1. 서론
현재 전 세계 수산물 생산량의 약 35%는 부산물로 발생되어 다양한 해양 환경오염 유발, 폐기물 처리 비용 등 부수적 비용을 유발시키고 있다. 이에 우리나라의 경우 해양수산부산물을재활용할 수 있는 정책을 수립하고 있으며, 식품, 화장품 및 의약품 등의 용도로 활용할 수 있는 연구개발을 적극 추진하고 있다(Ahn 등, 2021). 해양수산부산물 중 어류의 껍질에는 콜라겐 등 다양한 유용성분들이 함유되어 있으며, 콜라겐 추출 및 분리에 대한 연구 등이 많이 보고되고 있다. 또한, 해양생물 유래 콜라겐 및 펩타이드는 인체의 안전성 및 다양한 기능성이 검증되어 화장품, 기능성 식품, 의약품 등 원료로 다양하게 활용되고 있다(Cui 등, 2005; Kwon 등, 2007; Kwon 등, 2008).
콜라겐은 척추동물 및 무척추동물을 구성하는 섬유상 구조단백질로 인체 단백질 총중량의 30%를 차지하는 중요한 단백질이며, 특히 뼈와 피부(진피)에 함량이 높다(Jerome 등, 1998). 해양생물 유래 콜라겐에 대한 연구로는, 명태 껍질 유래 콜라겐의 추출 공정과 tyrosinase 저해 활성 및 주름 개선 효과(Yang 등, 2014), 동해 오징어 껍질 유래 콜라겐의 자외선에 대한 피부 보호 및 미백 효과(Kwon 등, 2008), 홍어 껍질 유래 콜라겐의 간 조직 지질축적 억제 효과(Lee 등, 2018) 등이 보고되고 있다. 콜라겐의 체내 흡수 효율을 높이기 위해서는 고분자 형태의 콜라겐을 직접 섭취하는 것보다 glycine-proline(Gly-Pro), proline-hydroxyproline (Pro-Hyp) 등과 같은 다이펩타이드 형태 또는 glycine-proline-hydroxyproline(Gly-Pro-Hyp, GPH)과 같은 트리펩타이드의 함유량이 높은 저분자 콜라겐 가수분해물을 섭취하는 것이 체내에 흡수되어 혈류를 통한 조직으로의 빠른 분포를 돕는다고 보고되고 있다(Hong 등, 2019; Iwai 등, 2005; Ohara 등, 2010; Yamamoto 등, 2016). 최근 저분자 콜라겐 펩타이드를 이용한 생리활성 연구로는 피부 광노화 예방(Kim 등, 2019), 피부 보습 개선 및 항주름 효과(Kim 등, 2018; Kim 등, 2022), 피부 장벽 보호 효과 등이 보고되고 있다(Kim 등, 2011). 특히 콜라겐 트리펩타이드 중에서 GPH 구조가 체내에 가장 흡수가 잘되어 혈액에 흡수되는 혈중 농도가 가장 높고, 체내에서도 안정적으로 존재한다고 보고되고 있으며(Yamamoto 등, 2016), UVB 조사 후 감소된 collagen 1A의 발현을 회복시켜 콜라겐 합성을 증가시키는 데 영향을 주는 것으로 보고되고 있다(Kim 등, 2018). 또한, GPH는 콜라겐 등의 조직 성분을 합성하는 섬유아세포의 증식 및 히알루론산 등의 생산을 촉진하는 유용물질이며 생체 이용성이 높다는 연구들이 보고되고 있다(Kim 등, 2018; Ohara 등, 2010). 이에 따라 AP 콜라겐 효소분해 펩타이드, collative 콜라겐 펩타이드 등 피부 건강 개별인정형 건강기능식품의 원료의 기능(지표) 물질을 GPH로 표준화하고 있다(MFDS, 2016a).
콜라겐 펩타이드는 고분자의 콜라겐을 효소 처리와 같은 방법으로 분해시켜 평균 분자량 1,000-5,000 Da 정도까지 저분자화시킨 단백질 가수분해물로, 최근 질량분석법을 이용한 콜라겐 펩타이드 분석법이 보고되고 있다(Kim 등, 2018). Kumazawa 등(2016)은 high performance liquid chromatography-triple quadrupole linear ion trap tandem mass spectrometer(HPLC-QTRAP MS)를 이용하여 6종의 동물(소, 말, 돼지, 양, 염소, 사슴) 원료를 판별하기 위한 콜라겐 마커 펩타이드 분석법을 확립하였으며, 가다랑어(Katsuwonus pelamis) 뼈의 콜라겐을 트립신과 키모트립신으로 가수분해하여 얻은 펩타이드의 아미노산 서열(SSGPPVPGPMGPMGPR)이 liquid chromatography coupled with electrospray-ionization quadrupole time-of-flight mass spectrometer(LC-ESI-QTOF-MS) 분석에 의해 보고되었다(Ding 등, 2019). 또한 눈다랑어(Thunnus obesus) 껍질 콜라겐 펩타이드 중 항산화 활성이 가장 높은 분획의 아미노산 서열이 LC-Q-Orbitrap-MS로 분석되었으며(Devita 등, 2021), 기능 식품의 주요 공급원인 여러 어종에서 어피 추출물과 어피 젤라틴의 LC-MS/MS 분석을 통하여 콜라겐 1α3을 식별하는 분석법이 보고되었다(Kleinnijenhuis 등, 2022).
홍어는 한국, 일본 및 중국의 북서부 태평양에서 발견되는 어류로, 특유의 냄새로 인해 어육 부분만 섭취하고 홍어 무게의 약 30%가 부산물로서 버려지고 있다(Baek 등, 2016). 홍어 가공 중 폐기되는 부산물인 어피, 어골, 내장 등은 별도의 과정 없이 대부분 폐기처리 되고 있어, 순환자원임에도 자원의 효율적인 활용이 이루어지지 않을 뿐 아니라 환경오염을 유발하고 있다(Park 등, 2011). 최근 홍어 부산물을 의약품, 건강기능식품 및 기능성화장품 원료 등 고부가가치 산업화 소재로 활용하기 위한 연구개발 등이 진행되고 있다. 그 대표적인 예로 홍어 연골로부터 콘드로이틴 황산의 추출에 관한 연구(Jeong, 2016), 홍어껍질로부터 정제된 젤라틴의 항균성에 관한 연구(Cho 등, 2006) 및 홍어껍질 콜라겐의 분자량에 관한 연구 등이 보고되고 있다(Hwang 등, 2007).
기능성 화장품, 건강기능식품 등 고부가가치 제품을 개발하기 위해서는 원료의 표준화 및 규격화가 매우 중요하며, 지표성분에 대한 분석법은 공인된 방법을 사용하여 타당성과 신뢰성을 갖는 과학적인 검증이 필요하다. 현재 홍어 콜라겐 펩타이드에 대한 항염증(Jeong 등, 2018), 산화억제 효과(Kang 등, 2012), 간 지질축적 억제 효과 등 효능 평가에 대한 연구들은 보고되고 있으나(Lee 등, 2018), 지표성분 분석 및 분석법에 대한 직선성, 정확성, 정밀성, 검출한계, 정량한계 등의 유효성 검증에 대한 연구는 보고되어 있지 않다.
따라서 본 연구에서는 홍어 가공 시 발생되는 부산물인 홍어 껍질 유래 콜라겐 펩타이드를 기능성 화장품 원료로 활용할 목적으로, 원료 표준화를 위해 GPH 정량분석 및 분석법에 대한 유효성을 검증하는 밸리데이션을 확립하였으며, 항산화, UV에 의한 피부 각질세포 사멸 억제 등 생리활성을 조사하였다.
2. 재료 및 방법
본 연구에 사용된 홍어 껍질 콜라겐 펩타이드는 ㈜영산홍어(Naju, Korea)에서 공급받아 사용하였다. HPLC 분석에 사용한 이동상 용매는 모두 HPLC급으로 J.T Baker (Pillipsburg, NJ, USA)사의 제품을 사용하였고, UPLC-MS 분석용으로 trifluoroacetic acid, formic acid, acetonitrile은 Thermo Fisher Scientific(Waltham, MA, USA)사의 제품을, water, methanol, 2-propanol은 Sigma-Aldrich(St. Louis, MO, USA)사의 제품을 사용하였다.
Gly-Pro-Hyp(Bachem, Bubendorf, Switzerland) 10 mg을 정밀하게 달아 10 mL 증류수에 녹여 1 mg/mL가 되도록 표준용액 stock을 제조하였다. 조제된 stock solution은 4°C에 보관하면서 사용 전에 증류수로 희석하여, 1.0, 2.5, 5.0, 10, 25, 50 μg/mL로 한 액을 검량선용 표준용액으로 사용하였다.
홍어 껍질 콜라겐 펩타이드 50 mg을 정밀하게 달아 50 mL volumetric flask에 넣고, 증류수를 50 mL 표선에 맞추어 1,000 μg/mL 농도의 시험용액을 조제하였다. 시험용액은 0.45 μm syringe filter로 여과하여 사용하였다.
Waters ACQUITY UPLC system(Waters Co., Milford, MA, USA)에 부착된 PDA eλ detector(Waters Co.)와 SYNAPT G2-Si QTOF mass spectrometer(Waters Co.)를 이용하여 펩타이드 분석을 수행하였다. 컬럼은 ACQUITY UPLC BEH C18(2.1 mm×100 mm, 1.7 μm)을 사용하였고, 시료는 5 μL 주입하였다. 컬럼 온도 30°C에서 0.1% formic acid (A)와 acetonitrile (B)를 사용하여 이동상 B가 2%인 조건으로 유속 0.2 mL/min을 적용하여 10분간 등용매 용리하였다. PDA는 210-400 nm 파장에서 스캔하였고, QTOF-MS 분석은 ESI source의 positive ion mode에서 분석하였으며, 이온 source와 desolvation 온도는 각각 120과 300°C로 유지하였다. Capillary voltage는 3 kV, cone voltage는 40 V에서 분석하였고, desolvation과 cone gas의 유속을 각각 600과 50 L/h로 설정하였다. 데이터의 재현성 및 정확도를 보정하기 위해 lock mass 용액으로 leucine-enkephalin ([M+H]+=m/z 556.2771)을 사용하였으며, 질량값 스캔 범위는 50-600 Da으로 설정하였다. 모든 MS 데이터는 MSE mode로 분석하였고 UNIFI(v1.9.4, Waters Co.) 소프트웨어를 이용하여 질량분석 데이터를 수집하고 펩타이드를 동정하였다.
HPLC는 Waters HPLC system e2695, PDA detector는 Waters 2998 PDA, 컬럼은 Jupiter® 4 μm Proteo 90Å(4.6 mm×250 mm, 4 μm)을 이용하여 분석을 진행하였다. 이동상은 0.1% trifluoroacetic acid(A)와 acetonitrile/ methanol(1:4 v/v, B), 유속은 0.3 mL/min, 컬럼 온도는 40°C로 유지하고 시료 10 μL를 주입하여 검출파장 214 nm에서 분석하였으며, 이동상 B가 5%인 조건으로 25분간 등용매 용리하였다.
홍어 콜라겐 펩타이드의 기능성 화장품 원료 표준화를 위해 선정된 지표성분에 대하여 분석법 밸리데이션을 실시하였다. 지표성분인 GPH의 함량을 측정하기 위해, 확립된 분석조건이 신뢰성 있는 결과를 얻을 수 있는지 검증하기 위하여 식품의약품안전처의 ‘식품 등 시험법 마련 표준절차에 관한 가이드라인’, ‘의약품 등 시험방법 밸리데이션 가이드라인’에 따라 특이성(specificity), 직선성(linearity), 검출한계(limit of detection) 및 정량한계(limit of quantitation), 정확성(accuracy), 정밀성(precision), 용액안정성(solution stability)을 평가하여 분석방법의 유효성을 검증하였다(MFDS, 2015; MFDS, 2016b).
Blank(증류수), 표준용액(25 μg/mL), 시험용액(1,000 μg/mL)을 조제한 뒤 0.45 μm syringe filter로 여과하여 분석에 사용하였다. 특이성 분석은 액체크로마토그램상에서 분석대상 물질인 GPH에 대한 간섭현상이 없는지 확인하였고, 표준용액과 시험용액의 피크 머무름 시간(retention time)을 비교하여 동일성을 확인하였다.
GPH 표준용액을 증류수로 단계별(1.0, 2.5, 5.0, 10, 25, 50 μg/mL) 희석하여 HPLC 분석 후 얻은 피크 면적과 주입 농도에 대한 검량선을 작성하고, 검량선의 상관계수(R2)값을 확인하였다.
직선성 검증을 통해 얻은 검량선의 기울기 평균값과 y절편의 표준편차에 근거하는 방법을 사용하였으며, 다음 식에 대입하여 검출한계(limit of detection, LOD)와 정량한계(limit of quantitation)를 산출하였다.
LOD = 3.3 × (SD/Slope of calibration curve)
LOQ = 10 × (SD/Slope of calibration curve)
SD: standard deviation of the response
시험용액에 이미 알고 있는 양의 GPH(10, 15, 25 μg/mL)를 첨가하여 동일한 분석조건으로 분석하였으며, 실제 첨가된 이론 농도값에 대한 검량선을 이용하여 구한 측정값의 회수율(%)로 나타내어 정확성을 평가하였다.
홍어 껍질 콜라겐 펩타이드에 함유된 지표성분인 GPH 함량을 분석하기 위해 1 mg/mL 농도의 시료를 3회 반복 분석하였으며, 표준용액을 분석하여 작성된 검량선에 의해 GPH 함량을 측정하였다.
시료의 DPPH 라디칼 소거활성 측정은 DPPH 용액 180 μL에 시료 20 μL를 혼합하여 상온에 30분 방치하였다. 방치한 용액을 SpectraMax® i3x Multi-Mode Detection Platform(Molecular Devices, San Jose, CA, USA)을 이용하여 517 nm에서 흡광도를 측정하였다. 대조군은 ascorbic acid(Sigma-Aldrich)를 사용하였다. 시료의 ABTS 라디칼 소거능 측정은 7 mM ABTS(Sigma-Aldrich)와 2.45 mM의 potassium persulfate(Sigma-Aldrich)를 1:1로 첨가하여 암소에서 24시간 반응시킨 후, 흡광도를 1.0으로 맞춘 뒤 혼합한 ABTS 용액 190 μL, 시료 10 μL를 혼합한 후 상온에서 7분간 암소에서 방치하였다. 방치한 용액을 SpectraMax® i3x Multi-Mode Detection Platform (Molecular Devices)을 이용하여 734 nm에서 흡광도를 측정하였다.
사람 피부각질세포(HaCaT)를 96-well microplate에 각 well당 5×104 세포가 되도록 접종하여 DMEM 배지(Gibco, Grand Islend, NY, USA)에 37°C의 조건에서 70-80% 정도 자랄 때까지 배양하였다. 그 후 혈청이 없는 DMEM 배지로 교체하고 UV를 30 mJ/cm2 처리하여 콜라겐 분해를 유발하였다. 시료를 농도별로 처리한 다음 24시간 동안 무혈청 배지에서 추가로 배양하였다. 24시간 배양 후, EZ-Cytox cell viability assay 시약(DoGen, Seoul, Korea)인 water soluble tetrazolium salt(WST)를 10 μL씩 넣고 37°C, 5% CO2에서 4시간 동안 배양 후 450 nm에서 흡광도를 측정하였다.
3. 결과 및 고찰
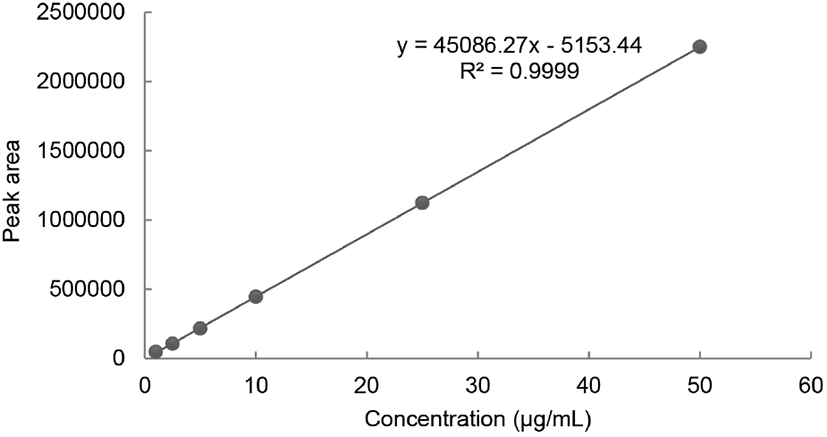
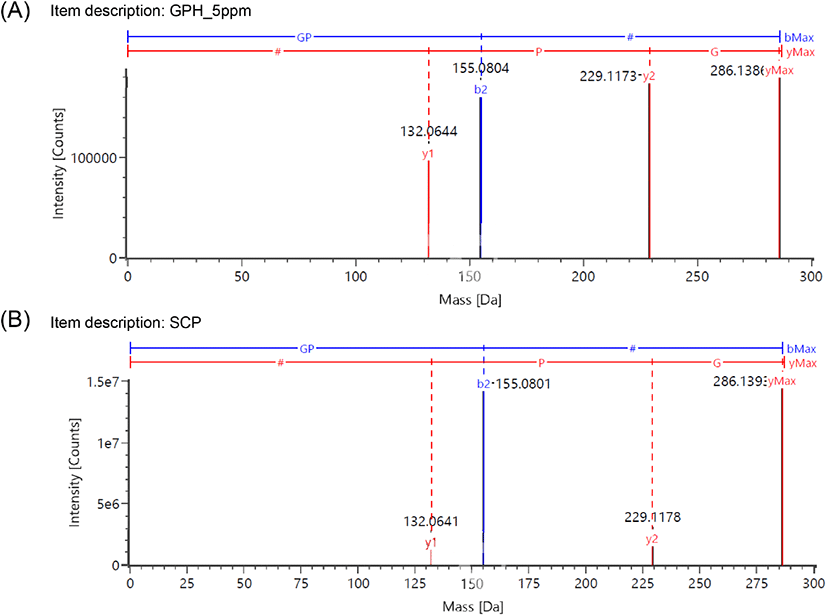
본 연구에서는 최근 규명된 콜라겐 펩타이드 기능성 원료의 지표성분 정보를 토대로 UPLC QTOF-MS를 사용하여 홍어 껍질 콜라겐 펩타이드 지표성분의 분자량 확인 및 아미노산 서열 분석을 실시하였다(Kim 등, 2018; Kim 등, 2022; Lee 등, 2021; MFDS, 2016a). GPH는 콜라겐 저분자 가수분해물 소재의 개별인정형 기능성 원료의 지표성분으로 사용되고 있으며, 피부 보습에 효능을 갖는 물질로 히알루론산의 생산을 촉진한다고 알려져 있다(Kim 등, 2018). 또한 광어(Paralichthys olivaceus) 껍질 가수분해물, 틸라피아(Oreochromis mossambicus) 어피 가수분해물, 실꼬리돔(Nemipterus virgatus)의 비늘로부터 얻은 원료의 지표성분으로서 콜라겐 트리펩타이드인 GPH가 보고되었다(Kim 등, 2018; Kim 등, 2022; Lee 등, 2021). 홍어 껍질 콜라겐 펩타이드 시험용액과 지표성분으로 예상되는 GPH(분자량: 285 Da) 표준용액을 UPLC-QTOF MS로 분석한 결과, 크로마토그램에서 피크 머무름 시간이 1.79분으로 일치하였으며, 모분자량은 각각 m/z 286.1393 [M+H]+과 286.1394 [M+H]+로 측정되었다(Fig. 1). MS fragment ion을 통해 아미노산 서열을 분석한 결과, GPH 표준용액과 홍어 콜라겐 펩타이드의 N-말단으로부터 b2 (Gly-Pro, m/z 155), bMAX(Gly-Pro-Hyp, m/z 286), C-말단으로부터 y1(Hyp, m/z 132), y2(Pro-Hyp, m/z 229), yMax(Gly-Pro-Hyp, m/z 286) 값을 얻었고, 이를 통하여 3개의 아미노산과 아미노산 서열을 확인할 수 있었다(Fig. 2). 일반적으로 콜라겐의 아미노산 조성은 Gly-X-Y 배열이 반복되는 특징을 가지고 있으며, type에 따라 다소 차이가 있으나 glycine이 전체의 1/3, proline이 1/4, hydroxyproline이 1/7 정도 차지하고 있다(Bailey 등, 1989). 홍어 껍질 콜라겐 펩타이드의 유리 아미노산 함량은 glycine, hydroxyproline, proline이 각각 19.32%, 16.25%, 12.35%로 아미노산 중 세 잔기의 함량이 가장 높게 보고되었으며, 전형적인 콜라겐 단백질의 특성을 나타내었다(Baek 등, 2016). 본 연구에서는 UPLC QTOF-MS 분석 결과를 바탕으로 홍어 껍질 콜라겐 펩타이드에서 GPH를 확인하고 이를 지표성분으로 선정하였다. GPH의 함량 분석을 위하여 범용화된 장비인 HPLC/PDA를 이용하여 지표성분의 정량분석법을 확립하고, 타당성을 검증하기 위하여 특이성, 직선성, 범위, 검출한계, 정량한계, 정확성, 정밀성, 용액 안정성의 8개 항목에 대한 분석법 밸리데이션을 수행하였다.
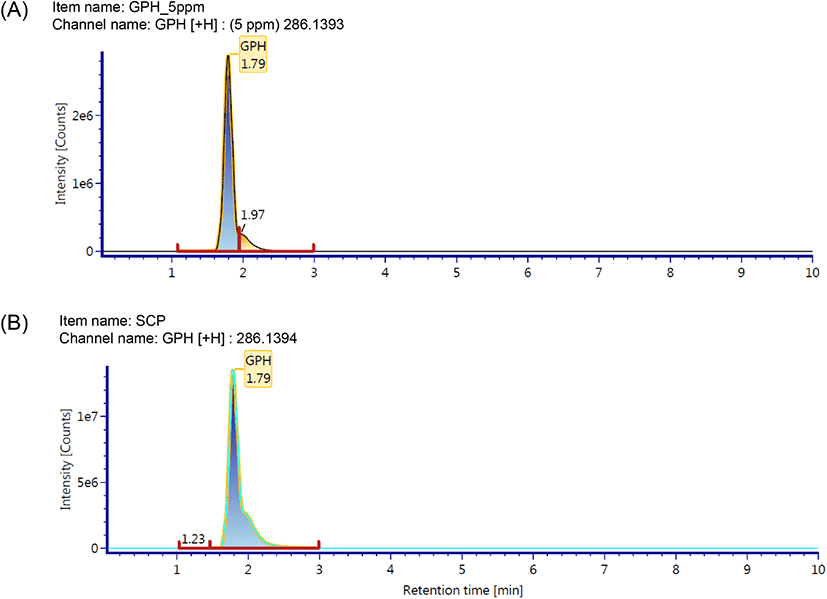
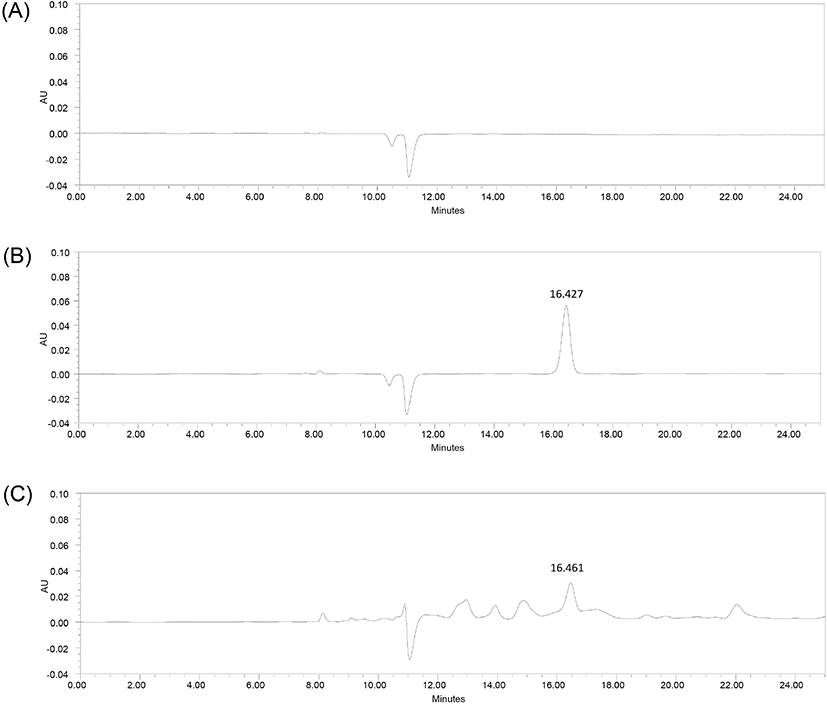
홍어 껍질 유래 콜라겐 펩타이드에서 GPH의 선택적 분석이 가능한지를 확인하기 위하여 표준용액 및 시험용액 지표성분의 HPLC 크로마토그램을 확인하였다. 그 결과 GPH 지표성분이 다른 물질의 간섭 없이 단일한 피크로 분리되었으며, 표준용액과 시험용액의 GPH 피크 머무름 시간이 약 16.4분으로 일치하였다(Fig. 3). 또한, PDA spectrum을 측정한 결과에서 표준물질인 GPH와 시험용액의 spectrum이 210-400 nm에서 동일한 패턴을 나타내어 본 시험법의 특이성을 검정하였다.
GPH 표준용액을 증류수로 희석하여 최종농도 1.0, 2.5, 5.0, 10, 25, 50 μg/mL로 직선성 농도 범위를 설정하였다. 각 농도별로 조제한 표준용액을 HPLC로 분석하여 피크 면적에 대한 농도의 관계를 나타내는 표준검량선을 작성하였으며(Table 1), 검량선의 상관계수(R2)는 0.9999 이상의 높은 직선성을 보였다(Fig. 4). Kim 등(2022)은 HPLC를 이용하여 광어 껍질 펩신 가수분해물에서 GPH를 정량한 바 있으며, 정량 표준곡선 작성을 위해 50-500 μg/mL의 농도 범위로 표준용액을 분석하였고 직선성을 나타내는 R2값은 0.9984로 보고되었다. 이는 본 연구에서 분석법 밸리데이션의 직선성 평가 결과로 측정된 R2값보다 낮은 수치이다.
| Standard | Concentration range (μg/mL) | Regression equation | R2 | LOD (μg/mL) | LOQ (μg/mL) |
|---|---|---|---|---|---|
| GPH | 1-50 | y = 45086.3x + 986.8 | 0.9999 | 0.07 | 0.22 |
검출한계 및 정량한계는 GPH 표준용액을 HPLC로 3회 반복 측정하여 얻은 검량선의 y절편의 표준편차를 기울기로 나눈 값의 3.3배를 검출한계, 10배를 정량한계로 계산하였다. 그 결과 검출한계는 0.07 μg/mL, 정량한계는 0.22 μg/mL 수준으로 나타났다(Table 1). 이는 홍어 껍질 유래 콜라겐 펩타이드의 표준화를 위해 설정된 지표성분의 분석을 위한 검출한계와 정량한계를 검증한 것으로, GPH 함량 측정에 활용이 가능할 것으로 사료된다.
정확성은 측정값이 이미 알고 있는 참값이나 표준값에 근접한 정도를 의미하며, 검량선 범위 내 분석물질 함량의 3가지 이상의 농도를 첨가하여 3회 이상 반복 측정하고 회수율을 산출하여 평가한다(MFDS, 2015; MFDS, 2016b). 시험용액(1,000 μg/mL)에 분석대상물질인 GPH를 3가지 농도(10, 15, 25 μg/mL)로 첨가하여 각 3회씩 분석한 결과, Table 2에 나타난 바와 같이 평균회수율은 각각 103.76, 100.35, 103.97%로 전체 평균회수율은 102.70%이며, 상대표준편차(RSD)는 모든 농도에서 2.0% 이하를 나타내었다. 정확성의 검증 시 분석대상물질 이외의 시료 중에 존재하는 기질의 영향을 고려해야 하며, 이는 분석대상성분의 검출을 방해하거나 회수율에 영향을 준다(MFDS, 2015). 본 연구에서는 평균회수율 102.70%로 100% 회수율에 가까운 수치를 나타냈으며 AOAC 기준에 적합함을 확인하였다(AOAC, 2019).
| Concentration (μg/mL) | Recovery1) (%) | RSD2) (%) |
|---|---|---|
| 10 | 103.76±1.65 | 1.59 |
| 15 | 100.35±1.52 | 1.52 |
| 25 | 103.97±0.14 | 0.14 |
정밀성은 반복성과 재현성 시험으로 평가하였다. 반복성 시험에서는 3개의 검체량(40, 50, 60 mg)으로 조제한 시험용액에 대해 전 조작을 5회 반복하여 분석한 측정값의 RSD값을 산출하였으며, 검체량별로 각각 0.90, 0.56, 0.67%로 AOAC 기준(AOAC, 2019; MFDS, 2022)인 상대표준편차 2.7% 내의 결과를 확인하였다(Table 3). 재현성 시험은 실험실 내 정밀성에 영향을 주는 시험일, 시험자, 시험장비 등을 서로 다르게 적용하여 측정하는 방법이다(MFDS, 2015; MFDS, 2016b). 먼저 시험일을 달리하여 분석한 결과, 각 일자에서 GPH의 평균 함량은 13.70과 13.36 mg/g, 전체 측정값에 대한 RSD는 1.40%로 분석되었다. 시험자 및 장비를 달리하여 분석한 결과, GPH의 평균 함량은 각각 13.70과 13.32 mg/g, 전체 측정값에 대한 RSD는 1.52%로 AOAC 재현성 기준(AOAC, 2019; MFDS, 2022)인 RSD 4.0% 내의 결과로 적합함을 확인하였다(Table 4).
| Amount of sample (mg) | Measured content of GPH1) (mg/g) | RSD2) (%) |
|---|---|---|
| 40 | 13.60±0.12 | 0.90 |
| 50 | 13.70±0.08 | 0.56 |
| 60 | 13.44±0.09 | 0.67 |
상온 및 냉장조건에서 수용액 상태인 시료의 안정성을 확인함으로써 시험에 소요되는 시간동안 실험실 환경에서 검액의 안정성이 유지되는지 검토하였다. HPLC 분석 시 대부분 자동주입장치(auto sampler)를 이용하여 밤새도록 검액을 주입하여 분석하므로, 전처리와 용액 보관에 24시간 이상의 많은 시간이 필요한 경우 검액의 안정한 기간을 설정해야 한다(MFDS, 2015). 본 연구에서는 조제한 검액을 보관하면서 0, 24, 48, 72시간 동안 표준용액과 시험용액의 안정성을 평가하였으며, 그 결과는 Table 5와 같다. 상온 및 냉장조건에서 큰 차이를 보이지 않았으며, 피크면적의 변화는 1% 이하로 72시간 동안 안정한 것을 확인하였다. 시험용액의 안정성 인자의 검증을 통하여 개발된 분석법이 GPH의 정량분석에 적용 가능한 재현성이 있음을 확인하였다.
Bars (−) indicate no significant % difference between HPLC peak areas.
검증된 분석법을 기반으로 홍어 껍질 콜라겐 펩타이드 시료 중에 함유된 GPH 함량을 분석하였다. 50 mg의 시료를 정밀하게 취하여 증류수에 녹여 50 mL로 조제한 용액을 3회 반복하여 분석하였을 때 홍어 콜라겐 펩타이드 중에는 13.51±0.03 mg/g의 GPH가 함유되어 있음을 확인하였다(Table 6). Kim 등(2022)에 따르면 광어 껍질 pepsin 가수분해물에서 지표물질 GPH 함량은 156.12 μg/g으로 보고되었으며, 본 연구에서 측정된 홍어 껍질의 GPH 함량보다 80배가량 낮은 수치였다. 반면, 틸라피아 어피의 저분자콜라겐 가수분해물에는 GPH 함량이 3.2%로 보고되었다(Kim 등, 2018). 이는 가수분해물의 분리 및 정제 방법을 최적화하여 콜라겐 펩타이드 내 지표물질의 함량을 높일 수 있을 것으로 사료된다. 본 연구를 통해 홍어 껍질 콜라겐 펩타이드의 지표성분인 GPH의 정량분석에 있어 범용성이 높은 장비인 HPLC/UV법을 적용하여 간편하게 정량할 수 있는 분석방법을 개발하였고 그 타당성을 검증하였다. 이러한 결과를 토대로 기능성 원료로서 홍어 콜라겐 펩타이드 원료의 표준화를 통한 품질관리 기준 설정 및 모니터링에 활용 가능할 것으로 사료된다.
| Standard | Content1) (mg/g) | RSD2) (%) |
|---|---|---|
| GPH | 13.51±0.03 | 0.22 |
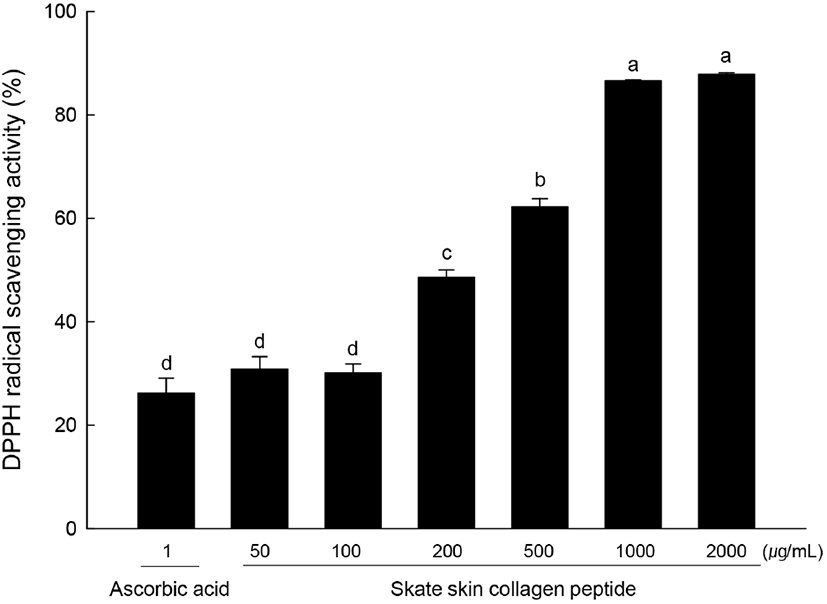
홍어 껍질 콜라겐 펩타이드에 대한 DPPH 라디칼 소거능을 분석한 결과는 Fig. 5와 같다. 양성대조군인 ascorbic acid(1 μg/mL)에서 26.19%의 DPPH 라디칼 소거능을 나타낸 반면, 홍어 껍질 콜라겐 펩타이드 2,000, 1,000, 500, 200, 100, 50 μg/mL에서 각각 87.89, 86.57, 62.20, 48.53, 30.12, 30.82%를 보였다. 양성대조군에 비해 200 μg/mL 이상의 농도를 처리하였을 때 유의적으로 큰 소거능을 나타내었다. 홍어 껍질 콜라겐 펩타이드에 대한 ABTS 라디칼 소거능을 분석한 결과는 Fig. 6과 같다. 양성대조군인 ascorbic acid(20 μg/mL)에서 9.23%의 ABTS 라디칼 소거능을 나타낸 반면, 홍어 껍질 콜라겐 펩타이드를 농도별로 첨가하였을 때 ABTS 라디칼 소거능은 2,000, 1,000, 500, 200, 100, 50 μg/mL에서 각각 20.7, 13.85, 5.64, 4.21, 3.25, 1.12%로 나타났다. 양성대조군에 비해 2,000 μg/mL에서 가장 큰 소거능을 나타낸 것으로 확인되었다. Choi 등(2003)은 홍어 부위별 발효과정 중의 100°C 열수 추출물에 대한 DPPH 라디칼 소거능을 측정하였으며, 추출물 1% 첨가 시 홍어 가식부는 33.6%, 내장은 48.8%, 연골 추출물은 16.7%의 전자공여작용을 보였다고 보고하였다. 또한, DPPH에 대한 홍어 껍질 물 추출물의 라디칼 소거능은 상온 추출물과 50°C 추출물에서 각각 70.0%와 73.6%로 측정되었으며(Kang 등, 2012), 본 실험 결과는 이보다 높은 항산화 활성을 나타내었다. 이는 홍어 껍질의 물 추출물보다 열수 추출 후 가수분해 효소를 이용하여 제조과정을 거친 콜라겐 펩타이드에서 더 높은 항산화 활성을 나타냄을 알 수 있으며, 분리 및 정제를 통해 활성 성분의 함량이 추출물보다 콜라겐 펩타이드에서 높아졌기 때문으로 사료된다. Lee 등(2009)은 어류비늘 콜라겐 펩타이드의 DPPH 라디칼 소거능을 평가한 결과 100, 500 μg/mL에서 각각 94.2, 91.5%였다고 보고해 본 연구의 결과와 유사하였다. 홍어껍질 콜라겐 펩타이드에 대한 기능성 연구는 항고혈압 효과(Ngo 등, 2015), 항치매 효과(Lee 등, 2015)가 보고되었다.

홍어 껍질 콜라겐 펩타이드가 HaCaT 세포의 생존율에 미치는 영향을 평가한 결과, 시료를 처리하지 않은 무처리군에 비해 2,000 μg/mL의 콜라겐 펩타이드를 처리한 군에서 120.02%로 유의적으로 세포증식이 증가한 것을 확인하였다(Fig. 7(A)). 이는 시료가 고농도에서 독성을 보이지 않고 세포증식을 촉진시킨 것으로 사료된다. 또한, HaCaT 세포에 30 mJ/cm2 UV를 처리하였을 때, UV를 조사하지 않은 대조군에 비해 UV 조사군에서 약 43.08%로 세포 생존율이 감소하였으나, UV 조사 후 2,000 μg/mL의 콜라겐 펩타이드를 처리한 군에서 세포 생존율이 28.84% 감소됨을 확인하였다(Fig. 7(B)). 이로부터 UV 조사에 의한 피부의 손상을 홍어 껍질 콜라겐 펩타이드가 개선할 수 있을 것으로 사료되며, 콜라겐 펩타이드의 자외선에 의한 피부 손상 억제 작용기작이 연구되어야 할 것으로 보인다. Kwon 등(2008)은 오징어 (Todarodes pacificus) 껍질 유래 콜라겐의 UV 보호능을 측정하였으며, 진피 섬유아세포에 처리 시 UV에 의해 야기되는 MMP-1의 발현을 저해시켜 피부에서 교원질의 파괴를 감소시킨다고 보고되었다. Kim 등(2018)은 피부 섬유아세포에 UV 조사 후 틸라피아 어피의 콜라겐 펩타이드 처리에 따른 피부 보습효과를 측정한 결과 세라마이드 키나아제와 히알루론산의 농도가 증가하였다고 보고하였다. 따라서 향후 홍어 껍질 콜라겐 펩타이드의 UV 조사에 의한 세포 보호효과를 바탕으로 보습 관련 인자에 대한 연구가 필요할 것으로 보인다.

이러한 연구 결과를 토대로 홍어 껍질 콜라겐 펩타이드는 항산화 활성 및 UV에 의한 피부 세포 보호효과를 나타내어 산업적으로 활용 가능성을 확인하였다. 또한, 검증된 HPLC 분석법을 이용하여 지표물질인 GPH로 규격화된 기능성 소재 개발이 가능할 것으로 사료된다.