1. 서론
염증반응은 외부 자극원에 의한 다양한 조직 손상 및 감염 등에 대항하여 일어나는 방어 보호반응으로, 조직의 항상성을 유지하기 위해 일어나는 필수적인 조절반응이다(Kim 등, 2012). 염증은 작용하는 기간에 따라 급성(acute)염증과 만성(chronic) 염증으로 나눌 수 있으며, 특히 만성 염증이라고 불리는 지속적인 염증반응은 단핵구나 대식세포 림프구, 혈장 세포 등의 침윤을 동반하는 특징이 있으며, 조직을 파괴하고 비만, 동맥경화, 당뇨병, 관절염 및 암과 같은 각종 만성 염증성 질환을 유발한다(Gramlich와 Petras, 2007; Jang과 Lee, 2023). 이러한 염증반응에서 중요한 역할을 수행하는 세포 중 하나가 대식세포(macrophage)이며, 대식세포는 동물 체내 모든 조직에 분포하며 체내 선천적 면역반응을 담당하는 면역세포로서 외부로부터 침입한 이물질을 제거하고 종양세포 성장과 감염된 미생물의 성장을 제한하거나 세포사멸을 유도하는 역할을 한다(Guo 등, 2008; Yun 등, 2008).
대식세포는 interferon-γ(IFN-γ), interleukin-6(IL-6), interleukin-1β(IL-1β), tumor necrosis factor-α(TNF-α)와 같은 염증성 사이토카인과 그람음성균 내독소로 작용하는 세포막 성분인 lipopolysaccharides(LPS) 등의 자극에 노출됨으로서 활성화되며, 이 활성화된 대식세포는 inducible nitric oxide synthase(iNOS)와 같은 효소의 발현을 통해 nitric oxide(NO)와 같은 다양한 염증 매개체들을 생성하게 된다(Jang과 Lee, 2023). NOS에 의해 L-arginine으로부터 합성되는 NO는 정상적인 수준에서는 유해 세균의 제거나 종양을 억제하는 역할을 하지만, 과도한 양의 NO가 생성될 시 염증반응을 통해 조직과 신경 손상, 유전자 변이 등을 유발하는 것으로 알려져 있다.
NO를 포함한 다양한 염증성 사이토카인들은 염증반응과 밀접하게 관련되어 있어 이들 사이토카인의 합성을 저해할 수 있는 소재들이 염증 질환의 예방 및 치료제로서 주목받고 있다. 지금까지 개발된 항염증제는 크게 스테로이드계와 비스테로이드성 항염증제(NSAIDs)로 나눠지며, 이들 모두 염증반응의 주요 매개체인 prostaglandin의 생합성을 억제함으로써 항염증 작용을 나타내는 제제이다. 그러나 항염증제를 장기간 복용했을 때 위염, 신장염 및 심장질환 등을 초래함으로써 인체 안전성 면에서 문제점을 안고 있어, 그 사용이 일부 제한되고 있기에 상대적으로 부작용이 적은 천연물로부터 항염증제를 개발하기 위한 연구가 진행되고 있다(Cerella 등, 2010; Hink와 Munzel, 2006; Jang과 Lee, 2023).
세계 5대 건강식품으로 알려진 렌틸(lentil, Lens esculenta)은 한해살이 콩과(Fabaceae) 식물로 낮은 강수량을 보이는 건조한 기후에서도 잘 자라며, 주로 중동, 남아시아, 아프리카 등의 지역에서 주로 섭취하는 식품 중 하나이다. 렌틸의 종류는 그린(green), 프렌치(French), 레드(masoor dal red), 벨루가(beluga) 등 다양하며, 품종에 따라 씨앗의 색깔과 꽃의 색깔이 다르다(Thavarajah 등, 2009). 렌틸은 100g 섭취 기준 353 Kcal의 열량을 가지며 각종 미네랄, 비타민, 무기질이 함유되어있는 것으로 알려져 있으며, 일반 콩과 비교하여 지방 함량이 낮으면서 섬유소 함량이 높아 체중 감량, 콜레스테롤 저하 및 혈당을 유지하는 데 도움을 준다(Lee와 Lee, 2016). 최근 국내에서는 기능성 곡물이 저 칼로리이면서 단백질, 무기질, 필수아미노산 등의 영양 성분의 함량이 높은 것으로 알려지면서 기능성 수입 곡물의 수요가 증가하고 있다(Sung, 2015). 이외에도 phytic acid, saponin, flavanol, polyphenol 등 유용성분들을 다량 함유하고 있어 만성질환이나 심혈관 질환에 효과가 있다고 알려져 있다(Agil 등, 2013; Johnson 등, 2013).
렌틸의 간세포 보호 효과 연구 결과에서는 벨루가 렌틸이 세포 내 glutathione(GSH) 함량과 대표적인 catalase(CAT)와 glutathione reductase(GR)의 항산화 효소의 활성을 증가시킴으로써 산화적스트레스로부터 간세포를 효과적으로 보호하는 것을 확인하였다(Lee와 Lee, 2016). 또한, 품종별 렌틸 추출물의 폴리페놀 화합물 함량 및 항산화 활성 연구에서 벨루가, 그린, 레드, 프렌치 중 벨루가 렌틸이 높은 폴리페놀 함유 및 항산화 활성을 나타내는 것으로 확인되어 기능성 소재로서 벨루가 렌틸의 산업적 응용이 활발해질 것으로 예상된다(Lee와 Lee, 2016). 이처럼 벨루가 렌틸의 경우 간세포 보호 효과와 항산화 활성 등의 생리 활성에 대한 연구가 일부 진행된 바 있으나, 염증 작용에 대한 벨루가 렌틸의 영향은 현재 보고된 바 없다. 따라서 본 연구에서는 벨루가 렌틸 추출물을 이용하여 염증 유발 물질인 LPS에 의해 활성화된 RAW 264.7 세포에서 항염증 활성을 확인 후, 이와 관련된 기전을 규명하고자 하였다.
2. 재료 및 방법
Dulbecco’s modifies Eagle’s medium(DMEM) high glucose, fetal bovine serum (FBS)과 antibiotics(penicillin/streptomycin)는 Gibco BRL(Grand Island, NY, USA)로부터 구매하였다. LPS와 lipoteichoic acid(LTA)는 Sigma-Aldrich Co. Ltd.(St Louis, MO, USA)로부터 구매하였으며, 3-(3,4-dimethyl-thiazolyl-2)-2,5-diphenyl tetrazolium bromide(MTT) 시약은 Amresco (Solon, OH, USA)로부터 구매하였다. Western blotting 분석에 사용된 enhanced chemiluminescence(ECL) detection kit는 ATTO(WSE-7120s, Tokyo, Japan)로부터 구매하였고, Hybond-p PVDF transfer membrane는 Bio-Rad(Hercules, CA, USA)로부터 구매하였다. iNOS, NF-κB p65, MAP kinases(p44/42, SAPK/JNK, p38), HO-1, GAPDH 항체와 anti-rabbit IgG는 Cell Signaling(Danver, MA, USA)로부터 구매하였고, Nrf2 항체는 Santa Cruz Biotechnology(Santa Cruz, CA, USA)에서 구매하였다. RNA 추출을 위하여 사용한 Trizol 시약은 Invitrogen (Carlsbad, CA, USA)사에서 PCR primer는 Bioneer(Daejeon, Korea)사로부터 구매하였으며, 그 밖의 분석용 시약 및 유기용매는 모두 Sigma-Aldrich Co.로부터 구매하였다.
본 실험에 사용된 벨루가 렌틸은 Zürsun Idaho Heirloom Beans(Twin Falls, ID, USA)에서 구매하여 실험에 사용하였다. 벨루가 렌틸을 세척 한 후 분쇄하여 0.2% HCl이 함유된 80%(w/v) methanol을 10배량 가하여 24시간 동안 진탕 배양을 통해 3회 반복하여 추출하였다. 추출액은 여과지(Whatman No. 3, England)를 사용하여 여과하여 55°C에서 rotary vacuum evaporator(UNI TRAP UT-1000, Eyela Co., Tokyo, Japan)로 감압 농축한 후에 48시간 동결건조하였다. 추출물은 분말 상태로 -20°C에서 보관하면서 사용하였다.
RAW264.7 마우스 대식세포주는 한국 세포주 은행(KCLB, Seoul, Korea)에서 분양받아 사용하였다. RAW264.7 세포 배양은 10% FBS와 1% antibiotics가 첨가된 DMEM 배지를 이용하여 37°C incubator(5% CO2)에서 배양하였으며, 세포가 배양접시의 80% 정도 찼을 때 cell lifter를 이용하여 세포를 떼어낸 후 원심분리(125 ×g)하여 세포를 회수하였다.
지방세포인 3T3-L1 세포는 1×106 cells/well로 분주하고 100% 밀도(confluency) 상태에서 48시간 방치한 후 분화를 유도하기 위해 1 μmol/L dexamethasone, 5 mg/mL insulin, 0.5 mmol/L IBMX와 10% FBS와 1% antibiotics가 포함된 DMEM을 사용하여 5% CO2, 37°C incubator에서 48시간 동안 분화를 유도하였다. 분화 유도 후 2일마다 10% FBS, 5μg/mL insulin이 첨가된 배지로 교체하였으며, 6일차 때 RAW 264.7 세포를 transwell insert(8.0 μm pore membrane)에 3.5×105 cells/well로 분주하여 분화된 3T3-L1 지방세포와 24시간 동안 함께 배양하였다.
RAW 264.7 세포에 대한 추출물의 세포 독성은 Jang과 Lee (2023)의 방법에 따라 MTT assay를 이용하여 측정하였다. RAW 264.7 세포 3×105 cells/well을 48-well plate에 분주하고, 24시간 동안 배양 후 DMSO에 녹인 벨루가 렌틸 추출물을 농도별로 1시간 먼저 처리 후 LPS를 100 ng/mL 농도로 처리하여 20시간 배양하였다. 그 후 MTT 용액(2.5 mg/mL) 20 μL를 각 well에 처리하고 4시간 동안 추가 배양하였다. 배양 종료 후 상층액을 제거하고 각 well에 DMSO(250 μL)를 첨가하여 생성된 formazan 결정을 용해시킨 후 microplate spectrophotometer (Epoch, Biotek Instruments Co., Winooski, VT, USA)로 550 nm에서 흡광도를 측정하였다. 이때 세포 생존율은 시료를 처리하지 않은 대조군의 100% 생존율을 기준으로 처리군의 상대적인 세포 생존율(%)을 구하였다.
NO 생성량 측정은 Griess Reagent System(Promega Co., Madison, WI, USA)의 방법에 따라 RAW 264.7 세포(3×105 cells/well)를 48-well plate에 분주하여 24시간 배양한 후 벨루가 렌틸 추출물을 농도별로 1시간 먼저 처리한 다음 LPS(100 ng/mL)를 처리하여 24시간 배양하였다. 배양 상층액 50 μL를 96-well plate에 취하고, 여기에 동량의 Griess 시약을 넣어 10분간 반응시킨 후 540 nm에서 흡광도를 측정하였다. Nitrite의 농도(μM)는 NaNO2를 사용하여 얻은 표준 곡선(standard curve)을 이용하여 산출하였다.
조건별로 시료 처리가 완료된 세포를 PBS로 2회 세척한 후 100 μL의 lysis buffer를 첨가하여 30분 동안 용해 시킨 후 12,000 ×g, 4°C에서 15분간 원심분리하여 세포막 성분 등을 제거하였다. 단백질 농도는 bovine serum albumin(BSA)을 표준화한 Bio-Rad protein assay kit(Hercules, CA, USA)를 사용하여 정량하였다. 4°C에서 12,000 ×g으로 15분간 원심분리하여 얻은 상층액의 단백질을 정량한 후 8-10% running gel과 5% stacking gel을 이용하여 100 V에서 80분간 SDS-polyacrylamide gel 전기영동을 실시하였다. 전기영동으로 분리한 단백질은 100 V에서 60분간 transfer하였다. 단백질이 이동된 membrane은 5% skim milk로 blocking 하였다. 1차 항체의 발현 정도를 검토하기 위하여 5% BSA 용액에 1:1,000으로 희석하여 24시간 동안 4°C에서 반응시킨 후 PBST(phosphate buffered saline with Tween 20)로 3회 세척 하였다. 계속하여 2차 항체를 5% BSA 용액에 1:4,000으로 희석하여 4시간 반응 후 다시 PBST로 3회 세척하였다. 이후 membrane에 ECL detection kit의 발색시약 혼합액을 도포하고, X-ray film(CP-G plus, Agfa Healthcare Ltd, New Orleans, LA, USA)에 현상하였다.
Total RNA는 배양한 RAW 264.7 대식세포에서 시료 처리가 완료된 세포의 배지를 제거하고 PBS로 두 번 세척 한 후 TRI reagent를 사용하여 분리하였다. 분리한 RNA 300 μL와 1-bromo-3-chloropropane 60 μL를 혼합하여 실온에서 15분 방치한 후 원심분리(12,000 ×g, 10분, 4°C)하고, 새로운 tube에 RNA층만 분리하였다. 여기에 2-propanol 150 μL를 첨가하고 실온에 3분간 방치한 후 원심분리(12,000 ×g, 10분, 4°C)한 후 상층액을 제거하였다. 침전물에 70% ethanol을 첨가하여 이를 원심분리(12,000 ×g, 5분, 4°C) 후 상층액을 제거하고 RNA pellet을 공기 중에 정치시킨 다음, 건조된 RNA pellet을 diethyl pyrocarbonate(DEPC) 처리된 DW를 첨가하여 60°C 수조에서 10분간 반응하여 침전물을 용해시켰다. 분리된 total RNA는 microplate spectrophotometer를 이용하여 260/280 nm에서 농도 및 순도를 측정하였다. 분리된 total RNA 1 μg/μL와 oligo(dt) primer 1 μL를 혼합하여 총 부피가 12 μL 되게 한 후 DEPC 1 μL, 5X reaction buffer 4 μL, 10 mM dNTP mix 2 μL, RNAase inhibitor(20 unit/μL) 0.5 μL, reverse transcriptase 0.5 μL를 더해 42°C에서 60분간 반응시킨 후 70°C에서 5분 처리하여 cDNA를 합성하였다. Quantitative real-time PCR(qPCR)은 cDNA 2 μL, SYBR Green I dye 5 μL, DEPC 2.5 μL를 첨가하여 각각의 primer 0.5 μL를 가하고 초기 변성 95°C 30초, 변성은 95°C 5초, annealing은 60°C 30초로 하여 40 cycle 진행하였다. 여기에 사용된 primer는 Jang과 Lee(2023)의 연구에서 사용된 것과 같다.
Nrf2의 핵과 세포질 발현 양상을 시각적으로 확인하기 위해 면역형광염색법을 실시하였다. 배양된 세포는 phosphate buffered saline(PBS)로 세척 후 세포를 4% 포름알데히드로 15분 동안 실온에서 고정시켰다. 고정된 세포는 PBS로 3회 세척하고 계면활성제인 0.3% Triton X-100와 5% normal goat serum, 1X PBS, 1% BSA을 사용하여 암실에서 1시간 동안 blocking 과정을 수행하였다. 이후 PBS로 3회 세척하고 Nrf2 항체(1:500)와 4°C에서 24시간 동안 반응 후 다시 PBS로 3회 세척하고 fluorescein(FITC)가 결합된 2차 항체(1:2,000)와 상온에서 2시간 동안 반응시켰다. 반응된 끝난 세포는 PBS로 3회 세척 후 핵 대조염색을 위해 Fluoroshield mounting medium with DAPI (Abcam, Cambridge, UK) 용액과 함께 슬라이드글라스에 부착시켜 Zeiss Axioskop 50 형광현미경(Carl Zeiss, Jena, Germany)을 이용하여 이미지를 얻었다.
3. 결과 및 고찰
그람음성균 유래 내독소인 LPS는 대식세포의 활성화를 통해 NO를 포함한 다양한 염증 매개 물질을 생성하게 되며, 특히 과도하게 생성된 NO는 염증반응을 촉진 시키는 것으로 알려져 있다(Jang과 Lee, 2023; Kim과 Son, 2014). 본 실험에서는 BLE의 NO 생성 억제 효과를 알아보기 위하여 LPS가 처리된 RAW 264.7 대식세포에 BLE를 0.1-0.6 mg/mL의 농도로 전처리한 후 NO 저해 활성을 확인하였다. RAW 264.7 대식세포에 LPS를 처리한 결과, LPS 처리 전에 비해 NO 생성량이 27.20 ±0.67 μM로 약 5배가량 증가하였으나, BLE 처리 농도에 의존적으로 NO 생성량이 감소하여 최고 농도인 0.6 mg/mL에서 NO 생성량이 9.60±0.19 μM로 유의적인 감소를 보였다(Fig. 1A). Lee 등(2017)은 정금나무 추출물이 1 mg/mL에서 47.30%의 NO 저해율을 보였으며, Kim과 Kim(2016)은 아사이베리 추출물이 2 mg/mL의 농도에서 40.5%의 NO 저해율을 보였다고 보고하였다. 이들 결과와 비교할 때 0.6 mg/mL 농도에서 54.25%의 저해율을 보인 BLE가 상대적으로 우수한 NO 저해 활성을 가진 것으로 확인되었다. 반면, 대추 잎 분획물(Kim과 Son, 2014), 섬쑥부쟁이 추출물(Seo 등, 2023) 및 어수리 추출물(Jang과 Lee, 2023)에 비해서는 BLE가 유사하거나 상대적으로 낮은 NO 저해율을 보이는 것으로 나타났다.
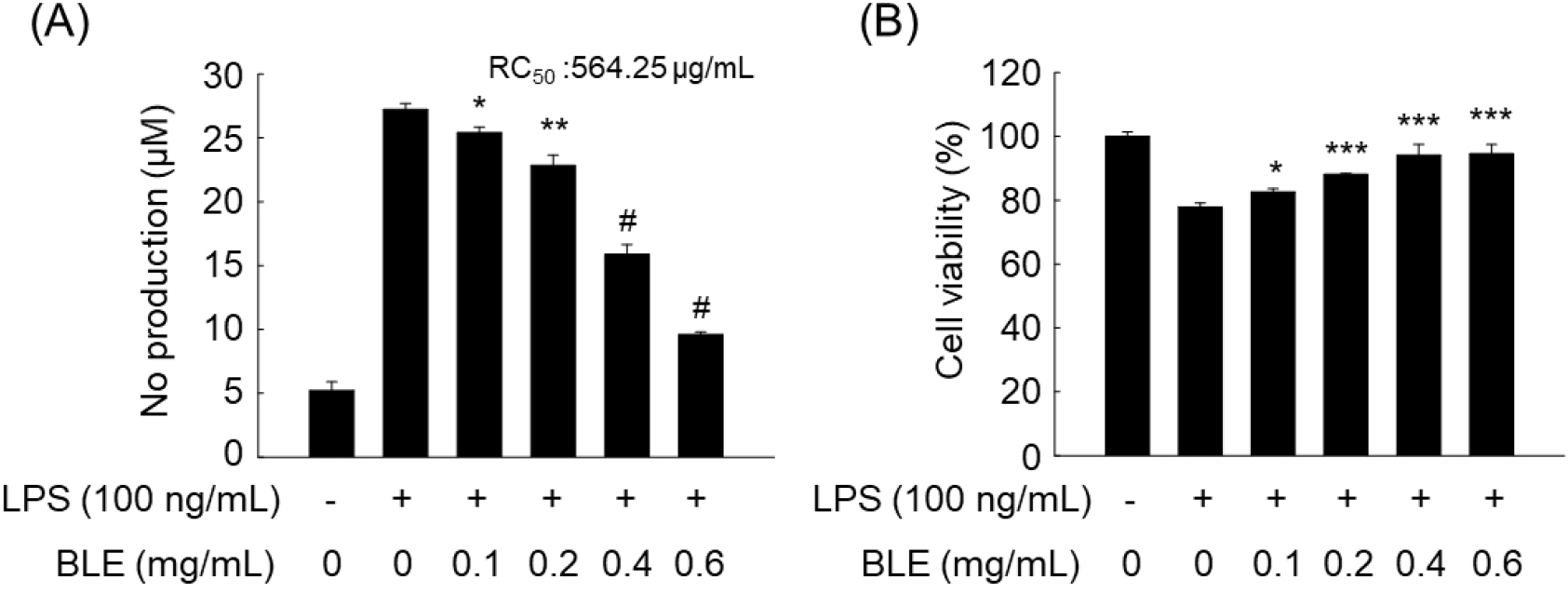
또한, BLE가 세포 생존율에 미치는 영향을 확인한 결과, 모든 농도에서 80% 이상의 세포 생존율을 보였으며 고농도로 갈수록 세포 생존율이 증가되는 양상을 보였다(Fig. 1B). 따라서 LPS에 의해 유도된 BLE의 NO 생성 저해 효과는 세포 생존율과 연관성이 낮으며 독성을 나타내지 않은 0.6 mg/mL를 최고 농도를 설정하여 다음 실험을 수행하였다.
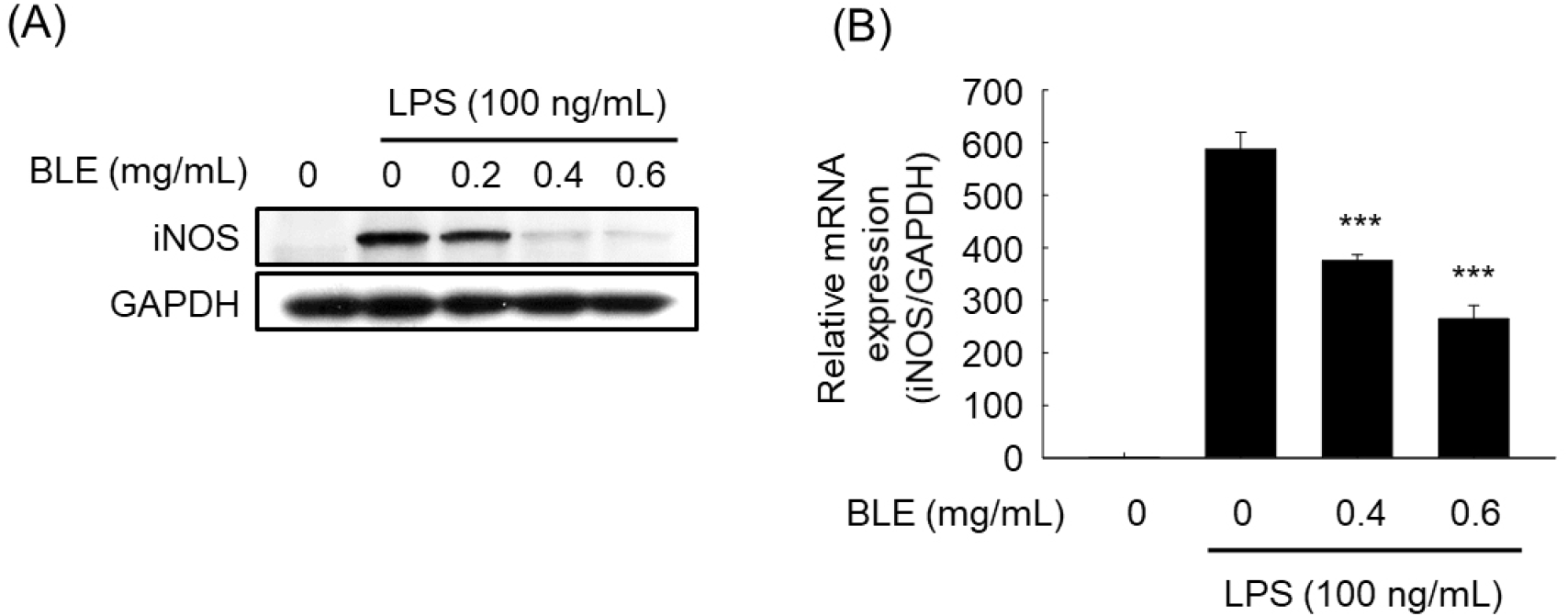
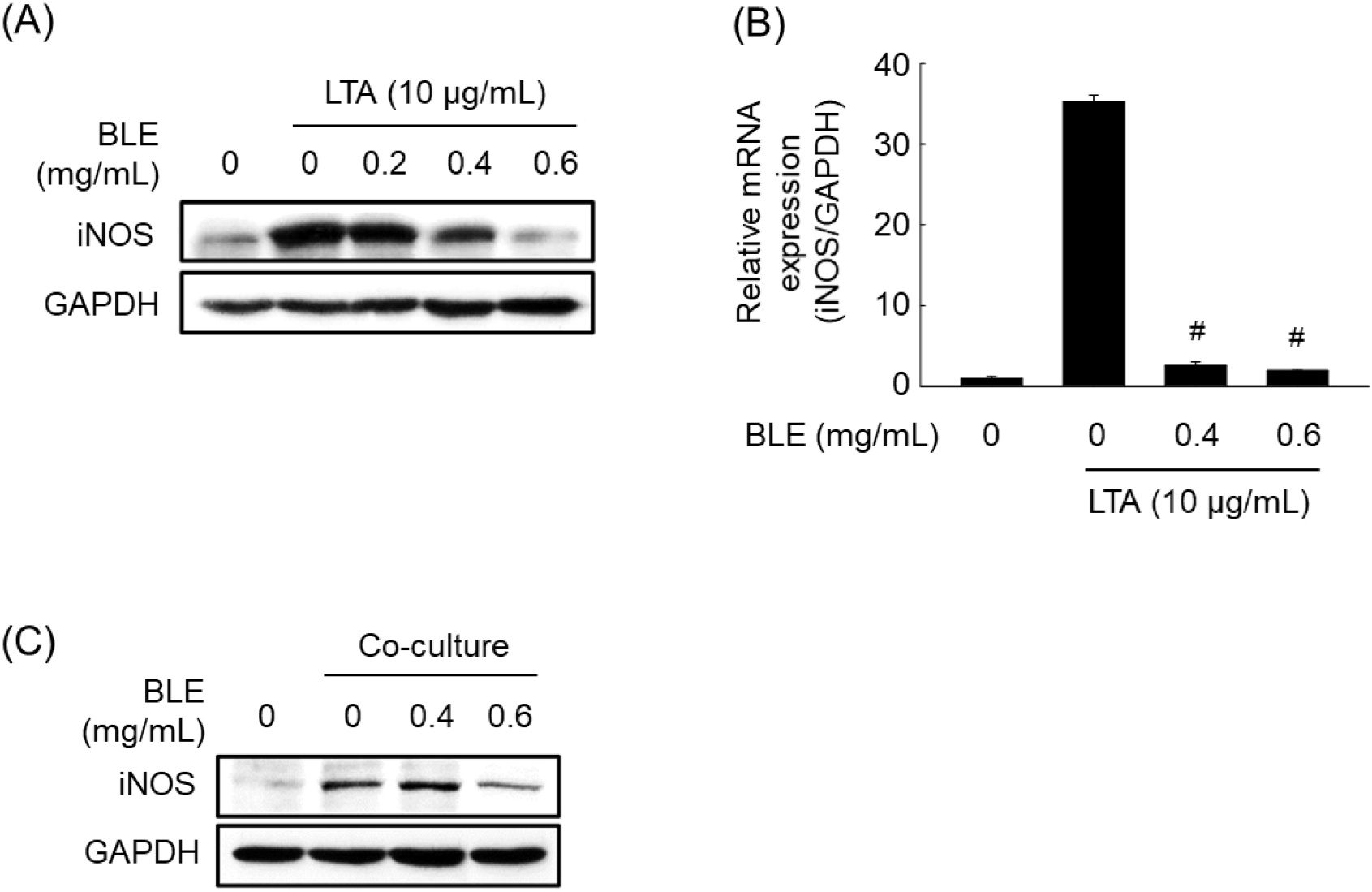
NO는 NOS에 의해 L-arginine으로부터 합성되며, NOS는 endothelial NOS(eNOS), neuronal NOS(nNOS) 및 iNOS의 3가지 이성질체로 존재한다(Lee 등, 2007). eNOS와 nNOS는 상피세포와 신경에 존재하여 정상적 생리기능을 조절하는 반면에, iNOS는 대식세포에서 LPS 등 외부의 자극으로 인해 생성되는 효소로 장기간 다량의 산화질소 농도를 생성하여 염증반응을 촉진하는 것으로 알려져 대식세포에서 iNOS의 수준은 염증 정도를 평가하는 중요한 자료로 사용되고 있다(Jang과 Lee, 2023). LPS에 의해 증가한 NO의 생성을 감소시킨 BLE의 효과가 iNOS의 발현억제에 의한 것인지 알아보기 위하여 western blot과 real-time PCR을 수행하였다. BLE를 농도별로 처리한 결과, LPS 대조군에 비해 iNOS의 단백질 발현이 유의적으로 감소하였으며(Fig. 2A), iNOS의 mRNA 발현 또한 BLE 처리에 의해 유의적으로 감소하였다(Fig. 2B). 이로부터 NO의 생성 억제는 전사 수준에서의 iNOS 발현억제에 의한 것임을 확인할 수 있었다.
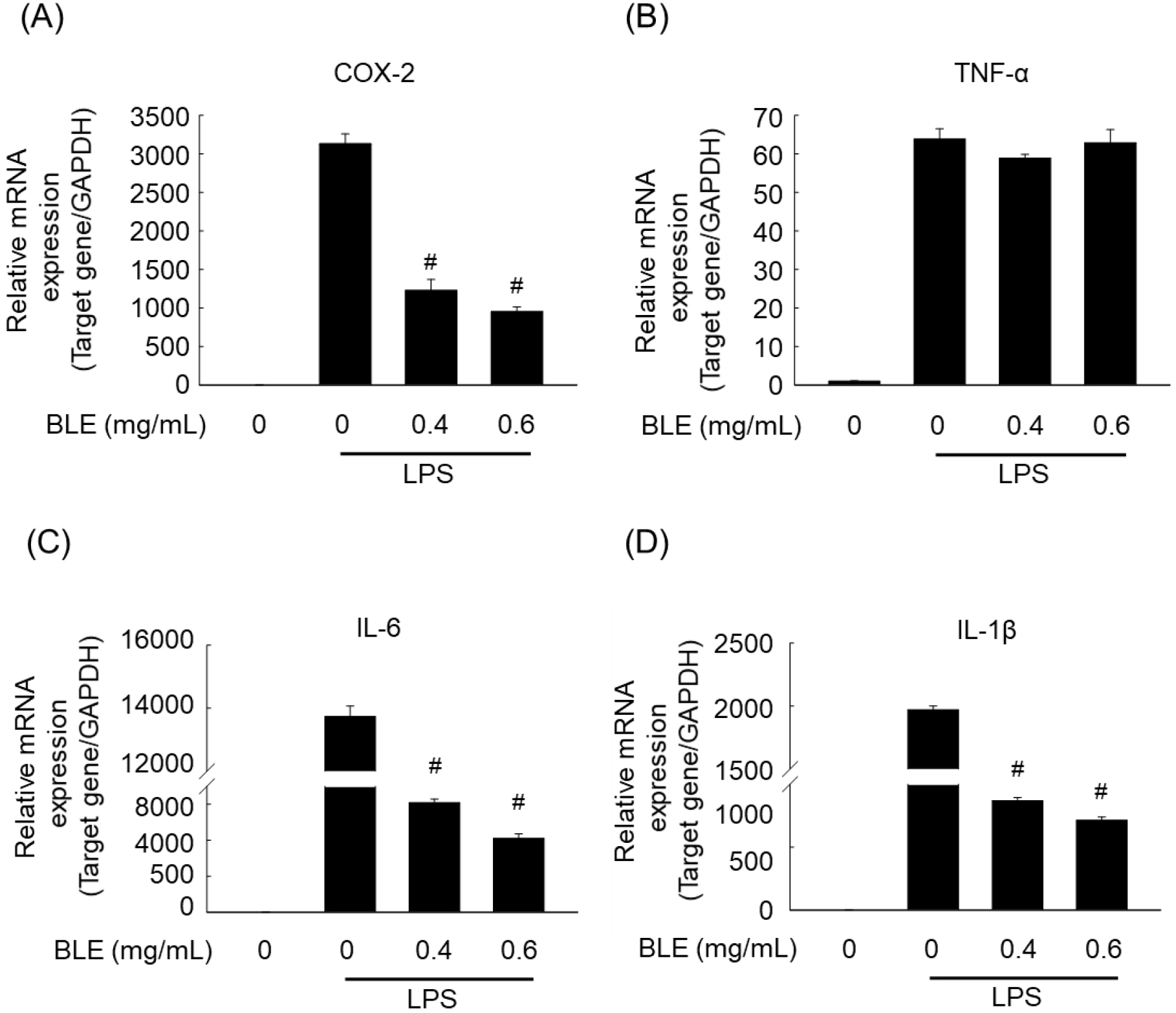
활성화된 대식세포인 RAW 264.7 세포에서는 TNF-α, COX-2, IL-1β, IL-6와 같은 염증성 사이토카인들의 발현이 증가하는 것으로 알려져 있다(Jang과 Lee, 2023). COX-2는 arachidonic acid를 prostaglandin으로 합성을 촉진시키는 효소로서 세균성 내독소와 자외선 등의 다양한 염증 유발 인자에 의해 과발현되어 염증뿐만 아니라 각종 퇴행성 질환의 발병과 진행에 중요한 역할을 하는 것으로 알려져 있다(Jang과 Lee, 2023). TNF-α는 주로 급성 염증반응에 관여하고 면역세포를 조절하며, IL-6는 단핵구를 포함한 여러 세포에서 분비가 되고 면역반응에 중요한 기능을 담당하고 있다. IL-1β는 T-cell의 활성화와 NK 세포의 활성도를 조절하는 등 여러 면역학적 작용들과 연관되어 있는 사이토카인으로, 주로 염증반응의 초기 단계에 발현량이 증가한다고 알려져 있다(Van 등, 2009). 다양한 염증성 사이토카인의 유전자 발현량을 알아보기 위해 정량 실시간 PCR(qPCR) 분석법을 이용하였다. COX-2, IL-6, IL-1β 유전자의 경우 LPS만 처리한 세포에서 그 발현량이 큰 폭으로 증가하였으나, BLE를 0.4와 0.6 mg/mL의 농도로 전처리한 세포에서는 각 유전자의 발현량이 모두 유의적으로 감소함을 확인하였다(Fig. 3). 반면 TNF-α의 경우 BLE 처리에 따라 유전자 발현량의 차이를 보이지 않았다(Fig. 3B). 이를 통하여 BLE가 LPS에 의해 활성화된 RAW 264.7 대식세포에서 NO를 포함한 다양한 염즘성 사이토카인의 발현을 효과적으로 억제하는 것을 확인할 수 있었다.
LPS 이외의 염증 유발물질 처리에 의해 유도되는 NO 생성에 BLE의 저해효과를 조사하였다. LTA는 그람 양성 세균의 외독소로 미생물 감염으로 인한 염증반응에서 중요한 역할을 한다. RAW 264.7 대식세포에 LTA를 처리한 결과, LTA 처리 전에 비해 NO 생성량이 13.60±0.26 μM로 약 16배가량 증가하였으나, BLE 처리 농도에 의존적으로 NO 생성량이 감소하여 최고 농도인 0.6 mg/mL에서 NO 생성량이 1.31±0.30 μM로 유의적으로 감소했다(Fig. 4A). 또한 Fig. 2B에서 LTA가 처리된 세포에서 BLE는 모든 농도에서 80% 이상의 세포 생존율을 보여주어 세포 독성이 없는 농도에서 NO 생성이 감소하는 것을 확인하였다.
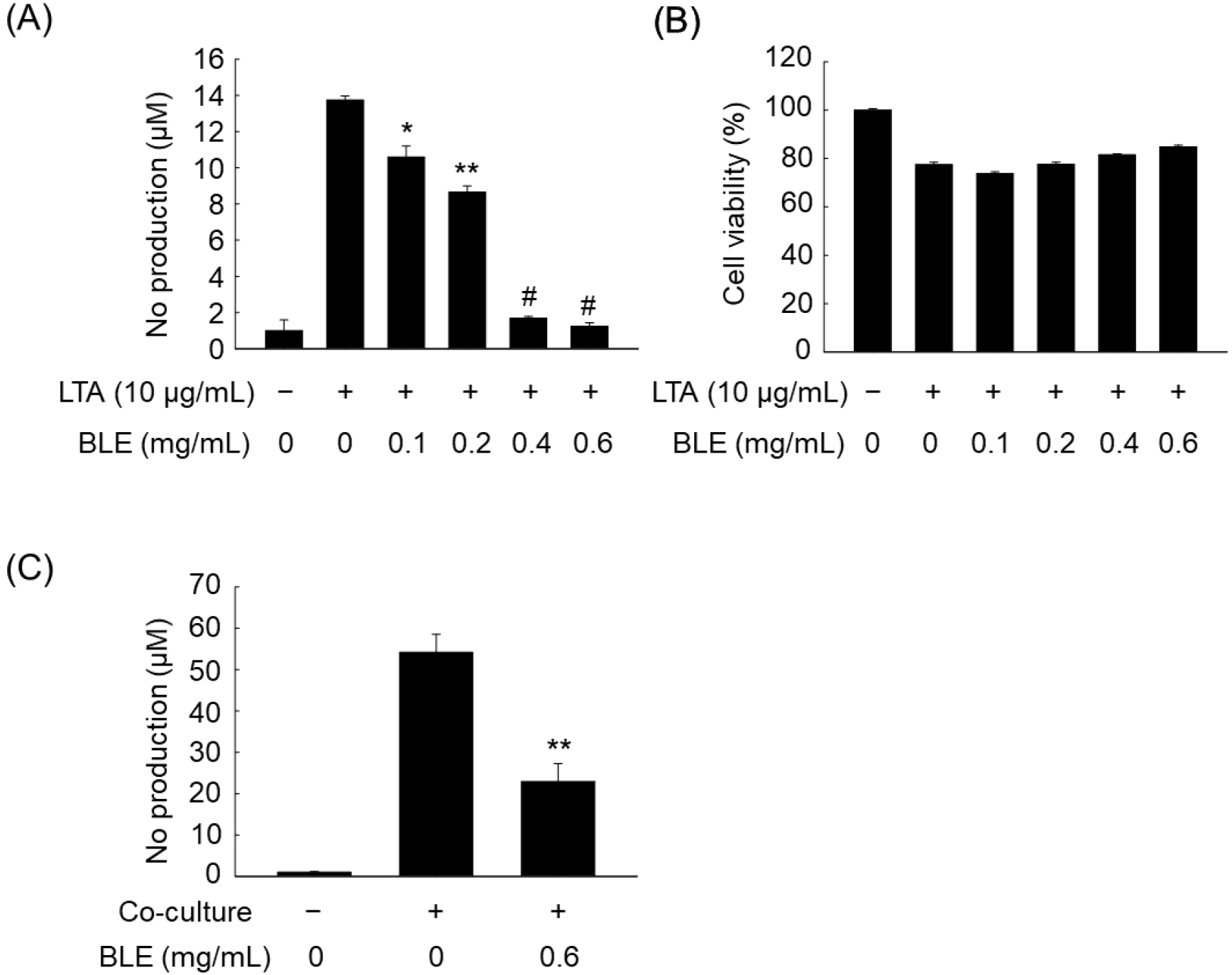
비만은 만성 염증과 밀접한 관계가 있으며 이러한 염증반응은 지방조직이 여러 사이토카인을 분비함으로써 면역세포들과의 상호작용으로 제2형 당뇨병 및 심혈관계 질환과 같은 대사성 질환 및 합병증을 유발하는 것으로 알려져 있다(Chawla 등, 2011). Kim 등(2014)은 3T3-L1 지방세포와 RAW 264.7 세포의 공동배양 시 NO와 TNF-α와 같은 염증성 사이토카인의 분비가 증가한다는 실험 결과에 따라 비만에 의한 염증반응이 대사성 질환의 주요한 원인으로 작용한다는 것이 확인하였다. 이러한 결과를 토대로 분화된 3T3-L1 지방세포와 공동배양으로 인해 유도된 NO 생성량을 확인해 본 결과, BLE가 처리되지 않은 공동배양 대조군에서 NO 생성량은 55.50±5.86 μM로 증가하였으나, BLE를 0.6 mg/mL로 처리하였을 때 NO 생성량이 22.08±3.62 μM로 감소하는 것을 확인하였다(Fig. 4C).
추가적으로 LTA 처리 또는 3T3-L1 지방세포와 공동배양으로 iNOS의 단백질과 mRNA 발현량이 큰 폭으로 증가하였으나, BLE를 전처리한 세포에서는 이들 발현량이 유의적으로 감소하는 것으로 확인되었다. 앞서 LPS를 처리하였을 때의 결과와 마찬가지로 BLE가 LTA 또는 3T3-L1 지방세포 공동배양으로 유도된 iNOS 단백질의 발현도 효과적으로 억제하였으며 이를 통해 세포 내 NO 생성을 조절하고 있음을 확인하였다(Fig. 5). Lee(2017)는 LTA 처리에 의해 유도된 대조군에 Salix paraplesia C.K. Schneid.와 Caragana jubata(Pall.) Poir.의 추출물을 처리하였을 때 iNOS의 단백질 발현이 유의적으로 감소됨을 확인하였으며, 이는 BLE가 LTA에 의해 유도된 대조군에서 iNOS의 단백질 발현이 유의적으로 감소하는 결과와 유사한 경향을 나타내었다. 또한, Kim 등(2014)은 RAW 264.7 세포와 3T3-L1의 공동배양을 통해 염증을 유도한 대조군에 esculetin를 처리하였을 때 iNOS의 단백질 발현이 유의적으로 감소됨을 확인하였으며, 이 또한 BLE가 3T3-L1 지방세포 공동배양에 의해 유도된 iNOS의 단백질 발현 결과와 유사한 경향을 나타내었다.
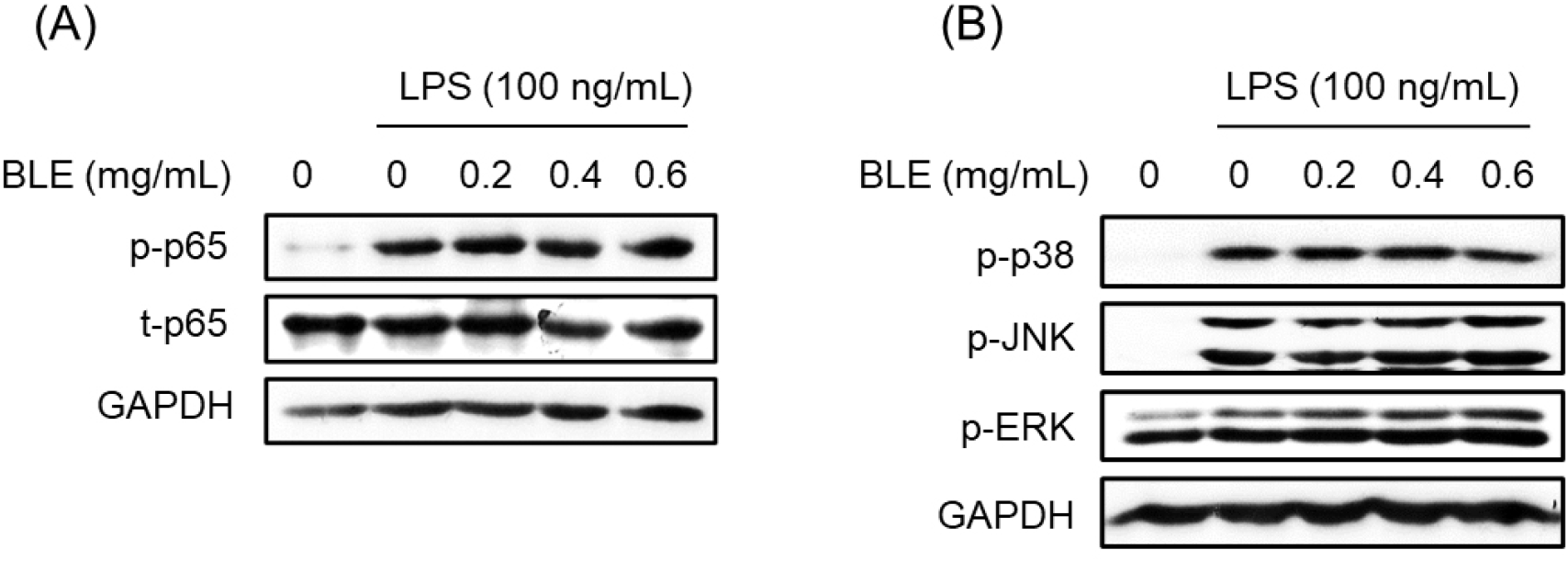
LPS는 대식세포 표면의 Toll-like receptor 4(TLR-4)를 자극하여 세포 내 전사 요소인 nuclear factor-kappa B(NF-κB)의 활성을 유도한다. NF-κB는 세포질에서 inhibitor kappa B(IκB)와 결합하여 불활성화 형태로 존재하나, 염증반응에 의하여 IκB kinase가 인산화되어 IκB가 분리되면 유리된 NF-κB는 핵 안으로 이동하여 TNF-α, IL-6, IL-1β 등의 염증성 사이토카인과 염증 매개 인자의 유전자 발현을 조절한다(Jang과 Lee, 2023). MAP kinases(mitogen-activated protein kinases)는 NF-κB를 인산화시켜 염증반응을 조절하는 역할을 하는 데 관여하는 것으로 알려져 있으며, 세포의 성장, 분열, 스트레스나 사이토카인에 의한 세포 반응의 조절 등에 중요한 역할을 한다(Johnson과 Lapadat, 2002). 또한, 외부 자극이 가해지면 p38, JNK1/2 및 ERK1/2에 의한 신호전달 경로에 의해 세포 내에서 활성화되어 세포의 형태 변화와 사이토카인 유전자의 전사 활성화를 초래한다(Johnson과 Lapadat, 2002). 따라서 BLE가 NF-κB와 MAP kinases 활성에 어떠한 영향을 미치는지 알아보기 위하여 western blot법을 통하여 확인하였다. Fig. 6에서 볼 수 있듯이 LPS 처리에 의해 NF-κB와 MAP kinases가 활성화(인산화)되었으나 BLE를 함께 처리하였음에도 불구하고 이들 단백질의 활성화에는 변화가 없었다. 따라서 NF-κB/MAP kinases 신호 경로는 BLE에 의한 염증 억제 효과와 관련이 없음을 알 수 있었다.
HO-1은 heme을 ferrous iron, biliverdin 및 carbon monoxide (CO)로 전환시키고, biliverdin은 다시 환원효소에 의해 bilirubin으로 환원된다(Jang과 Lee, 2023). HO-1에 의해 생성된 CO는 혈관을 확장시켜 장기 손상을 억제하며 항염증 및 항세포자멸사의 기능이 있으며, bilirubin은 출혈 쇼크 시 정맥 내 백혈구 이동을 억제해 염증을 감소시키는 것으로 보고되었다(Jang과 Lee, 2023).
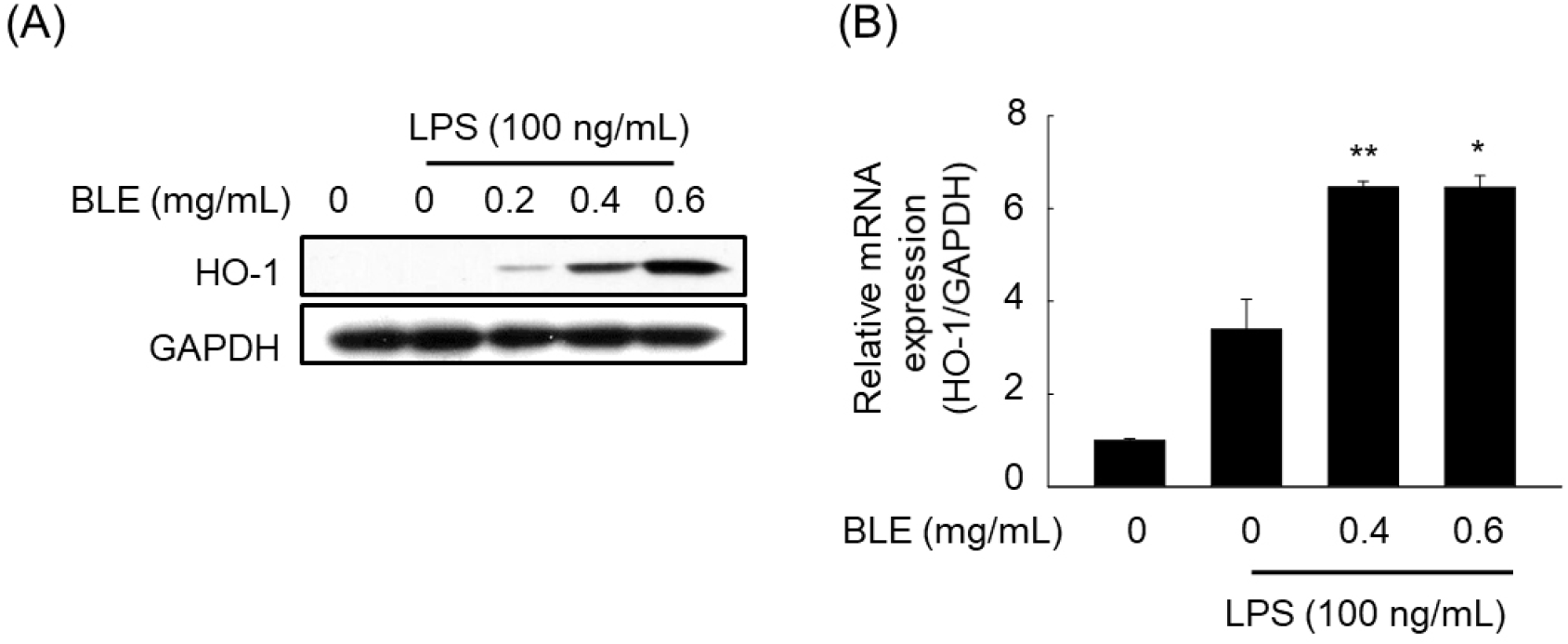
항염증 작용을 나타내는 여러 가지 메커니즘 중에서 최근 주목받고 있는 HO-1은 산화적 손상으로부터 세포 내 지질 및 단백질들을 보호하는 방어 기작의 하나로 보호 작용을 할 뿐 아니라 염증반응을 억제한다고 알려져 있으며, 단구세포/대식세포, 수지상세포, T림프구, 비만세포 등과 같은 다양한 염증성 세포들의 활성화, 분화 및 성숙 과정을 조절함으로써 최종적으로 염증반응을 억제시킬 수 있는 것으로 알려져 있어 항염증제 개발을 위한 중요한 약리학적 타겟으로 여겨지고 있다(Ryter, 2022). 특히, LPS를 처리한 RAW 264.7 세포에서 HO-1은 NO의 생성과 iNOS 유전자 발현을 억제함으로써 염증반응을 차단하는 것으로 알려져 있다. 또한, HO-1은 스트레스나 허혈 및 염증반응에서 유도되며 주로 세포를 보호하는 기전에 작용하며 여러 종류의 염증 치료제들이 HO-1의 발현을 유도하고, 이를 통해서 항염증 효과를 나타낸다고 보고되고 있다(Ryter, 2022). 따라서 BLE의 항염증 효과가 Nrf2/HO-1 신호전달경로와 관련이 있는지를 확인한 결과, BLE의 처리에 따라 HO-1 단백질과 mRNA 발현이 유의적으로 증가함을 확인하였으며(Fig. 7), 이 결과를 통해 BLE에 의한 NO 생성 억제에는 HO-1 조절을 통한 iNOS 발현 감소가 연관되어 있음을 예상할 수 있었다.
HO-1 단백질 발현은 Nrf2 의존적으로 조절되는데, Keap1에 의해 세포질에서 비활성화 상태로 존재하던 Nrf2가 산화적 자극에 의해 Keap1이 해리되면서 핵 내로 이동하고 antioxidant response element(ARE)와 결합하여 HO-1의 발현을 조절한다(Jang과 Lee, 2023). 우선 BLE(0.6 mg/mL)를 시간별로 처리하여 Nrf2의 발현을 분석한 결과, Nrf2 단백질 발현은 LPS를 처리한 후 4, 6, 8시간에서 증가하였다(Fig. 8A). 따라서 Nrf2 단백질 발현이 가장 뚜렷하게 증가한 6시간을 선택하여 BLE를 농도별로 처리하였으며, 이 때 양성 대조군으로는 sulforaphane (SFN)을 사용하였다. LPS에 의해 유도된 세포에 BLE를 전처리한 결과, Nrf2 단백질 발현이 농도 의존적으로 증가하였으며, 이를 통해 BLE가 Nrf2의 발현 증가를 통해 HO-1의 발현 증가를 유도할 가능성이 있음을 확인할 수 있었다(Fig. 8B).
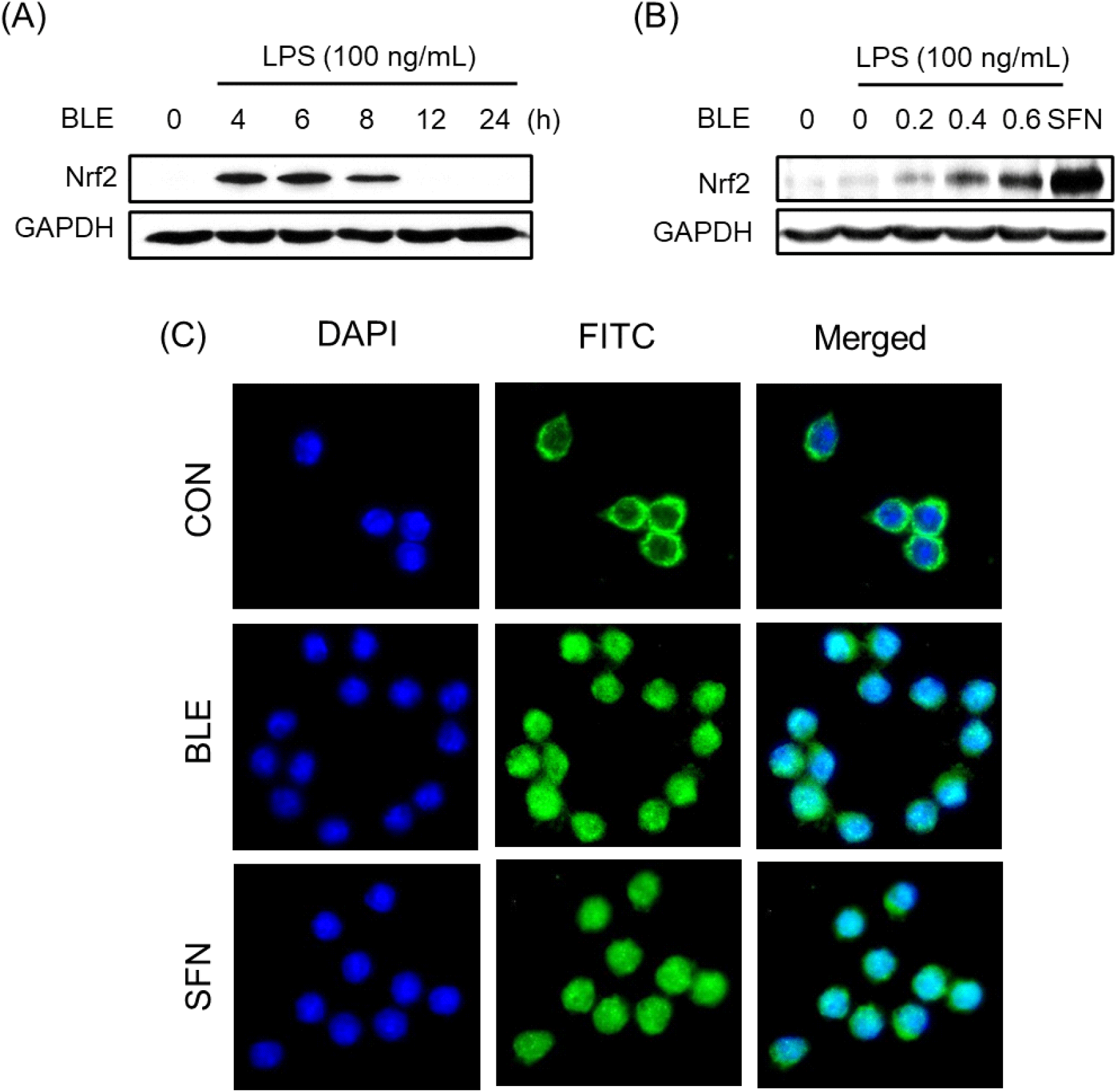
BLE 처리에 의한 Nrf2의 핵으로의 이동(활성화) 여부를 조사하기 위하여 면역 형광염색법을 실시한 결과, BLE 처리 전에 세포질에 존재하던 Nrf2(FITC; 초록색)가 BLE 처리 후 Nrf2 단백질의 핵 내 이동(FITC와 DAPI 염색의 겹침)을 관찰할 수 있었다(Fig. 8C). 이때 surforaphane(SFN)은 Nrf2의 핵 내 이동을 활성화하는 양성 대조물질로 사용되었다. 이는 BLE가 Nrf2/HO-1 경로의 활성을 통하여 iNOS의 발현을 억제할 수 있으며, 이로 인해 NO의 생성을 감소시켜 염증반응으로부터 보호 활성을 나타낸다는 것을 시사한다. 대식세포 모델에서 헛개나무 추출물(Woo 등, 2018)과 어수리 추출물(Jang과 Lee, 2023) 등 다양한 식물 유래 추출물이 Nrf2 활성화를 통하여 HO-1 발현을 유도함으로써 항염증 효과를 나타내는 것으로 보고되고 있으며, 이는 BLE의 항염증 기전과 유사한 결과임을 알 수 있었다.
최근 한 연구는 20종 렌틸 품종을 대상으로 phytochemical 성분 프로파일링을 수행하여 렌틸의 총 토코페롤류와 총 카로티노이드류 화합물의 함량을 건물기준 각각 37-64 μg/g과 5.3-28.1 μg/g으로 보고하였다(Zang 등, 2015). 그러나 벨루가 렌틸의 phytochemical 화합물 조성 및 함량에 관한 연구는 수행된 적이 없어 관련 정보가 부족한 실정이다. 최근 수행된 본 연구실의 선행연구 결과에 따르면 벨루가 렌틸 추출물의 총 폴리페놀 화합물과 총 플라보노이드 화합물 함량이 다른 3종(red, green, and French)의 렌틸 추출물과 비교해 큰 차이가 없는 것으로 확인되었으며(Jung 등, 2022; Lee와 Lee, 2016), H2O2와 알코올이 처리된 간세포 모델을 대상으로 수행된 연구에서도 4종 렌틸 추출물이 유사한 세포 보호 활성을 나타내었다(data not shown). 이들 결과를 종합해 볼 때, 벨루가 렌틸의 phytochemical 화합물 조성 역시 다른 품종의 렌틸과 유사할 것으로 예상되지만, 품종에 따라 항산화 활성의 차이를 보인 것(Lee와 Lee, 2016)을 고려할 때 서로 다른 성분의 함유 가능성 또한 예상된다. 따라서 벨루가 렌틸 추출물의 자세한 성분 프로파일링과 함께 항염증 물질을 확인하기 위한 추가적인 연구가 필요할 것으로 생각된다.
4. 요약
본 연구에서는 벨루가 렌틸 추출물(BLE)의 항염증 효능을 NO 생성 측면에서 검토하고 이와 관련된 분자 기전을 규명하고자 하였다. LPS, LTA 및 지방세포 공동배양에 의해 활성화된 RAW 264.7 대식세포에서 BLE는 독성이 없는 농도 범위에서 유의적인 NO 생성 저해 효과를 보였다. 이와 함께 BLE 처리에 따라 iNOS mRNA 및 단백질의 발현이 유의적으로 저해됨을 확인하였으며, 이는 BLE에 의한 NO 생성 억제 효과가 전사 수준에서의 iNOS 발현을 억제함으로부터 기인하는 것임을 시사한다. 추가적으로 BLE는 NO 외에도 활성화된 대식세포에서 증가하는 다양한 염증성 사이토카인 유전자(COX-2, IL-1β 및 IL-6)의 mRNA 발현 또한 유의적으로 억제하는 것으로 나타났다. BLE의 항염증 효과와 관련된 분자 기전에 관한 추가적인 연구를 수행한 결과, 항염증 관련 대표 기전인 NF-κB/MAP kinases 신호 경로와는 연관성이 없는 것으로 나타났다. 반면, BLE 처리에 따라 Nrf2 단백질 발현의 증가 및 활성화가 유도되고 HO-1의 발현이 유의적으로 증가하는 것을 확인함으로써 Nrf2가 HO-1의 발현을 증가시키기 위한 전사 인자로서 작용할 가능성이 높음을 확인하였다. 따라서, 본 연구를 통해 식용원료 유래의 잠재적인 항염증 소재로서 BLE의 활용 가능성을 확인할 수 있었으며, 향후 동물모델을 대상으로 항염증 효과를 입증하기 위한 추가적인 연구가 필요할 것으로 생각된다.
