1. 서론
사람의 피부는 체내 수분 및 피부 장벽을 유지하고 외부 물질의 침입으로부터 신체를 보호하며, 면역반응을 나타내는 인체가 지닌 가장 큰 기관이다. 피부는 표피, 진피, 피하지방 3개의 층으로 나뉘어져 있으며 각각의 피부 부속기관으로 구성되어 다양한 기능을 수행한다. 그 중 표피는 3개의 층 중 가장 얇으며 각질층(stratum corneum, SC), 투명층, 과립층(stratum granulosum, SG), 유극층 (stratum spinosum, SS), 기저층(stratum basale, SB)으로 나뉘는데, 각질층에서는 brick 역할의 각질세포와 mortar 역할의 세포 간 지질(intercellular lipids)이 bricks and mortar model을 형성하여 피부에 필요한 수분과 전해질의 손실을 막아 피부 장벽 기능을 수행한다(Jo, 2016). Filaggrin(FLG)은 피부 장벽의 주요 인자 중 하나로, 각질형성세포가 분화됨에 따라 케라틴 필라멘트를 응집하여 단단하고 편평한 각질세포를 만들어 brick 역할을 수행할 수 있게 도와준다(Park 등, 2019). 이러한 FLG의 발현 감소는 천연보습인자(natural moisturizing factor, NMF)도 감소시켜 피부 SC의 손상을 일으킨다(Im 등, 2024). 뿐만 아니라 SG에서는 세포 간 부착기능 및 다양한 조절 작용을 하는 밀착연접(tight junction, TJ)이 존재한다(Kim과 Kang, 2016). TJ는 세포연접의 한 종류로 occludin, claudin(CLDN), zona occluden(ZO) 등의 단백질로 구성되며(Lee 등, 2013), 이들의 다양한 신호전달 단백질들과의 결합을 통해 수분 및 이온들의 이동 조절에 관여한다. 특히, CLDN-1 단백질은 피부 보습 효과와 아토피 피부염(atopic dermatitis, AD) 치료에 중요한 marker로 쓰여지고 있는데, TJ 관련 단백질뿐만 아니라 피부 장벽과 관련한 involucrin(INV), FLG, CLDN 등의 손상은 보습 기능과 함께 종양 전이, 세포증식 조절(Choi 등, 2016), AD 등에 관여하는 것으로 알려져 있다. AD는 심한 가려움증을 동반하는 염증성 피부질환으로 대식세포, 호산구, 등 염증과 관련된 세포의 이동에 의해 매개되며, 다양한 면역 세포들을 염증 부위에 침투시켜 염증반응을 조절한다. 이때 cyclooxygenase-1 (COX-1)과 inducible nitric oxide synthase(iNOS) 등의 발현으로 prostaglandin E2(PGE2), nitric oxide(NO) 등과 같은 염증매개 물질이 분비되고 과도한 발현은 AD의 증상을 악화시킬 수 있다(Sim 등, 2014).
으름덩굴(Akebia quinata)은 으름덩굴과(Lardizabalaceae)에 속하며 흔히 chocolate vine 또는 목통(木通)이라고 불리는 낙엽덩굴성 목본이다. 으름덩굴은 한의학에서 진통제, 소염제, 이뇨제로 사용되어져 왔으며, 신장염, 요도염, 신경통 작용뿐만 아니라 민간 요법으로 우리나라 전통 체중 감량 차의 성분으로도 쓰여져 왔다(Chowdhury, 2016; Kyung 등, 2015). 또한, 현재까지 생리활성과 관련하여 항산화, 항동경맥경화, 항비만, 항염증, 항노화, 혈압강하작용 등에 대한 효과가 입증되었다. 으름덩굴에는 chlorogenic acid, saponin, β-sitosterol, betulin, β-D-glucoside, myo-inositol, hederagenin, sucrose, guaianin N, oleanolic acid 등의 다양한 성분들이 존재한다고 밝혀졌는데(Jeon, 2014; Kim 등, 2024; Park, 2005), 그 중 chlorogenic acid는 활성산소종을 제거하는 항산화 및 발암, 항돌연변이에 탁월하고(Sato 등, 2011), 영양학적 관점에서 이는 강력한 식이 항산화제로 작용하여 2형 당뇨병, 비만, 항고혈압 등의 효과를 나타낸다고 알려져 있다(Zhao 등, 2012). 생강(Zingiber officinale)은 Zingiberaceae과에 속하며, 식물 화학물질로 알려진 생물학적 활성 화합물이 풍부한 식물이다. 생강은 중국, 동남아시아 및 인도네시아에서는 향신료로 사용될 뿐만 아니라 약초 식물로써 소화, 장애, 기침, 발열 등의 치료제로써 쓰여져 왔다. 이러한 생강에는 phenolic과 terpenoid와 같은 다양한 활성 화합물이 많이 포함되어져 있으며 탄수화물, 지질, 유기산, 섬유질 및 기타 영양소도 함유하고 있다. 생강에는 gingerol, zingerone, shogaol, paradol 등과 같은 페놀성 성분이 함유되어 있는데 그 중, 생강의 주 성분은 gingerol이며, 항산화제, 항염증제, 항비만제 등의 다양한 생물학적 활성을 갖는다(Ayustaningwarno, 2024; Li 등, 2024). Gingerol의 분리 이후 zingerone 및 shogaol의 분리를 통해 이들의 구조적 특성을 확인하고, 항산화, 항균, 항진균, 항염증 및 항당뇨병에 대해 효과가 있다고 밝혀졌다(Eldesouky 등, 2023; Kim과 Ahn, 1993). 회화나무(Sophora japonica L.)의 열매는 괴각(Sophorae fructus)이라고 불리는 콩과(Leguminosae)에 속하는 식물로, 중국, 일본, 한국 등에 널리 분포하며 한약재로 쓰이고 있다. 일반적으로 지혈제, 빈혈 등에 사용되고 치질, 고혈압, 잇몸 염증 등에도 효과가 있다고 알려져 있다. 괴각은 flavonoid 및 isoflavonoid 화합물을 주 성분으로하여 sophoricoside, sophoaflavonoloside, rutin 등을 함유하고 있는데, 그 중 sophoricoside는 항염, 면역 억제 활동, 호르몬 및 에스트로겐 작용 등의 광범위한 약리적 효과를 나타낸다고 알려져있다. 또한, 모세혈관 강화 작용과 고혈압 예방 등에 사용되는 rutin이 어린 괴각 속에 46%로 매우 높은 함량을 차지하고 있다(Lee, 2005; Park 등, 2008; Yuen 등, 2024).
다양한 효능을 지닌 약용 식물이나 천연물을 혼합하여 사용한 연구들은 단일 추출물을 사용했을 때 보다 우수한 시너지 효과를 나타내어 아토피 피부염 증세 완화(Yang 등, 2010), 면역 세포 활성화(Byun과 Byun, 2015), 항염 효능(Cho 등, 2016) 등의 효과를 보인 바 있다. 따라서 본 연구에서는 각각의 다양한 활성을 지닌 괴각, 건강(말린 생강), 으름줄기(으름덩굴) 세 가지 소재들을 혼합하여 복합추출물을 제조한 뒤, 이에 의한 항염증 및 피부 장벽 개선의 효과를 검증하여 기능성 소재로서의 활용 가능성을 알아보고자 하였다.
2. 재료 및 방법
본 실험에 사용된 추출물은 50% ethanol을 용매로 사용하여 추출을 진행하였으며, 건강은 용량(g)에 대한 40배의 용매를 첨가하여 추출하였고 괴각과 으름줄기는 용량(g)에 대한 20배의 용매를 첨가하여 추출하였다. 추출은 70°C에서 6시간 동안 진행하였으며, 추출이 끝난 후 0.6 μm의 필터를 사용하여 여과하였다. 여과된 용액은 60 °Brix로 맞춘 후 감압농축을 진행하였다. 각각 농축된 괴각, 건강, 으름줄기 추출물은 두 가지의 비율로 혼합하였으며, 8:1:1의 비율로 혼합한 시료는 CSP-811, 5:3:2의 비율로 혼합한 시료는 CSP-532로 시료명을 칭하여 실험에 사용하였다.
세포 배양에 사용된 dulbecco’s modified eagle medium (DMEM), fetal bovine serum(FBS), penicillin/streptomycin은 Thermo scientific hycloneTM(Logan, UT, USA)에서 구입하였으며, Propionibacterium acnes(P. acnes, KTCT 3314)는 KCTC(Sinjeon, Jeongeup, Korea)에서 구매하여 사용하였다. 세포 생존율 측정을 위해 2-[(4,5-dimethylthiazol)-2-yl]-2,5-diphenyl-tetrazolium bromide(MTT), dimethyl sulfoxide (DMSO)와 항염증 활성 측정을 위해 사용한 lipopolysaccharide (LPS), griess reagent, RIPA buffer는 Sigma Chemical Co. (St. Louis, MO, USA)를 사용하였다. 또한 primary-antibody인 COX-2와 β-actin, secondary-antibody인 anti-mouse는 Santa Cruz Biotechnology, Inc.(Santa Cruz, CA, USA), primary-antibody인 iNOS와 secondary-antibody인 anti-rabbit은 Cell Signaling Technology Inc.(Danvers, MA, USA)에서 구입하여 사용하였다. 단백질 발현 측정은 위해 사용한 enhanced chemiluminescence(ECL) 용액은 Merck Millipore(Burlington, MA, USA)에서 구입한 Immobilon Western Chemiluminescent HRP Substrate를 사용하였다. 피부 장벽 개선을 확인하기 위해 측정한 FLG(MBS944540), INV(MBS700658) ELISA Kit는 MyBioSource(San Diego, CA, USA), ZO-1(CSB-E13916h), CLDN-1 (CSB-EL005490HU) ELISA kit는 CUSABIO(Houston, TX, USA)사를 이용하여 실험에 사용하였다.
실험에 사용된 기기는 rotary vacuum evaporator(EYELA, Tokyo, Japan), micro refrigerated centrifuge(Smart R17, Hanil Scientific Inc., Gimpo, Korea), microplate reader (SPECTROstar Nano, BMG LABTECH, Ortenberg, Germany), SimpliAmpTM Thermal Cycler(Applied Biosystems, MA, Foster City, USA), ChemiDocTM MP Imaging System(BIO-RAD, Hercules, CA, USA) 등을 사용하였다.
본 세포 실험에 사용한 세포주는 서원대학교 공동연구실에서 분양받은 HaCaT cell과 한국세포주은행에서 분양받은 RAW 264.7 cell을 이용하였다. 세포 배양은 10% FBS와 1% penicillin/streptomycin(100 U/mL)을 함유한 DMEM 배지를 사용하였으며, 37°C의 5% CO2 incubator에서 80% 이상 자란 cell을 계대 배양하여 실험에 이용하였다.
세포 생존율은 Carmichael의 방법(Carmichael 등, 1987)에 따라 측정하였다. HaCaT cell과 RAW 264.7 cell은 1×104 cells/well로 96 well plate에 분주하여 배양 조건에 따라 24시간 배양하였다. 이후 시료인 CSP-811, CSP-532와 양성 대조군으로 사용한 RA(retinoic acid) 및 Vit. C(ascorbic acid)는 78, 156, 312, 625, 1,250, 2,500, 5,000 μg/mL의 농도로 처리하여 다시 24시간 배양하였으며, 2.5 mg/mL 농도로 제조한 MTT 시약을 각 well에 40 μL씩 첨가하여 3시간 30분 동안 반응시켰다. 상층액 제거 후, 100 μL의 DMSO를 각 well에 넣고 상온에서 10분간 shaking을 진행하였으며 540 nm에서 microplate reader를 사용하여 흡광도를 측정하였다. 세포 생존율은 대조군으로 시료를 첨가하지 않은 무처리군을 사용하였고, 이와 첨가군의 흡광도 비교를 통해 백분율(%)로 나타내었다.
피부장벽개선 인자들의 생성량을 측정하기 위해 HaCaT cell을 1×105 cells/well로 6 well plate에 seeding 한 후, 세포 배양 조건에 따라 24시간 배양하였다. 이후 1X의 P. acnes를 자극제로 처리하였으며 농도별(100, 500, 1,000 μg/mL)로 시료 및 양성 대조군은 RA를 처리하여 24시간 추가배양 하였다. 이후 각 well의 상층액을 500 μL씩 수거하여 13,200 rpm, 5분 조건에서 원심분리를 통해 상층액 300 μL를 재수거하여 사용하였다. 피부장벽개선 인자들은 FLG, INV, CLDN-1, ZO-1으로 각 인자들의 ELISA kit를 사용하여 제조사의 매뉴얼에 따라 실험을 진행하였으며, 발현량은 microplate reader를 사용하여 흡광도 450 nm에서 측정하였다.
NO 생성 저해 활성은 Green 등의 방법(Green 등, 1982)을 응용하여 측정하였다. 6 well plate에 RAW 264.7 cell(2×105 cells/well)을 분주하여 배양 조건에 따라 24시간 배양하였다. 이후 LPS(10 μg/mL)를 처리하여 NO 생성을 유도하였고, 2시간 뒤 MTT assay 측정에 따라 95% 이상의 세포 생존율을 보인 농도구간(100, 500, 1,000 μg/mL)의 시료를 처리하여 16시간 추가 배양하였다. Griess reagent와 각 상층액은 100 μL씩 1:1 비율로 10분간 shaking하여 혼합한 후, 540 nm에서 microplate reader를 사용하여 흡광도 측정을 실시하였다. Standard로 NaNO2를 사용하였으며 양성 대조군으로는 Vit. C를 사용하였다. NO 생성 저해 활성은 LPS 단독 처리군 대비 시료첨가군의 비교를 통해 백분율(%)로 나타내었다.
항염증 활성을 확인하기 위해 RAW 264.7 cell을 사용하여 염증 관련 인자인 iNOS 및 COX-2의 단백질 발현량을 확인하였다. RAW 264.7 cell을 100 mm cell culture dish에 1×106 cells/well로 분주하였으며 세포 배양 조건에서 24시간 동안 배양하였다. 이후 자극제로 RAW 264.7 cell에 LPS(10 μg/mL)를 처리하여 cell을 자극하였으며, 농도별(100, 500, 1,000 μg/mL)로 시료를 처리하여 배양하였다. 각 well은 DPBS로 2회 세척하였으며 RIPA buffer와 protease & phosphatase single-use inhibitor cocktail(100X)을 100:1 비율로 혼합하여 lysis buffer를 조제하여 각 well에 분주 후 세포막을 용해시켰다. 이후 4°C, 13,200 rpm 조건에서 20분간 원심분리하여 얻어진 상등액은 BCA protein assay kit로 단백질 정량 진행 후 western blot에 사용하였다. 각 단백질은 20 μL로 10% SDS acrylamide gel에 120 V, 90분 loading하여 분리하였다. 이후 60 V, 150분 조건으로 transfer 기기를 사용하여 분리된 단백질을 polyvinylidene fluoride(PVDF) membrane에 이동시켰으며, tris-buffered saline & tween 20(TBS-T)로 조제한 5% skim milk에 1시간 동안 blocking하였다. Primary antibody는 3% skim milk를 사용하여 각 비율로 조제한 뒤 4°C에서 overnight 하였으며 TBS-T로 10분간 3회 반복 세척하였다. Secondary antibody는 3% skim milk를 사용하여 각 비율로 조제하여 상온에서 1시간 30분 반응시켰고, TBS-T로 10분간 3회 반복세척 후 ECL에 반응시켜 ChemiDocTM MP Imaging System을 사용하여 band를 확인하였다.
3. 결과 및 고찰
MTT assay는 수용성 기질의 노란색 MTT를 사용하여 살아있는 cell에서 미토콘드리아의 환원 효소작용을 통해 보라색의 불용성 formazan으로 전환시키는 원리로써 생성된 formazan을 측정하여 시료의 세포 독성을 확인하는 방법 중 하나이다(Jang, 2015).
먼저 피부 장벽 개선 효과를 평가하기 위해 피부각질 세포인 HaCaT cell에서의 CSP-811 및 CSP-532와 양성대조군인 RA의 세포 생존율을 측정하였고 Fig. 1과 같이 나타내었다. CSP-811 및 CSP-532와 RA는 모두 1,250 μg/mL 이하의 농도구간에서 95% 이상의 세포 생존율을 보여주었다. 또한, 항염증 활성을 측정하기에 앞서 먼저 대식세포인 RAW 264.7 cell에서의 CSP-811 및 CSP-532와 양성대조군인 Vit. C의 세포 생존율을 측정하였으며, Fig. 2와 같이 나타내었다. 그 결과, CSP-811 및 CSP-532는 1,250 μg/mL, 양성 대조군인 Vit. C는 2,500 μg/mL 이하의 농도구간에서 95% 이상의 세포 생존율을 보여주었다.
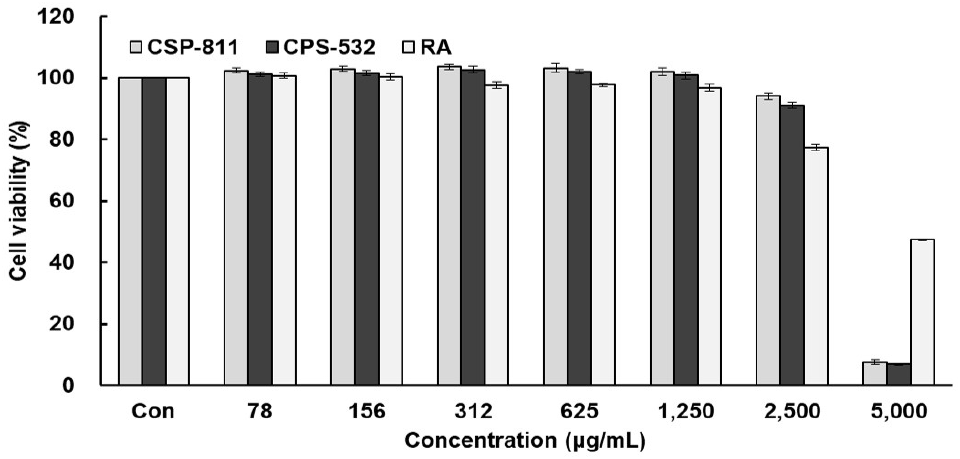
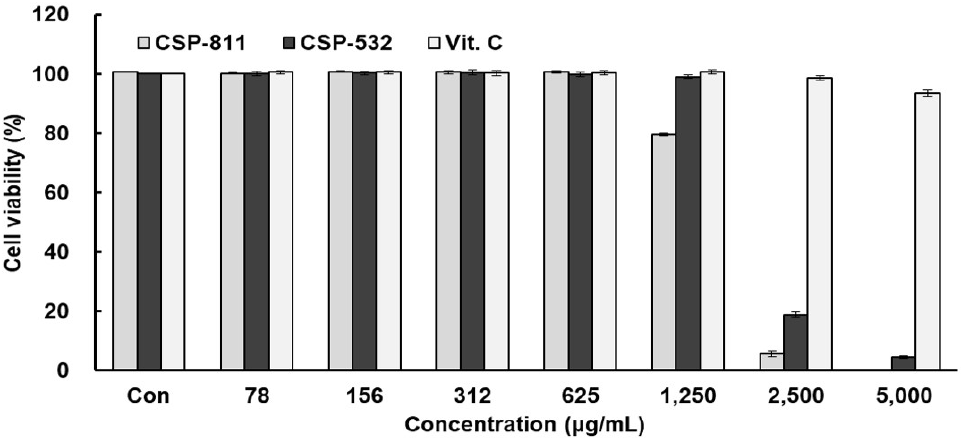
따라서 CSP-811 및 CSP-532 추출물의 피부 장벽 개선 및 항염증 효과를 확인하기 위한 이후 실험은 모두 95% 이상의 세포 생존율을 나타낸 1,250 μg/mL 이하의 농도구간을 설정하여 측정하였다.
각질형성세포가 turn-over 과정을 통해 각질세포로 분화됨에 따라 INV, FLG 등의 유전자들의 발현이 증가하며, 이 때 FLG은 caspase-14 등의 다양한 분해 효소들에 의해서 천연 보습 인자로써의 기능을 수행한다. 또한, 피부 보호막을 형성하는 필수적인 요소로써 수분 유지 및 외부 물질의 침투를 막아주는 역할을 하는데, 이러한 FLG의 감소는 보호막 파괴로 인해 수분 손실 및 증발과 이물질 침투로 인해 염증 발생으로 이어지기에 피부 장벽 강화를 위한 핵심적인 지표라 할 수 있다(Kim, 2020; Kim 등, 2021).
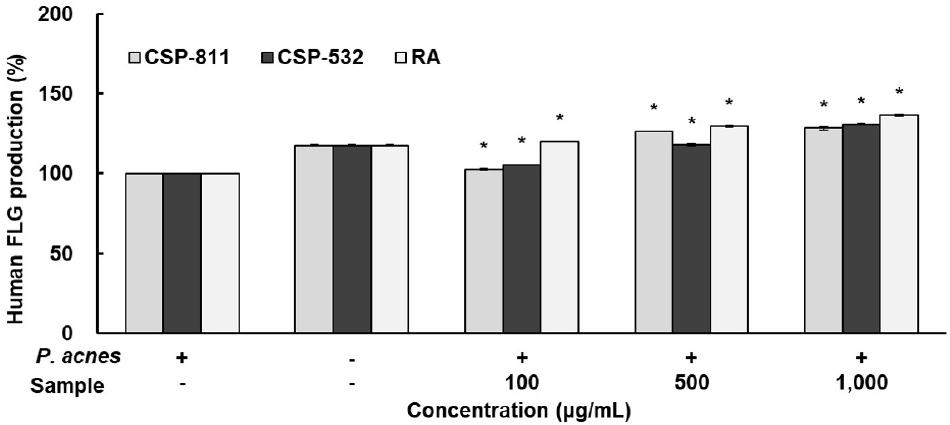
CSP-811 및 CSP-532의 피부장벽 개선 인자를 측정하기 위해 자극제로 P. acnes를 사용하였으며, 측정 결과는 Fig. 3와 같이 나타내었다. FLG ELISA Kit를 이용하여 생성량을 측정한 결과, P. acnes 단독 처리군 대비 CSP-811 및 CSP-532와 양성 대조군인 RA 모두 전 농도구간에서 농도 의존적으로 증가함을 보여주었다. CSP-811 및 CSP-532는 각각 1,000 μg/mL 농도에서 P. acnes 단독 처리군 대비 28.39%, 30.77%의 FLG 생성 효과를 보여주었으며 두 시료 모두 무처리군보다 우수한 생성량을 확인할 수 있었다.
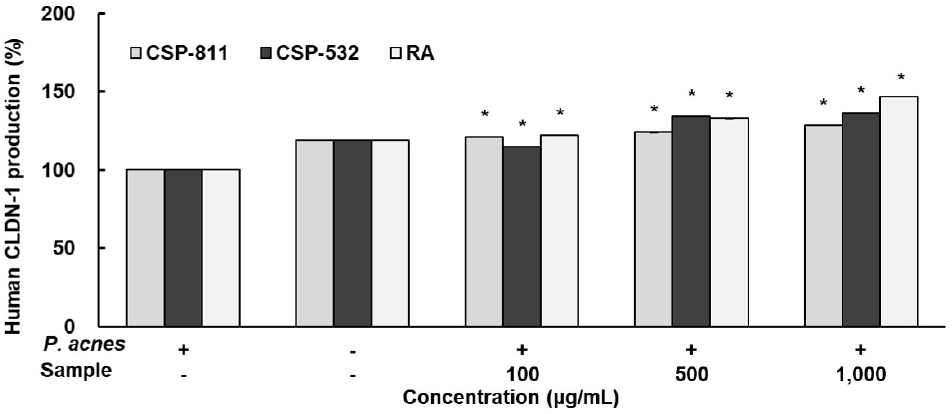
CLDN-1은 TJ와 관련된 장벽 기능 유지에 필수적인 인자로, 현재까지 알려진 CLDN family 24종 중 피부에 가장 많이 분포하고 있다고 알려져 있다. CLDN-1은 세포 극성 유지와 세포 성장, 분화에 관여하고, 세포 골격과 결합하는 등 세포 신호를 전달하고 피부 장벽에 있어서 중요한 역할을 담당한다(Kim, 2021; Kim 등, 2008).
다음으로 CLDN-1 ELISA Kit를 이용하여 CSP-811 및 CSP-532의 CLDN-1 생성 효과를 측정한 결과 Fig. 4와 같이 나타내었다. CSP-811 및 CSP-532와 양성 대조군 RA 모두 P. acnes 단독 처리군 대비 농도 의존적으로 증가하였음을 확인하였고, 최종 농도인 1,000 μg/mL에서 각각 28.55%, 36.24%의 생성량을 나타내어 18.95%를 나타낸 무처리군보다 우수한 효과가 있음을 확인하였다.
피부 장벽은 표피층의 분화과정을 통해서 형성되며 SG와 SS에서 분화를 촉진하는 인자인 INV이 발현된다. 이는 케라틴 필라멘트를 응집시켜 단단한 각질세포막을 형성시키고, 세포막 안쪽에서 단백질들과의 cross-link를 통해 피부 장벽 기능 강화에 중요한 역할을 한다(Ha 등, 2021; Lee, 2020).
INV ELISA Kit를 이용하여 CSP-811 및 CSP-532의 INV의 생성 효과를 확인한 결과는 Fig. 5와 같이 나타내었다. 그 결과, CSP-811 및 CSP-532, 양성 대조군인 RA 모두 농도 의존적으로 증가하여 P. acnes 단독 처리군 대비 최종 농도인 1,000 μg/mL에서 각각 38.74%, 29.00% 생성 효과를 보여주었다. 또한, 24.15%의 발현량을 보여준 무처리군보다 우수한 생성 효과를 확인할 수 있었다.
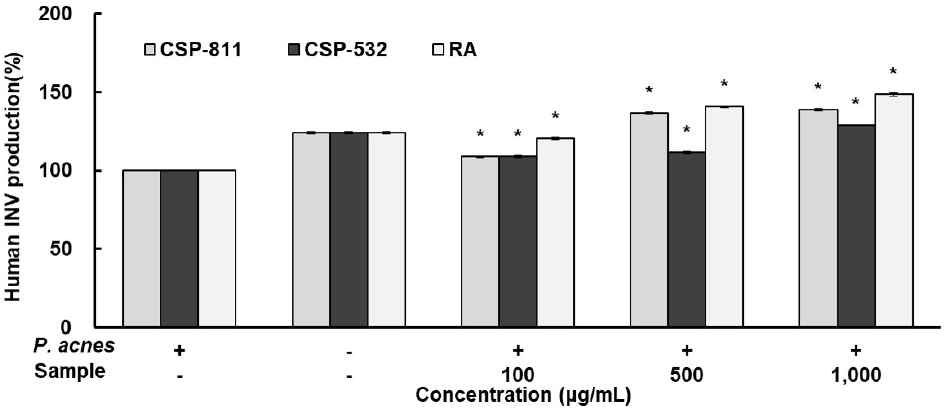
세포질에 존재하는 판단백인 ZO-1과 cingulin들은 occludin, CLDN 등과 같은 TJ 구조물 단백질에 매개체로 사용되어 세포질 조절 단백과 결합한다. 또한, 세포간 부착 및 세포 공간 사이를 통해 수분 및 물질 이동을 조절하는 역할을 하여 체내 장벽 기능을 수행하는데, 이때 ZO-1은 세포 사이 침투, 신호 전달, 세포 증식 및 분화에 관여하는 중요한 물질로 대부분 TJ의 기능은 다른 구성원과 밀접한 관련이 있는 ZO-1의 파괴와 함께 변형되어진다. 이에 ZO-1은 다양한 조직의 장벽 기능을 관찰하기 위해 중요한 지표 및 마커로 사용되어지고 있다(Liu 등, 2022; Yoo, 2008).
ZO-1 ELISA Kit를 사용하여 CSP-811 및 CSP-532의 ZO-1 생성 효과를 확인한 결과, Fig. 6과 같이 나타내었다. CSP-811 및 CSP-532, 양성 대조군인 RA 모두 농도 의존적으로 증가함을 확인하였으며, P. acnes 단독 처리군 대비 두 추출물은 최종농도인 1,000 μg/mL에서 각각 29.92%, 20.42%의 생성 효과를 보여주었다.
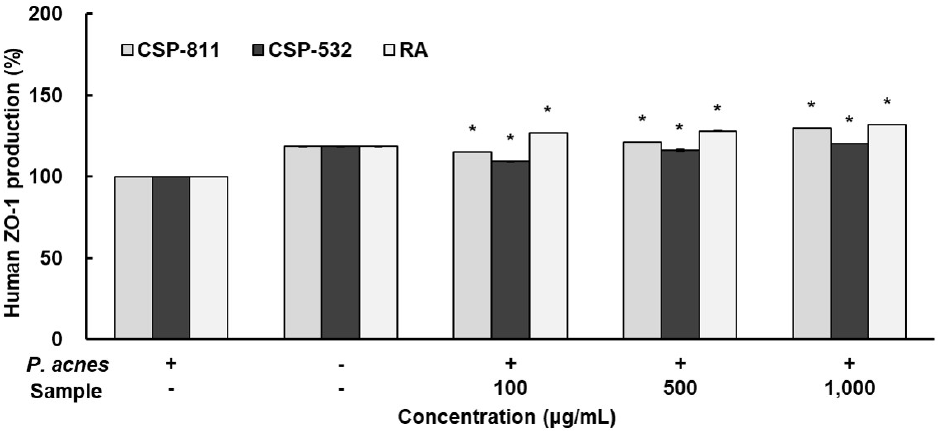
다양한 요인에 의해 발생하는 염증 반응은 대식세포를 활성화시키며, 이는 NO, prostaglandin, cytokine 등을 매개체로 하여 알레르기 등을 유발한다. 특히, RAW 264.7 cell과 같은 대식세포는 LPS의 자극을 통해 다양한 염증성 cytokine 등을 분비하는데, 외부 자극으로부터 신체를 방어하기 위한 목적으로 많은 양의 NO가 생성될 경우 유전자 변형, 조직 손상 등을 일으켜 질병이 발생된다(Park, 2016).
CSP-811 및 CSP-532의 NO 생성 저해 활성은 자극제로 LPS를 사용하였고, 측정 결과는 Fig. 7과 같이 나타내었다. LPS 단독처리군과 무처리군의 NO 생성량 차이를 통해 RAW 264.7 cell에서 염증이 유도되었음을 확인하였으며 각 시료를 농도별(100, 500, 1,000 μg/mL)로 처리하였을 때, CSP-811 및 CSP-532는 모두 LPS 단독 처리군 대비 전 농도구간에서 농도 의존적으로 NO 생성 저해 효과가 나타남을 확인하였다. 또한 양성 대조군으로 사용한 Vit. C보다 모든 농도구간에서 우수한 억제 효과를 나타냈으며 최종 농도인 1,000 μg/mL에서 CSP-811 및 CSP-532는 각각 38.34%와 36.55%의 NO 저해 효과를 보여주었다.
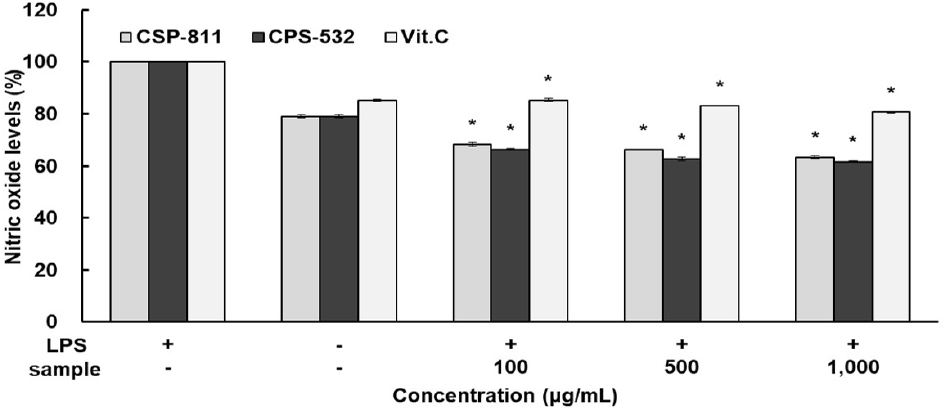
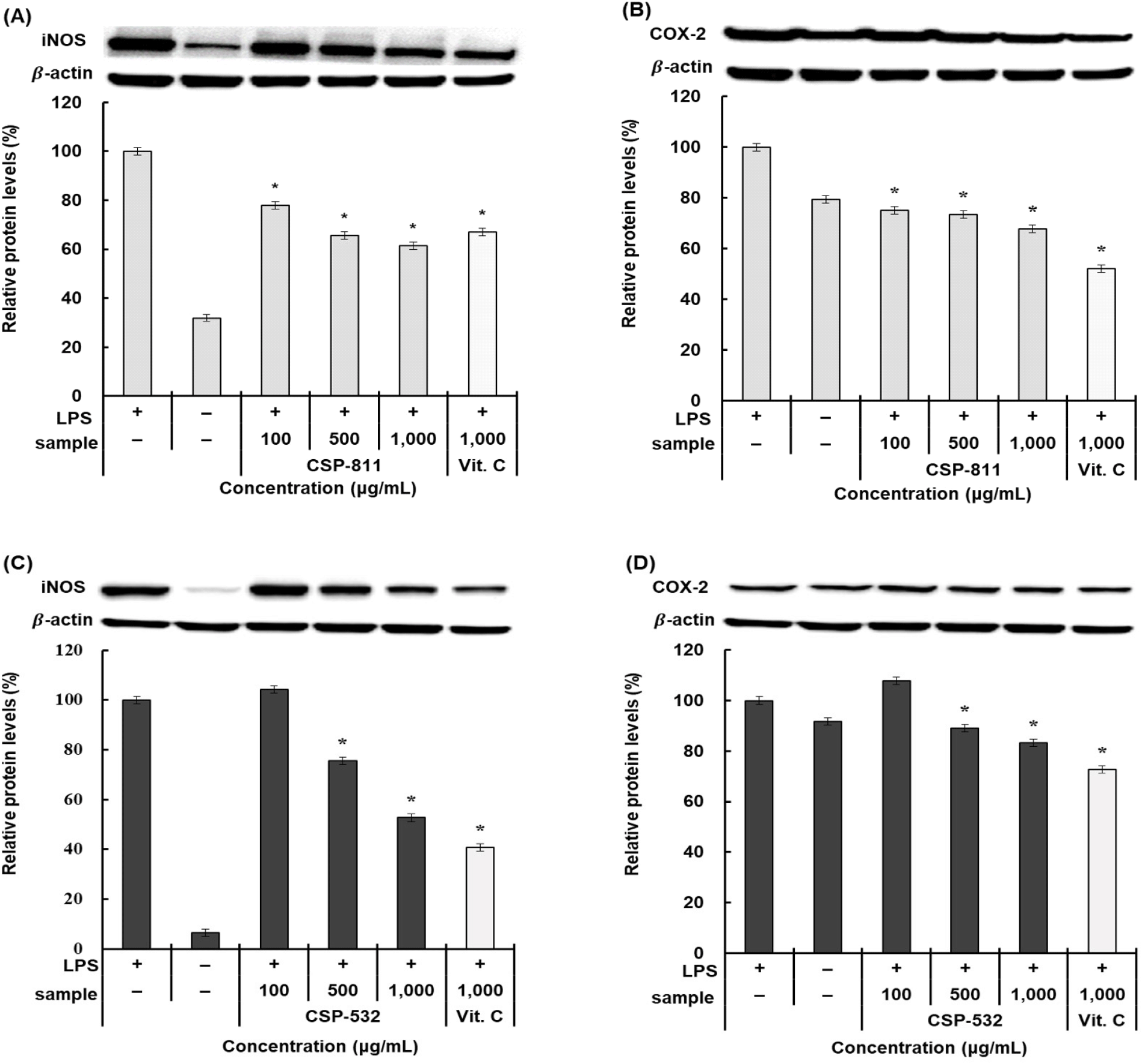
생체에서 macrophage는 체내에 들어온 외부 물질을 세포 독성물질의 분비를 통해 파괴하는 면역세포이다. 이는 LPS 등의 자극을 통해 활성화되며 활성산소, cytokine, NO 등을 발생시키게 된다. 특히 LPS를 통한 대식세포의 자극은 염증 반응 전사인자인 iNOS와 COX-2의 단백질 발현으로 NO와 PGE2를 생성하고, 과량의 NO와 PGE2의 발생은 염증을 악화시킨다고 알려져 있다(Cho, 2017).
따라서, CSP-811 및 CSP-532가 대식세포인 RAW 264.7 cell에서 염증에 관여하는 iNOS 및 COX-2의 단백질 발현 억제 효과를 확인하기 위해 western blot을 통해 측정하였으며, 결과는 Fig. 8과 같이 나타났다. 양성 대조군은 Vit. C를 사용하였으며, 각 인자 측정 시 어떠한 조건에도 상시 일정 발현되는 β-actin을 housekeeping 인자로 이용하여 실험을 진행하였다. CSP-811의 iNOS와 COX-2의 단백질 발현량을 측정한 결과, LPS 단독 처리군과 비교하였을 때 최종 농도인 1,000 μg/mL에서 각각 38.59%, 32.36%의 저해 효과를 보여주었으며, CSP-532는 각각 47.33%, 16.72% 저해함을 확인하였다. CSP-811의 iNOS 저해 효과는 대조군인 Vit. C보다 우수한 효과를 나타내었으며, 최종 농도에서 CSP-811 및 CSP-532 두 추출물의 COX-2 발현량은 무처리군보다 좋은 저해 활성을 나타내었다.
본 연구에서는 각각의 효능을 지닌 괴각, 건강, 으름줄기를 두 가지의 비율로 혼합한 복합추출물을 제조하여 피부 장벽 개선 및 항염증에 대한 효과를 확인하고자 본 실험을 진행하였다. 괴각, 건강, 으름줄기를 8:1:1 비율과 5:3:2 비율로 혼합하여 피부 각질세포인 HaCaT cell에서 피부 장벽에 관여하는 FLG, INV, CLDN-1, ZO-1의 발현을 각각의 ELISA Kit를 통해 측정한 결과, 모두 농도 의존적으로 증가하며 무처리군보다 우수한 생성 효과를 보여주었다. 또한, LPS로 활성화시킨 RAW 264.7 cell에서의 항염증 효능을 측정한 결과, NO 생성과 iNOS 및 COX-2의 단백질 발현을 모두 유의적으로 저해하는 것을 확인하였다. 결론적으로 두 종류의 복합추출물인 CSP-811 및 CSP-532 추출물은 수분 및 이온들의 이동 조절을 위해 세포 사이를 연결하여 피부 장벽을 구성하는 TJ 관련 단백질들의 생성을 증가시키고, 염증 발생에 중요한 역할을 하는 NO, iNOS 및 COX-2를 억제하기에 피부 장벽 강화 및 항염증 효과를 확인하여 이에 기능성 소재로서의 활용 가능성이 있다고 판단되어진다.
4. 요약
본 실험은 괴각, 건강, 으름줄기를 8:1:1 비율과 5:3:2 비율로 혼합한 CSP-811 및 CSP-532 복합추출물을 사용하여 피부 장벽 개선 및 항염 효과에 미치는 영향을 알아보고자 하였다. 먼저 피부 장벽 개선 효과를 알아보기 위해 HaCaT cell을 사용하여 세포 생존율을 측정한 뒤, CSP-811 및 CSP-532와 양성 대조군인 RA 모두 이후 실험에서 95% 이상의 세포 생존율을 보인 100, 50, 1,000 μg/mL의 농도구간을 설정하여 진행하였다. 피부 장벽에 주요한 역할을 하는 FLG, INV, CLDN-1 및 ZO-1의 발현량은 ELISA Kit를 사용하여 측정하였으며, 자극제로는 P. acnes를 사용하였다. 측정 결과, CSP-811에 의해 28.39%, 38.74%, 28.55%, 29.92% 생성되었으며, CSP-532에 의해 30.77%, 29.00%, 36.24%, 20.42% 생성되어짐을 확인하였다. 또한, 항염증 활성을 확인하기위해 대식세포인 RAW 264.7 cell을 사용하여 세포 생존율을 측정하였으며, CSP-811 및 CSP-532와 양성 대조군인 Vit. C는 모두 1,250 μg/mL 이하의 농도구간에서 95% 이상의 세포 생존율을 보여주었다. 따라서 이후 세포 실험은 100, 500, 1,000 μg/mL의 농도구간을 설정하여 진행하였다. LPS를 자극제로 사용하여 NO 생성 저해 활성 측정 결과, 두 추출물은 농도 의존적으로 감소하였으며, 최종 농도인 1,000 μg/mL에서 CSP-811 및 CSP-532는 LPS 단독 처리군 대비 38.34%와 36.55%의 억제 효과를 보여주었다. 이후, 염증 관련 인자인 iNOS와 COX-2의 단백질 발현량을 측정한 결과, CSP-811에 의해 각각 38.59%, 32.36%, CSP-532에 의해 각각 47.33%, 16.72% 감소함을 확인하여 두 복합추출물은 항염 효과가 있음을 확인하였다. 따라서 CSP-811 및 CSP-532 복합추출물은 피부 장벽 개선과 항염 효과가 있음을 확인하여 기능성 소재로써 활용 가능성이 우수할 것으로 판단된다.
