Research Article
자색무 품종별 무와 무청의 비휘발성 대사체 및 항산화 활성 비교
Comparison of metabolites and antioxidative activity in leaves and roots of purple radish cultivars
Seung-Hun Chae
1
, Sang-Hyeon Lee
1
, Jae-Hak Moon
2
, Jeong-Yong Cho
2,*
1전남대학교 원예학과 및 IT-Bio 융합시스템전공
1Department of Horticulture and Interdisciplinary Program in IT-Bio Convergence System, Chonnam National University, Gwangju 61186, Korea
2Department of Integrative Food, Bioscience and Biotechnology, Chonnam National University, Gwangju 61186, Korea
Citation: Chae SH, Lee SH, Moon JH, Cho JY. Comparison of metabolites and antioxidative activity in leaves and roots of purple radish cultivars. Food Sci. Preserv., 31(6), 985-998 (2024)
Copyright © The Korean Society of Food Preservation. This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Oct 11, 2024; Revised: Nov 04, 2024; Accepted: Nov 05, 2024
Published Online: Dec 31, 2024
Abstract
This study aimed to compare non-volatile metabolites and antioxidant activities of three purple radish varieties (cv. Sweet Baby, cv. Jungwoonmu, and cv. Boraking) leaves and roots. The total phenolic and flavonoid contents of the leaves were significantly higher than the roots. Glucosinolate content was significantly higher in the leaves than in the roots. In the purple radish roots, Boraking had the highest total anthocyanin content (420.14±16.2 mg cyanidin-3-glucoside/100 g) when compared to Sweet Baby (351.1±27.3 mg C3G/100 g) and Jungwoonmu (367.1±16.6 mg C3G/100 g). Based on the non-volatile metabolite analysis by liquid chromatography-electrospray ionization-quadrupole time-of-flight-mass spectrometry, 40 compounds, including flavonoid glycosides and coumaroyl glycosides in the leaves and 48 compounds, including various cyanidin glycosides and kaempferol glycosides in the roots were identified. Boraking was clearly classified from Sweet Baby and Jungwoonmu. The leaves of three purple radish cultivars had higher ABTS+ radical scavenging activity and ferric-reducing antioxidant power than the roots. The non-volatile metabolites and antioxidative activities of three purple radishes are expected to be used as basic information in food processing. In addition, the purple radish leaves, which are mostly discarded, will be used as a variety of food materials such as salads, wraps, and various vegetable-based dishes.
Keywords: Raphanus sativus L.; non-volatile metabolites; anthocyanin; antioxidant; LC-QToF-MS
1. 서론
무(Raphanus sativus L.)는 십자화과에 속하는 초본식물로써 전세계적으로 재배 및 소비되고 있다. 우리나라의 4대 채소 중 하나인 무는 김치, 말랭이, 그리고 단무지 등의 형태로, 그리고 무청은 나물, 김치, 시래기, 그리고 샐러드 등으로 널리 소비되고 있다(Gamba 등, 2021; Kim 등, 2010). 이러한 이유로 인해 계절 및 식품 용도에 따라 무병장수(무), 요맘때(알타리무), 그리고 토종조선(열무) 등의 다양한 무 품종들이 재배되고 있다.
무는 항암, 항산화, 간해독, 콜레스테롤 감소, 면역 증진, 그리고 피부 보호 등의 다양한 건강 기능성을 발휘한다고 보고되고 있으며, vitamin류와 mineral이 풍부하고, flavonoid류, phenolic compound, lignan류, terpenoid류, glucosinolate, carotenoid류, 그리고 anthocyanin 등을 포함한 다양한 유용 성분을 함유하고 있다(Gamba 등, 2021; Goyeneche 등, 2015; Koley 등, 2020; Shin 등, 2015; Wang 등, 2013; Zhang 등, 2020). 무청은 flavonoid류, phenolic compound, carotenoid류 등의 유용성분을 함유하고 있다고 보고된 바 있다(Park 등, 2020; Selyutina과 Gapontseva, 2016; Shehata 등, 2014).
무에 함유된 다양한 유용 성분들은 건강기능성에 기여할 뿐만 아니라, 겉모양, 향미 등의 기호적 특성에 영향을 준다고 알려져 있다(Kwak 등, 2017; Mei 등, 2022). 특히 매운맛 성분으로 알려진 glucosinolate류는 항암, 항균, 그리고 항염증을 포함한 여러 생리 활성을 발휘하나, 다량 함유되어 있을 경우 무의 기호적 특성에 부정적인 영향을 주는 주요 인자라고 여겨지고 있다. Glucosinolate류 중 glucoraphanin은 무미, 무취이며, glucoraphasatin은 쓴맛이나 매운맛을 지니고 있다(Bell 등, 2018; Yan 등, 2023). Glucoraphasatin은 무에 함유된 glucosinolate의 90% 이상을 차지하고 있으며, 재배환경, 품종 및 부위에 따라 그 함량 차이가 매우 크다고 보고된 바 있다(Yan 등, 2023).
최근 carotenoid 및 anthocyanin을 함유하고 있는 유색무 품종들은 소비자들에게 건강에 도움을 주는 유용 채소로 주목받고 있다(Hanlon과 Barnes, 2011; Muminović 등, 2005; Zhang 등, 2021). 특히 자색무의 경우 cyanidin 또는 pelargonidin을 기본 구조에 phenolic acid류, 당류, 그리고 유기산이 결합된 다양한 anthocyanin류를 함유하고 있다. 이러한 anthocyanin류는 혈관건강, 항산화, 항염증, 종양 세포 성장 억제, 그리고 비만 억제 등의 다양한 생리 활성을 발휘하다고 알려져 있다(Alappat과 Alappat, 2020; Jaakola 등, 2013; Malien-Aubert 등, 2001; Pang 등, 2023; Wu 등, 2023; Yuan 등, 2023). 최근 자색무 품종들에 따라 anthocyanin의 종류 및 함량 뿐만 아니라 항산화 활성도 다른 것으로 보고된 바 있다(Goswami 등, 2018; Goyeneche 등, 2015). 국내에서 재배되고 있는 자색무 품종들로는 스위트 베이비, 정운무, 보라남, 그리고 보라킹이 있으나, 그 품종에 따라 품질 특성을 이해를 위한 성분학적 연구는 미비한 실정이다.
따라서, 본 연구에서는 우리나라에서 소비되고 있는 자색무 3품종[스위트 베이비(cv. Sweet baby), 정운무(cv. Jungwoonmu), 그리고 보라킹(cv. Boraking)]을 대상으로 LC-QToF-MS를 이용한 비휘발성 대사체 분석을 통해 성분학적 특성을 파악하고자 하였다. 또한, 자색무의 무와 무청에 대한 항산화 활성을 비교하였다.
2. 재료 및 방법
2.1. 실험 재료
본 실험에 사용된 무(Raphanus sativus L.)는 전라남도 함평군에서 2022년 9월 1일에 파종하여 2022년 11월 9일에 수확한 것으로, 자색무는 스위트 베이비(cv. Sweet baby; 소형무), 정운무(cv. Jungwoonmu), 그리고 보라킹(cv. Boraking), 대조군인 백색무는 무병장수(cv. Mubyeongjangsu)를 사용하였다. 세척한 무와 무청을 약 1 cm 이하의 크기로 절편한 다음 동결 건조하여 분말화하였으며, 이를 −80°C에서 보관하여 실험에 사용하였다.
2.2. 총페놀성 화합물 및 총플라보노이드 함량 측정
백색무와 자색무의 무와 무청 건조분말 100 mg을 70% 메탄올 1 mL를 각각 가하여 30분 동안 sonication하여 추출한 다음 4°C에서 293 ×g으로 15분 동안 원심분리하여 상층액을 분리하였다. 백색무(무병장수) 및 자색무(스위트베이비, 정운무, 그리고 보라킹)의 총페놀성 화합물 함량은 Folin-Denis 방법(Hwang 등, 2021)을 변형하여 측정하였다. 이를 각각 감압농축하여 무와 무청 70% 메탄올 추출물을 제조하였다. 각각의 무와 무청 추출물 10 μL와 0.2 N Folin-Denis Reagent 100 μL를 혼합한 다음 상온에서 3분 동안 반응시켰다. 이 반응 용액에 7.5% Na2CO3 포화수용액 80 μL를 가하여 1시간 동안 암소에서 반응시킨 다음, 750 nm에서 분광광도계(MQX200R, BioTek, Winooski, VT, USA)를 이용하여 흡광도를 측정하였다. 이때 표준물질로 gallic acid를 이용하여 표준곡선을 작성하였고, 총페놀성 화합물 함량은 gallic acid으로 상응하는 양(gallic acid equivalent, GAE)으로 환산하여 나타내었다.
백색무 및 자색무의 총플라보노이드 함량은 Ban 등(2018)의 방법을 약간 변형하여 측정하였다. 각각의 무와 무청 추출물 20 μL와 diethylene glycol 180 μL를 혼합한 다음 상온에서 3분 동안 반응시켰다. 이 반응 용액에 1N NaOH 10 μL를 가하여 37°C에서 90분 동안 반응시킨 다음, 427 nm에서 분광광도계(MQX200R, BioTek)를 이용하여 흡광도를 측정하였다. 이때 표준물질로 naringin을 이용하여 표준곡선을 작성하였고, 무와 무청의 플라보노이드 함량은 naringin으로 상응하는 양(naringin equivalent, NAE)으로 환산하여 나타내었다.
2.3. 자색무의 총안토시아닌 함량 측정
자색무 100 mg을 1% trifluoroacetic acid(TFA)이 함유된 70% 메탄올 1 mL에 넣고 암소에서 12시간 동안 추출한 다음, 4°C에서 293 ×g으로 15분 동안 원심 분리(VARISPIN 12 R, CYRSTE)하였다. 얻어진 자색무의 70% 메탄올 추출물 100 μL를 530 nm에서 분광광도계(MQX200R, BioTek)를 이용하여 흡광도를 측정하였다. 이때 표준물질로 cyanidin-3-glucoside를 이용하여 표준곡선을 작성하였고, 총안토시아닌 함량은 cyanidin-3-glucoside으로 환산(equivalent to cyanidin-3-glucoside, C3G)하여 나타내었다.
2.4. Glucosinolate 함량 측정
무와 무청의 glucosinolate는 Moon과 Ku(2022)의 방법으로 정성 및 정량 분석하였다. 무와 무청의 동결건조 분말시료(0.1 g)와 70% 메탄올 2 mL를 혼합하여 95°C에서 10분 동안 추출하였다. 여기에 1 mM sinigrin 500 μL를 가한 다음 4°C에서 293 ×g으로 15분 동안 원심 분리하여 1차 상층액을 얻었다. 잔사에 70% 메탄올 2 mL를 가하여 상기와 동일한 방법으로 추출한 다음 1 mM sinigrin를 가하지 않고 원심 분리하여 2차 상층액을 얻었다. 얻어진 1차와 2차 상등액을 혼합하여 70% 메탄올 추출물을 제조하였다. 제조된 70% 메탄올 추출물 1 mL와 0.5 M lead/barium acetate solution(1 M lead acetate / 1 M barium acetate = 1:1 v/v) 150 μL에 반응시켰다. 이 반응 용액을 4°C에서 293 ×g으로 1분 동안 원심분리 하여 상층액을 얻었다. 얻어진 상층액을 Sephadex A-25 resin에 주입한 다음 0.02 M pyridine acetate 3 mL과 3차증류수 3 mL를 순차적으로 용출하였다. Glucosinolate가 흡착된 컬럼에 sulfatase 500 μL를 넣고 12시간 동안 반응시킨 다음 3차증류수로 3 mL로 glucosinolate를 용출하였다. 용출 용액은 0.22 μm syringe filter로 여과하여 LC-QToF-ESI-MS 분석에 사용하였다.
Glucosinolate의 정성 및 정량은 ACQUITY UPLC® HSS T3(1.8 μm, 2.1×50 mm, Waters Co., Milliford, MA, USA)이 장착된 Ultra-performance liquid chromatography(UPLC: ACQUITY UPLCTM system, Waters Co.)와 ESI-QTOF-MS (MS: Xevo G2-XS; QToF, Waters MS Technologies, Manchester, UK)을 이용하여 분석하였다. Glucosinolate 분리를 위한 UPLC 조건의 경우 이동상 용매는 0.1% formic acid가 함유된 H2O(A)와 acetonitrile(B)을 사용하였고, 0-5 min 0% B, 5-7 min 80% B, 7-9 min 100% B로 하는 gradient 방법으로 용출하였으며, 210-400 nm의 photodiode array(PDA)를 이용하여 검출하였다. 또한, column oven의 온도는 40°C, 유속은 0.2 mL/min으로 하였다. MS 분석은 positive 및 negative ion을 이용하였으며, collision energy는 20-45 eV, ion source 온도는 130°C, desolvation 온도는 200°C로 분석하였다. 내부 표준 물질인 sinigrin의 peak area와 시료에서 검출된 화합물의 peak area를 비율을 구한 다음, 그 값에 response factor를 곱하여 개별 glucosinolate를 정량하였다(Clarke, 2010).
2.5. LC-MS 기반 무와 무청의 대사체 분석
무와 무청 분말의 70% 메탄올 추출물을 Sep-Pak C18 Classic cartridge(360 mg, Waters Co., Wilmslow, UK)에 주입한 다음 3차 증류수 5 mL와 100% acetonitrile(MeCN) 2 mL로 용출하였다. 얻어진 100% MeCN 용출액은 농축하여 0.45 μm membrane filter로 여과한 후 얻어진 여액을 LC-MS 대사체 분석에 사용하였다. 무와 무청의 비휘발성 대사체는 상기의 glucosinolate 함량 측정에 제시한 바와 같이 이동상 용매 용출 조건을 제외하고 동일한 UPLC-QToF-MS 조건으로 분석하였다. UPLC 조건의 경우 무와 무청의 이동상 용매는 0.1% formic acid가 함유된 H2O(A)와 MeCN(B)을 사용하였다. 이 때 이동상 용매의 gradient 용출 방법은 0-4 min 5% B, 4-6 min 10% B, 6-40 min 20% B, 40-50 min 30% B로 하였다. 대사체들은 210-400 nm의 photodiode array(PDA)를 이용하여 검출하였다. 무와 무청에서 검출된 대사체들은 온라인 데이터베이스(MassBank와 Pubmed)를 이용하여 MS fragment ion을 비교하여 동정하였다. Progenesis QI(Waters Co., UK)를 이용하여 화합물들의 intensity를 기반으로 MetaboAnalyst 6.0(https://www.metaboanalyst.ca/)를 이용하여 무 품종별 다변량통계(Principal Component Analysis, PCA)을 실시하였다.
2.6. ABTS+ radical 소거능 및 철환원력 측정
무와 무청의 ABTS+ radical 소거능 활성은 Song 등(2024)의 방법을 약간 변형하여 측정하였다. ABTS+ radical 용액은 7 mM ABTS 수용액과 2.45 mM의 potassium persulfate 수용액을 1:1(v/v) 비율로 혼합하고, 암소에서 12시간 동안 반응시킨 후 734 nm에서 흡광도 값(optical density, OD)이 1.0±0.02가 되도록 증류수로 희석하여 제조되었다. 무와 무청의 70% 메탄올 추출물 용액 10 μL과 ABTS+ radical 수용액 180 μL를 혼합하여 1시간 동안 암소에서 반응시킨 후 735 nm에서 분광광도계(MQX200R, BioTek)를 이용하여 흡광도를 측정하였다. 표준물질인 ascorbic acid를 이용하여 표준곡선을 작성하였고, 무와 무청의 ABTS+ radical 소거능 활성은 ascorbic acid과 상응하는 농도(ascorbic acid equivalent, AAE)로 환산하여 나타내었다.
백색무와 자색무의 철환원력은 Chae 등(2023)의 방법을 약간 변형하여 측정하였다. 무와 무청의 70% 메탄올 추출물 용액 10 μL과 FRAP 반응 용액[300 mM acetate buffer/10 mM 2,4,6-tri(2-pyridyl)-S-triazine(TPTZ) 용액/FeCl3·6H2O 용액 = 10:1:1(v/v)] 190 μL를 혼합하여 37°C에서 10분 동안 반응시킨 다음 593 nm에서 흡광도를 측정하였다. 표준물질인 ascorbic acid를 이용하여 표준곡선을 작성하였고, 무와 무청의 철환원력은 ascorbic acid과 상응하는 농도(AAE)로 환산하여 나타내었다.
2.7. 통계 분석
통계처리는 Prism 5(GraphPad, Northside, San Diego, CA, USA)을 사용하여 일원 분산 분석(one-way analysis of variance)을 실시하였다. 백색무와 자색무 무와 무청의 품종별 항산화 능력(ABTS+ radical 소거능과 철환원력), 총페놀성 화합물 함량, 총플라보노이드 함량, 그리고 총안토시아닌 함량의 유의한 차이는 Tukey’s honestly significant difference test로 사후 검정(p<0.05)을 실시하였다.
3. 결과 및 고찰
3.1. 총페놀성 화합물 및 총플라보노이드 함량
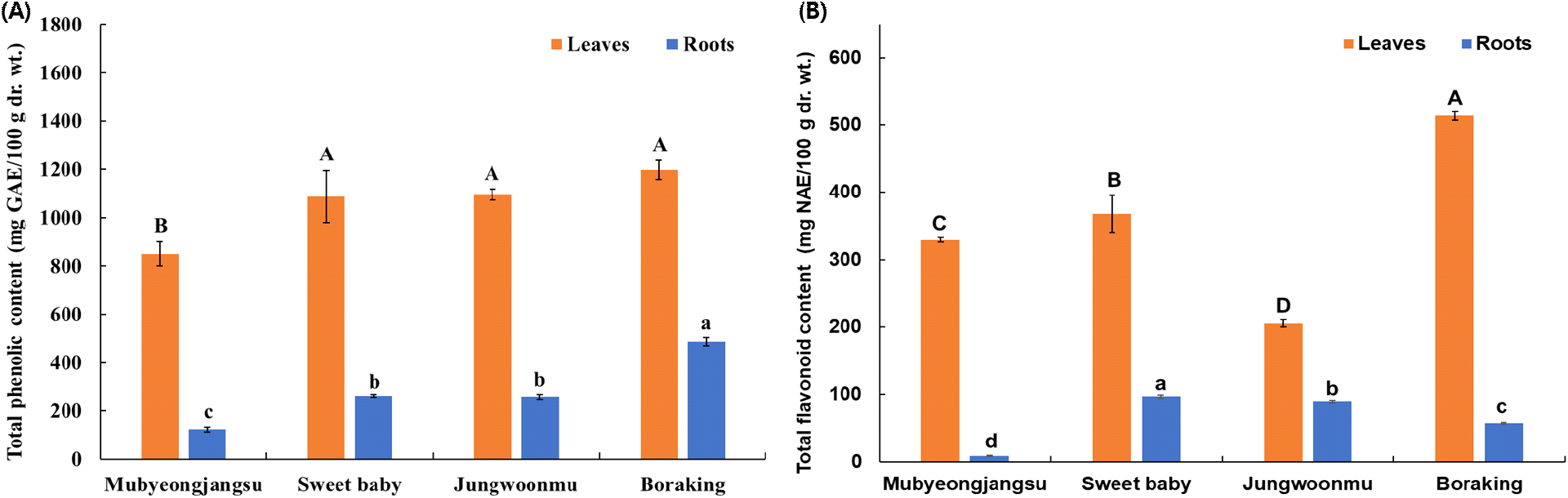
무에 함유된 페놀성 화합물 및 flavonoid류는 항산화, 항비만, 항염증, 혈관 건강, 치매예방 등의 다양한 건강 기능성을 발휘한다고 보고되고 있어, 식품의 건강 우수성을 이해하는 지표 인자로 활용되고 있다(Goyeneche 등, 2015; Koley 등, 2020). 무에는 caffeic acid, ferulic acid, quercetin, luteolin, cyanidin, 그리고 그 관련 배당체들을 포함한 다양한 종류의 페놀성 화합물들을 함유하고 있으나, 그 함량은 품종, 부위(종자, 순, 무청, 그리고 무), 그리고 재배환경에 따라 다르다고 보고되고 있다(Chorol, 2019; Noreen과 Ashraf, 2009). 자색무 또한 anthocyanin류를 비롯한 다수의 페놀성 화합물을 함유하고 있을 것으로 시사된다. 따라서, 자색무 3품종 및 백색무 1품종을 대상으로 무와 무청의 총페놀성 화합물과 총 flavonoid 함량을 조사하였다. 무청의 총페놀성 화합물 함량(850.3-1,197.2 mg GAE/100 g dr. wt.)은 백색무와 자색무 품종 모두 무(123.1-486.5 mg GAE/100 g dr. wt.)에 비해 월등히 높음을 알 수 있었다(Fig. 1A). 또한 자색무 3품종의 경우 무청의 총페놀성 화합물 함량은 1,087.0-1,197.2 mg GAE/100 g dr. wt.로 유의적인 차이를 보이지 않았으나, 대조군으로 사용한 백색무인 무병장수(850.3±50.3 mg GAE/100 g dr. wt.)에 비해 유의적으로 높았다. 무의 경우 자색무 3품종의 총페놀성 화합물 함량은 258.5-486.5 mg GAE/100 g dr. wt.로 대조군인 무병장수에 비해 유의적으로 높았다. 특히, 자색무 품종들 중 보라킹이 가장 높은 총페놀성 화합물 함량(486.5±17.7 mg GAE/100 g dr. wt.)이었다.
Fig. 1.
Total phenolic (A) and total flavonoid (B) contents of different radish cultivar roots and leaves.
Different letters above the bars indicate significant differences (p<0.05). The bars and error bars represent mean±SD (n=3). Different capital letters on the bars represent significant differences between different cultivar leaves. Different small letters on the bars represent significant differences between different cultivar roots. GAE, gallic acid equivalent; NAE, naringin equivalent.
Download Original Figure
무와 무청의 총 flavonoid 함량은 총페놀성 화합물 함량과 유사한 경향이었으나 무 품종들 간의 그 함량은 유의적으로 다소 차이가 있음이 관찰되었다(Fig. 1B). 즉, 무청의 총 flavonoid 함량은 205.2-513.8 mg NAE/100 g dr. wt.로, 무(8.6-97.2 mg NAE/100 g)에 비해 월등히 높았으며, 이는 총페놀성 화합물 함량과 유사한 경향을 나타냈다. 총페놀성 화합물 함량이 가장 높았던 자색무 품종인 보라킹의 무청(513.8±6.7 mg NAE/100 g dr. wt.)은 두 자색무 품종들과 백색무에 비해 유의적으로 가장 높은 총 flavonoid 함량이었다. 그러나, 자색무인 정운무 무청의 총 flavonoid 함량은 자색무 품종들 중 가장 낮은 함량이었으며, 대조군인 무병장수에 비해서도 유의적으로 더 낮은 함량이었다. 무의 경우 자색무 3품종이 백색무에 비해 유의적으로 높은 총 flavonoid 함량이었으나 총페놀성 화합물 함량이 가장 높았던 보라킹 품종은 스위트 베이비(97.2±2.3 mg NAE/100 g dr. wt.)와 정운무(89.3±2.7 mg NAE/100 g dr. wt.)에 비해 다소 낮은 함량(57.0±1.4 mg NAE/100 g dr. wt.)을 나타냈다.
무청은 무에 비해 상대적으로 총페놀성 화합물 및 총 flavonoid 함량이 높다고 보고되고 있으며(Goyeneche 등, 2015; Kim 등, 2010; Orak, 2007), 이는 본 연구 결과와 일치하였다. 자색무는 백색무와 총페놀성 화합물과 총 flavonoid 함량이 유사하다고 보고하였으나(Mohammed 등, 2022), 이와 달리 본 실험에 사용된 자색무 3 품종들 모두 백색무인 무병장수에 비해 높은 총페놀성 화합물 함량이었으며, 총 flavonoid 함량 또한 자색무인 정운무를 제외하고 높은 경향이었다. 자색무의 총페놀성 화합물 및 총 flavonoid 함량은 재배환경 및 수확시기에 따라 다를 수 있으나 특히 총페놀성 화합물 및 총 flavonoid 함량이 품종에 따라 다름을 알 수 있었다.
3.2. 총안토시아닌 함량
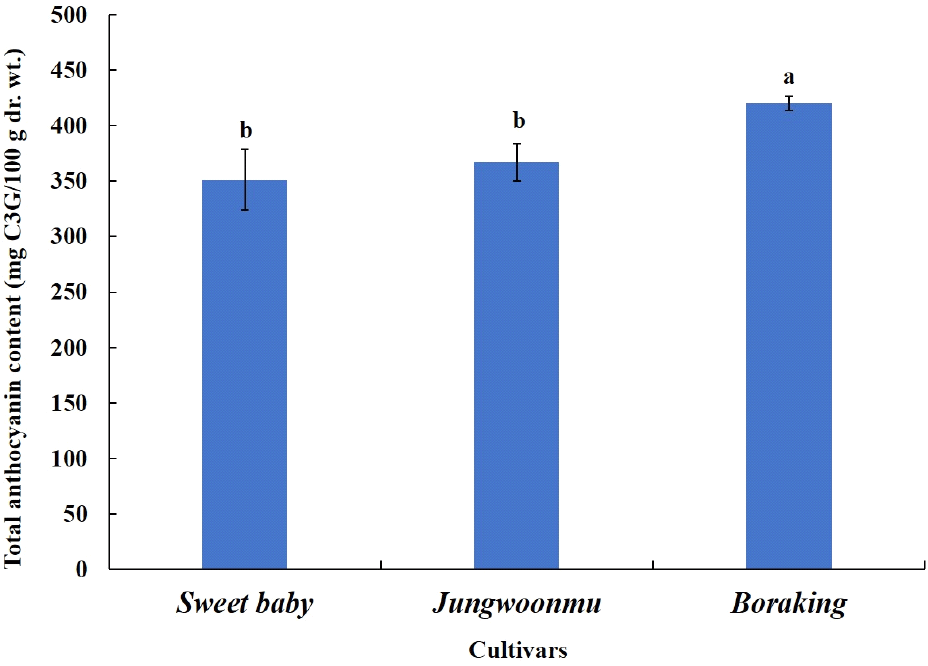
Anthocyanin류는 식품의 청색 또는 적색 색소 화합물로, 혈관 개선, 항산화, 항염증 등 다양한 건강 기능성이 우수하다고 보고되고 있다(Garcia와 Blesso, 2021; Mozos 등, 2021). 자색무에는 anthocyanin류 중 cyanidin을 기본 골격에 glycose, organic acid, phenolic acid 등이 결합된 형태로 존재하고 있다고 알려져 있으며, 품종에 따라 anthocyanin류 함량의 차이가 크다고 보고된 바 있다(Giusti와 Wrolstad, 2003; Liu 등, 2024). Anthocyanin류는 무에 대부분 존재하며 무청에 극히 일부 함유하고 있으나 본 실험에 사용했던 자색무 3품종 모두 무청에는 적색을 띠지 않음을 육안으로 관찰되었다. 따라서, 무청을 제외하고 자색무 3품종의 무를 대상으로 총 anthocyanin 함량을 조사하였다. 그 결과(Fig. 2), 보라킹의 총 anthocyanin 함량은 420.14±6.56 mg C3G/100 g dr. wt.로, 정운무(367.10± 16.61 mg C3G/100 g)와 스위트 베이비(351.09±27.33 mg C3G/100 g)에 비해 유의적으로 높았다. 적색무의 총 anthocyanin 함량은 63.77-500 mg/100 g dr. wt.로, 품종에 따라 그 함량이 매우 다르다고 보고되고 있다(Jing 등, 2012; Lim 등, 2023). 본 실험의 사용된 자색무 3품종들은 다른 유색무 품종들에 비해 anthocyanin 함량이 상대적으로 높은 것으로 사료된다.
Fig. 2.
Total anthocyanin content of different purple radish cultivar roots.
Different letters above the bars indicate significant differences (p<0.05). The error bars represent mean±SD (n=3). C3G, cyanidin-3-glucoside.
Download Original Figure
3.3. Glucosinolate 함량
Glucosinolate류는 황을 함유하고 있는 2차대사산물로, 무, 브로콜리, 배추와 같은 Brassicaceae속 식물에서 주로 함유되어 있으며, 항산화, 항염증, 심혈관질환 예방, 그리고 뇌신경세포 보호 등 다양한 생리활성을 발휘한다고 보고되고 있다(Mithen, 2001). 그러나, glucosinolate류는 매운맛이나 쓴맛이 지니고 있어 무에 다량으로 함유하고 있을 경우 맛에 부정적인 영향을 주는 화합물로 인식되고 있다(Bell 등, 2018; Yan 등, 2023). 따라서, 국내에서 재배되고 있는 자색무 3품종의 무와 무청을 대상으로 LC-MS 분석을 통해 glucosinolate류를 정성 및 정량하였다. 그 결과(Table 1), 무청에서는 glucoraphasatin, glucobrassicin, 그리고 glucoraphanin를 비롯한 3종의 glucosinolate류가 검출되었다. 무청의 LC-MS에서 검출된 3종의 glucosinolate류 중 glucoraphasatin은 현저하게 높은 함량이었으며, 그 다음으로는 glucobrassicin이었다. 특히 매운맛과 쓴맛을 지닌 glucoraphasatin 함량은 자색무인 정운무의 무청(36.88±4.14 mmole/100 g DW)이 다른 자색무 품종인 스위트베이비(19±2.15 mmole/100 g DW)와 보라킹(18.88±0.27 mmole/100 g DW)에 비해 2배 이상 높은 함량이었다. Glucoraphasatin는 스위트베이비와 보라킹 또한 백색무인 무병장수에 비해 유의적으로 낮은 함량이었다. 무에서는 3종의 glucosinolate류 중 glucoraphasatin와 glucoraphenin가 주 화합물로, glucobrassicin는 극미량으로 LC-MS 분석에서 검출되었다. 무에서의 glucosinolate류 함량은 무청에 비해 20배 이상 매우 낮았다. Glucoraphasatin와 glucoraphanin 함량은 자색무와 백색무 품종들 간에 유의적인 차이가 관찰되었으나, 그 함량은 크지 않았다.
Table 1.
Glucosinolates content of different radish cultivar leaves and roots
|
Parts |
Cultivars |
Glucosinolate contents (mmole/100 g dr. wt.) |
|
Glucoraphenin |
Glucobrassicin |
Glucoraphasatin |
Total |
|
Leaves |
Mubyeongjangsu
|
1.30±0.22b1)
|
2.09±0.32c
|
24.72±2.88b
|
28.10±2.95b
|
|
Sweet baby
|
1.69±0.07a
|
5.20±0.90c
|
15.19±2.15c
|
22.08±3.00b
|
|
Jungwoonmu
|
0.66±0.05c
|
4.12±0.61b
|
36.88±4.14a
|
41.67±4.73a
|
|
Boraking
|
1.40±0.08ab
|
8.96±0.91a
|
18.88±0.27bc
|
28.43±1.08b
|
|
Roots |
Mubyeongjangsu
|
0.13±0.06a
|
Trace |
1.08±0.14a
|
1.21±0.08a
|
|
Sweet baby
|
0.09±0.01a
|
Trace |
1.04±0.07a
|
1.13±0.06a
|
|
Jungwoonmu
|
0.11±0.01a
|
Trace |
1.06±0.09a
|
1.16±0.10a
|
|
Boraking
|
0.06±0.01b
|
Trace |
0.76±0.06b
|
0.82±0.06b
|
Download Excel Table
Glucosinolate류는 품종, 부위(새싹, 줄기, 그리고 잎), 재배환경에 따라 그 종류와 함량이 다르다고 보고되고 있다(Biondi 등, 2021; Kang 등, 2020; Lee 등, 2024; Tong 등, 2021). 특히 무청은 가뭄이나 고온 스트레스 등의 재배환경 인자에 직접적인 영향을 받아 다른 부위에 비해 glucosinolate류의 함량이 높다고 알려져 있다. 유색무(적색무, 자색무 등)의 glucosinolate 함량은 백색무에 비해 상대적으로 높다고 보고된 바 있다(Hanlon과 Barnes, 2011). 본 실험에 사용한 자색무 품종들 중 무청의 경우 스위트 베이비가 가장 높은 glucosinolate 함량이었으며 그 외 두 품종들은 백색무인 무병장수와 유사하거나 낮은 함량이었고 무의 경우 자색무 3품종 모두 백색무와 비슷하거나 유의적으로 낮은 glucosinolate 함량이었다. 또한, 적색무는 anthocyanin 함량이 증가할수록 glucosinolate 함량이 증가하는 경향이었으나(Jing 등, 2012), 이와 달리 본 실험에 사용된 자색무 품종들은 총 anthocyanin 함량이 높고 glucosinolate 함량이 낮은 경향이었다. 이상의 결과를 종합해 보면, 무청과 무의 glucosinolate 함량은 재배환경 외에도 품종에 기인된 것으로 사료되며, 국내산 자색무 품종들은 다른 유색무 품종들에 비해 그 함량이 상대적으로 낮은 것으로 판단된다.
3.4. LC-MS 기반 무청과 무의 비휘발성 대사체 분석
자색무 품종 및 부위(무와 무청)에 따라 총페놀성 화합물, 총 flavonoid, 총 안토시아닌, 그리고 개별 glucosinolate 함량이 다소 차이가 있음을 알 수 있었다. 자색무 품종 및 부위(무와 무청)에 따른 개별 페놀성 화합물, flavonoid류, anthocyanin류, glucosinolate류 등을 비롯한 주요 유용 화합물들을 보다 정밀하게 이해하고자 LC-MS 기반 비휘발성 대사체 및 다변량 통계분석을 실시하였다.
3.4.1. 무청
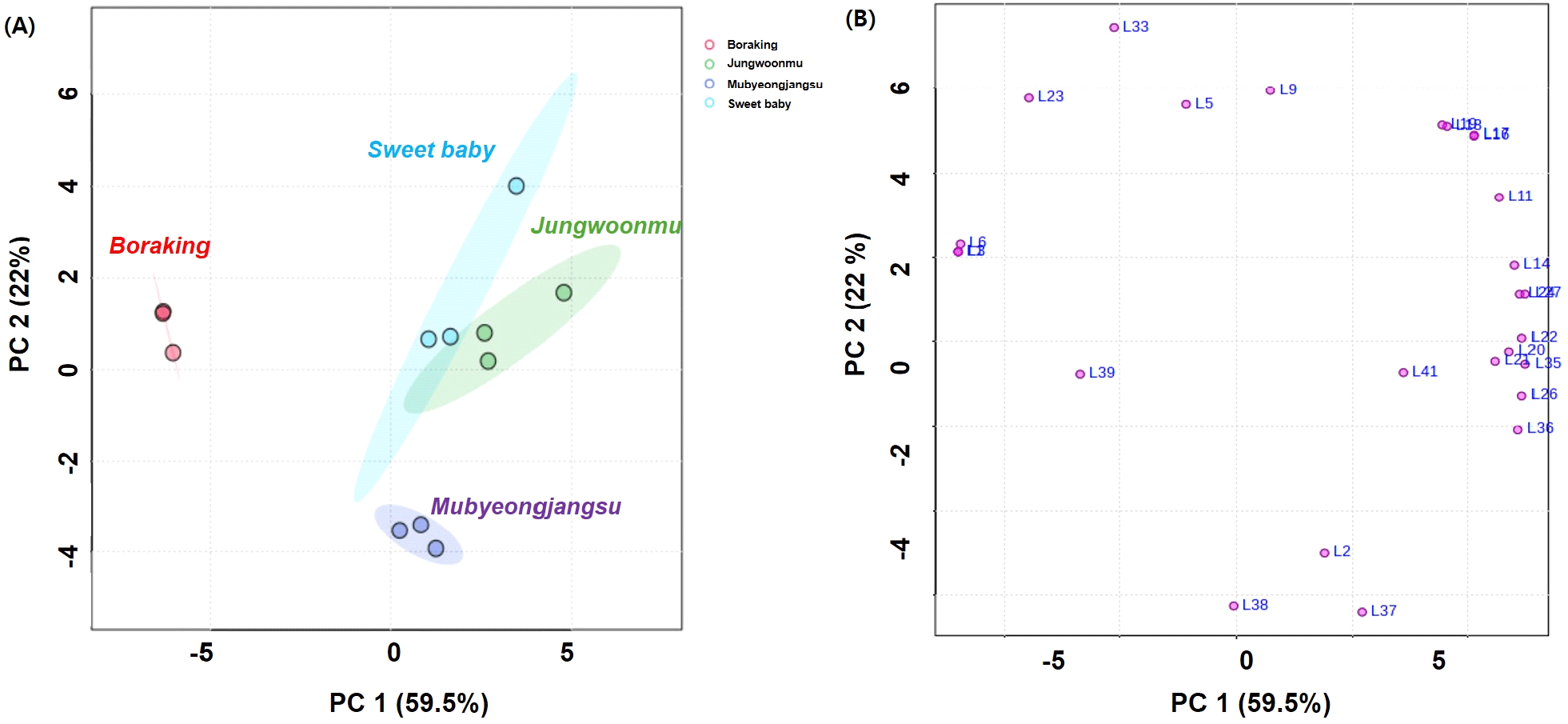
자색무 3품종와 백색무 1종의 무청을 대상으로 UPLC-ESI -QTOF-MS(positive 및 negative) 분석을 실시한 결과(Table 2), LC-MS TIC chromatogram에서 40종의 주요 대사체들이 검출되었으며, MS spectra를 기반으로 PubChem, Massbank, HMDB, 및 FoodDB를 이용하여 그 대사체들을 동정할 수 있었다. 무청에서 동정된 대사체들은 4종의 glucosinolate류 및 6종의 coumaric acid 유도체들을 비롯한 다수의 flavonoid glycoside 유도체들로 동정되었다. 특히 무청에서는 ferulic acid, caffeic acid, 그리고 sinapinic acid 등을 기본 구조로 하는 phenylpropanoic acid 유도체들이, naringin과 quercetin, luteolin, 그리고 apigenin을 기본 골격으로 하는 flavonoid glycoside류가 다수 동정되었다. 이는 선행문헌(Koley 등, 2020; Lin 등, 2011; Zhu 등, 2015)에서 보고된 바 있는 무의 대사체 결과와 일치하였다. 자색무 품종에 따른 무청의 주요 대사체를 이해하고자, 주성분 분석(principal component analysis, PCA)을 실시하였다. 그 결과(Fig. 3A), 자색무 품종들 중 보라킹은 다른 2종의 자색무인 스위트베이비와 정운무와 확연하게 구별되었으며, 이때 PC 1과 PC 2는 59.5%와 22%이었다. 2종의 자색무인 스위트베이비와 정운무는 자색무인 보라킹보다 백색무인 무병장수와 확연하게 구별되지는 않는 것으로 보아, 이들 품종의 무청에서 검출된 대사체들의 종류 및 함량이 유사한 것으로 여겨진다. 특히 보라킹에는 glucobrassicin과 caffeoyl glucoside류가, 스위트베이비와 정운무에는 apigenin, quercetin, luteolin 등의 비롯한 다수의 flavonoid glycoside류가 상대적으로 높은 함량임을 PCA loading plot에서 확인할 수 있었으며 자색무 품종에 따라 개별 대사체들 함량도 다소 차이가 있음이 관찰되었다(Fig. 3B). 자색무의 총페놀성 화합물 및 flavonoid 함량은 coumaroic acid 유도체들과 flavonoid glycoside들이 주로 기인하는 것으로 판단된다. 특히 총페놀성 화합물 함량이 가장 높았던 보라킹 무청에는 다른 자색무 품종에 비해 caffeoyl glucoside류를 비롯한 coumaric acid 유도체들이 다량 함유되어 있는 것으로 여겨진다. 또한, LC-MS 대사체 분석 결과에서 스위트베이비와 정운무는 flavonoid glycoside류가 다량 함유되어 있을 것으로 나타났으나 총 flavonoid 함량과는 일치하지는 않았다. 자색무에 함유되어 있는 개별 coumaric acid 유도체들과 flavonoid glycoside류의 정량적 연구가 앞으로 필요할 것으로 판단된다.
Table 2.
MS results of metabolites identified in different cultivar radish leaves
|
No. |
tR
|
Fragment ions (m/z) |
Molecular weight |
Molecular formula |
Predicted compounds |
|
Positive |
Negative |
|
L1 |
6.92 |
365.08 ([M+Na]+) |
341.08 ([M-H]−) |
342 |
C15H18O9
|
Caffeoyl glucose |
|
L2 |
7.20 |
420.04 ([M+H]+), 362.07 |
418.03 ([M-H]−) |
419 |
C12H21NO9S3
|
Glucoraphasatin |
|
L3 |
7.27 |
365.08 ([M+Na]+) |
341.08 ([M-H]−) |
342 |
C15H18O9
|
Caffe oyl glucose isomer 1 |
|
L4 |
7.27 |
420.04 ([M+H]+), 362.07 |
418.03 ([M-H]−) |
419 |
C12H21NO9S3
|
Glucoraphasatin |
|
L5 |
7.42 |
391.09, 362.07 |
447.05 ([M-H]−) |
448 |
C16H20N2O9S2
|
Glucobrassicin |
|
L6 |
7.51 |
391.09, 362.07 |
447.05 ([M-H]−) |
448 |
C16H20N2O9S2
|
Glucobrassicin isomer 1 |
|
L7 |
8.59 |
379.10 ([M+Na]+) |
355.10 ([M-H]−) |
356 |
C16H20O9
|
Feruloyl glucose |
|
L8 |
9.01 |
379.10 ([M+Na]+) |
355.10 ([M-H]−) |
356 |
C16H20O9
|
Feruloyl glucose isomer 1 |
|
L9 |
9.32 |
409.18 ([M+Na]+) |
431.19 ([M-H]−) |
388 |
C18H28O9
|
Hydroxyjasmonic acid-glucoside |
|
L10 |
9.75 |
409.18 ([M+Na]+) |
431.19 ([M-H]−) |
388 |
C18H28O9
|
Hydroxyjasmonic acid-galactoside |
|
L11 |
11.09 |
611.16 ([M+H]+) |
609.14 ([M-H]−) |
610 |
C27H30O16
|
Quercetin-O-rhamnosylglucoside |
|
L12 |
11.60 |
611.16 ([M+H]+) |
609.14 ([M-H]−) |
610 |
C27H30O16
|
Quercetin-O-rhamnosylgalactoside |
|
L13 |
11.80 |
611.16 ([M+H]+) |
609.14 ([M-H]−) |
610 |
C27H30O16
|
Quercetin-O-rhamnosylglucoside isomer 1 |
|
L14 |
12.33 |
581.15 ([M+H]+) |
579.13 ([M-H]−) |
580 |
C27H32O14
|
Naringin |
|
L15 |
12.33 |
611.16 ([M+H]+) |
609.14 ([M-H]−) |
610 |
C27H30O16
|
Quercetin-O-rhamnosylgalactoside isomer 1 |
|
L16 |
12.62 |
595.16 ([M+H]+) |
593.14 ([M-H]−) |
594 |
C27H30O15
|
Luteolin-O-rhamnosylglucoside |
|
L17 |
12.62 |
617.14 ([M+H]+) |
661.13 ([M-H+FA]−) |
616 |
C29H28O15
|
Dicaffeoyl-succinoyl-quinic acid |
|
L18 |
13.30 |
595.16 ([M+H]+) |
593.14 ([M-H]−) |
594 |
C27H30O15
|
Luteolin-O-rhamnosylglucoside isomer 1 |
|
L19 |
13.30 |
617.14 ([M+H]+) |
661.13 ([M-H+FA]−) |
616 |
C29H28O15
|
Dicaffeoyl-succinoyl-quinic acid isomer 1 |
|
L20 |
13.58 |
595.16 ([M+H]+) |
593.14 ([M-H]−) |
594 |
C27H30O15
|
Luteolin-O-rhamnosylglucoside isomer 2 |
|
L21 |
13.58 |
617.14 ([M+H]+) |
661.13 ([M-H+FA]−) |
616 |
C29H28O15
|
Dicaffeoyl-succinoyl-quinic acid isomer 2 |
|
L22 |
13.58 |
565.15 ([M+H]+) |
563.13 ([M-H]−) |
564 |
C26H28O14
|
Apigenin-apiosylglucoside |
|
L23 |
13.65 |
- |
539.14 ([M-H]−) |
540 |
C24H28O14
|
Syringyl-glucopyranose |
|
L24 |
13.65 |
595.16 ([M+H]+) |
593.14 ([M-H]−) |
594 |
C27H30O15
|
Luteolin-O-rhamnosylglucoside isomer 3 |
|
L25 |
13.65 |
617.14 ([M+H]+) |
661.13 ([M-H+FA]−) |
616 |
C29H28O15
|
Dicaffeoyl-succinoyl-quinic acid isomer 3 |
|
L26 |
13.65 |
565.15 ([M+H]+) |
563.13 ([M-H]−) |
564 |
C26H29O14
|
Apigenin-apiosylglucoside isomer 1 |
|
L27 |
14.23 |
595.16 ([M+H]+) |
593.14 ([M-H]−) |
594 |
C27H30O15
|
Luteolin-O-rhamnosylglucoside isomer 4 |
|
L28 |
14.23 |
617.14 ([M+H]+) |
661.13 ([M-H+FA]−) |
616 |
C29H28O15
|
Dicaffeoyl-succinoyl-quinic acid isomer 4 |
|
L29 |
14.23 |
565.15 ([M+H]+) |
563.13 ([M-H]−) |
564 |
C26H29O14
|
Apigenin-apiosylglucoside isomer 2 |
|
L30 |
14.29 |
595.16 ([M+H]+) |
593.14 ([M-H]−) |
594 |
C27H30O15
|
Luteolin-O-rhamnosylglucoside isomer 5 |
|
L31 |
14.29 |
617.14 ([M+H]+) |
661.13 ([M-H+FA]−) |
616 |
C29H28O15
|
Dicaffeoyl-succinoyl-quinic acid isomer 5 |
|
L32 |
14.29 |
565.15 ([M+H]+) |
563.13 ([M-H]−) |
564 |
C26H29O14
|
Apigenin-apiosylglucoside isomer 3 |
|
L33 |
14.55 |
- |
539.14 ([M-H]−) |
540 |
C24H28O11
|
Syringyl-glucopyranose isomer 1 |
|
L34 |
14.55 |
595.16 ([M+H]+) |
593.14 ([M-H]−) |
594 |
C27H30O15
|
Luteolin-O-rhamnosylglucoside isomer 6 |
|
L35 |
16.19 |
579.17 ([M+H]+) |
577.15 ([M-H]−) |
578 |
C27H30O14
|
Lespedin |
|
L36 |
16.77 |
579.17 ([M+H]+) |
577.15 ([M-H]−) |
578 |
C27H30O14
|
Lespedin isomer 1 |
|
L37 |
29.18 |
671.32 ([M+Na]+) |
693.33 ([M-H+FA]−) |
648 |
C31H52O14
|
Decanoyl-isobutanoyl-(methylbutenoyl)sucrose |
|
L38 |
30.78 |
509.27 ([M+Na]+) |
531.28 ([M-H+FA]−) |
486 |
C25H42O9
|
Monogalactosylmonoacylglycerols (MGMG) 16:3 |
|
L39 |
31.19 |
509.27 ([M+Na]+) |
531.28 ([M-H+FA]−) |
486 |
C25H42O9
|
MGMG 16:3 isomer 1 |
|
L40 |
31.26 |
699.37 ([M+Na]+) |
721.37 ([M-H+FA]−), 675.36 ([M-H]−) |
676 |
C33H56O14
|
Digalactosyldiacylglycerol (DGMG) 18:3 |
|
L41 |
33.10 |
537.30 ([M+Na]+) |
559.31 ([M-H+FA]−) |
514 |
C27H46O9
|
MGMG 18:3 |
Download Excel Table
Fig. 3.
Principal component analysis (PCA) score plot (A) and loading plot (B) of different radish cultivar leaves (cv. Mubyeongjangsu, cv. Sweet baby, cv. Jeonwoonmu, and cv. Boraking).
L1-L41 are metabolite number presented in Table 2.
Download Original Figure
3.4.2. 무
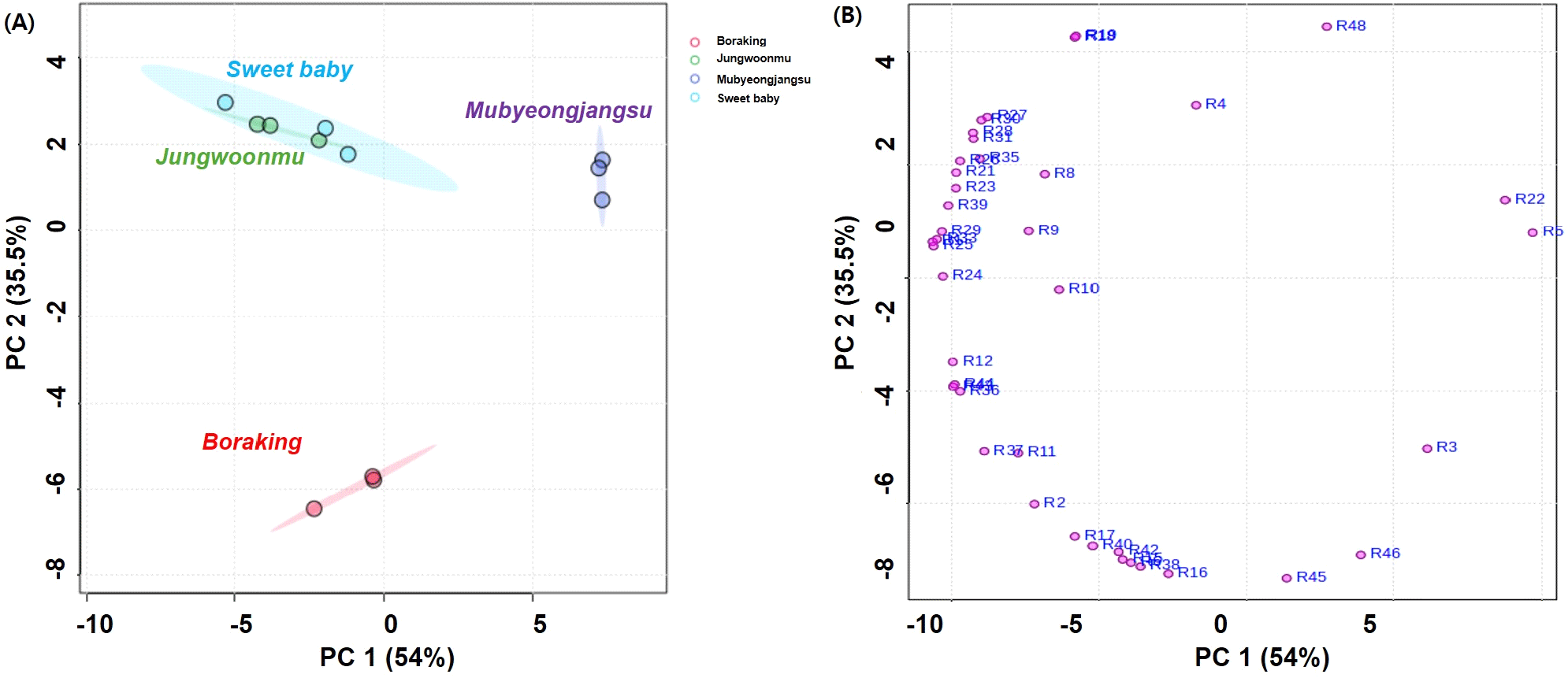
자색무 3품종와 백색무 1종의 무를 대상으로 무청과 동일한 방법으로 UPLC-ESI-QTOF-MS(positive 및 negative) 분석을 실시한 결과, LC-MS TIC chromatogram에서 48종의 주요 대사체들이 검출되었다(Table 3). 특히, 무에서는 amino acid류, glucosinolate류, phenylpropanoic acid류, kaempferol glycoside류, 그리고 다수의 cyanidin glycoside류가 동정되었으며, 이러한 대사체들은 선행문헌(Koley 등, 2020; Lin 등, 2011; Zhu 등, 2015)에서 보고한 결과와 매우 유사하였다. 앞서 설명한 바와 같이 LC-MS를 이용한 백색무와 자색무의 glucosinolate류 정성 및 정량 결과에서 2종의 glucosinolate류(glucoraphanin과 glucoraphasatin)가 검출되었으나, LC-MS 대사체 분석에서는 glucoerucin, glucobrassicin, neoglucobrassicin, 그리고 raphanin 등을 비롯한 다수의 glucosinolate 유도체들이 주된 화합물로 검출되었다. 자색무의 무청에서는 apigenin, quercetin, luteolin 등의 비롯한 다수의 flavonoid glycoside류가 동정되었으나, 무에서는 무청과 달리 cinnamic acid류 또는 organic acid류가 결합되어 있어 다수의 kaempferol glycoside류였음을 알 수 있었다. 또한, 무청에서 주요 화합물로 검출되지 않았던 다수의 anthocyanin류가 자색무에서 동정되었다. 특히 자색무에서 동정된 14종의 주요 anthocyanin류는 cyanidin에 organic acid류와 phenylpropanoic acid류가 1종 또는 2종 이상 결합된 화합물들이었으며, organic acid류로는 malonic acid가, phenylpropanoic acid류로는 caffeic acid, sinapinic acid, ferulic acid, coumaric acid였다. 자색무에는 organic acid류와 phenylpropanoic acid류가 결합된 pelargonidin glycoside류가 다수 검출되었다고 보고된 바 있으나(Koley 등, 2020; Lin 등, 2011; Zhu 등, 2015), 이 화합물들은 본 연구에서 사용된 자색무 품종들에서 검출되지 않았다. 이는 pelargonidin glycoside류가 분석 한계 이하의 매우 미량으로 함유되어 있을 것으로 해석된다. 자색무 품종에 따른 무의 주요 대사체들을 이해하고자, 주성분 분석(PCA)을 실시하였다. 그 결과(Fig. 4A), 자색무 품종들 중 보라킹은 다른 2종의 자색무인 스위트베이비와 정운무와 확연하게 구별되었으며, 이때 PC1과 PC2는 54.6%와 32.8%이었다. 자색무 품종들은 백색무인 무병장수와도 확연하게 구별되었다. 특히 보라킹에는 glucobrassicin와 anthocyanin류(cyanidin-3-O-coumaroylferulorylsophoroside-5-O-malonylglucoside, cyanidin-3-O-caffeoylsophoroside-5-O-malonyldiglucoside 등)과 phenylpropanoic acid glycoside류(feruloryl glucoside, coumaroyl glucoside 등)이, 스위트베이비와 정운무에는 cyanindin류(cyanidin-3-O-coumaroylsophoroside-5-O-malonylglucoside, cyanidin-3-O-feruloylsophoroside-5-O-malonylglucoside 등)과 flavonoid 배당체인 kaempferol-coumaroyl triglucoside가 상대적으로 높은 함량임을 PCA loading plot에서 확인할 수 있었으며, 자색무 품종에 따라 개별 대사체들의 함량 또한 다름이 관찰되었다(Fig. 4B). 자색무의 총페놀성 화합물 및 총 flavonoid 함량은 cyanidin glycoside류와 kaempferol glycoside류가 크게 기인한 것으로 판단된다. 자색무 품종인 보라킹은 스위트베이비와 정운무에 높은 총 anthocyanin 함량을 나타내 보라킹 무는 다른 자색무에 비해 cyanidin glycoside류를 다수 또는 다량 함유하고 있는 것으로 판단된다. Anthocyanin류는 항산화, 혈관개선, 항암, 그리고 항염증과 같은 다양한 생리활성을 발휘하나, 이러한 효능은 그 구조적 차이에 따라 다르다고 보고되고 있다(Goyeneche 등, 2015; Liu 등, 2021; Noman 등, 2021). 그러나, 자색무에 함유된 anthocyanin류의 대부분은 LC-MS 분석을 통한 추정구조만을 제시하고 있어 그 정확한 구조해석을 통한 개별 함량 및 효능 검증에 대한 보다 체계적인 연구가 요구된다.
Table 3.
MS results of metabolites identified in different cultivar radish root
|
No. |
tR
|
Fragment ions (m/z) |
Molecular weight |
Molecular formula |
Predicted compounds |
|
Positive |
Negative |
|
R1 |
6.56 |
251.15 ([M+H]+), 121 |
249.13 ([M-H]−) |
251 |
C12H18N4O2
|
Agmatine derivative |
|
R2 |
6.70 |
205.09 ([M+H]+), 188 |
203.98 ([M-H]−) |
204 |
C11H12N2O2
|
Tryptophan |
|
R3 |
6.70 |
323.07 ([M+Na]+) |
299.07 ([M-H]−), 137.02 |
300 |
C13H16O8
|
Hydroxybenzoic acid-glucoside |
|
R4 |
6.77 |
251.15 ([M+H]+), 121 |
249.13 ([M-H]−) |
251 |
C12H18N4O2
|
Agmatine derivative isomer 1 |
|
R5 |
6.89 |
205.09 ([M+H]+), 188 |
203.98 ([M-H]−) |
204 |
C11H12N2O2
|
Tryptophan |
|
R6 |
6.92 |
298.09 ([M+H]+), 136 |
296.08 ([M-H]−) |
297 |
C11H12N5O3S |
Methythioadenosine |
|
R7 |
6.98 |
114.03, 132.04 |
420.04 ([M-H]−) |
421 |
C12H23NO9S3
|
Glucoerucin |
|
R8 |
7.08 |
358.10, 380.08 |
436.04 ([M-H]−) |
437 |
C12H23NO10S3
|
Glucoraphanin |
|
R9 |
7.13 |
420.04 ([M+H]+), 362.07 |
418.03 ([M-H]−) |
419 |
C12H21NO9S3
|
Glucoraphasatin |
|
R10 |
7.23 |
420.04 ([M+H]+), 362.07 |
418.03 ([M-H]−) |
419 |
C12H21NO9S3
|
Glucoraphasatin isomer 1 |
|
R11 |
7.35 |
391.09, 362.07 |
447.05 ([M-H]−) |
448 |
C16H20N2O9S2
|
Glucobrassicin |
|
R12 |
7.45 |
365.12 ([M+Na]+) |
387.12 ([M-H+FA]−),
341.12 ([M-H]−) |
342 |
C15H18 O9
|
Caffeic acid-glucose |
|
R13 |
7.50 |
391.09, 362.07 |
447.05 ([M-H]−) |
448 |
C16H20N2O9S2
|
Glucobrassicin isomer 1 |
|
R14 |
7.66 |
365.12 ([M+Na]+) |
387.12 ([M-H+FA]−),
341.12 ([M-H]−) |
342 |
C15H18 O9
|
Caffeoyl glucose isomer 1 |
|
R15 |
8.01 |
349.09 ([M+Na]+) |
325.09 ([M-H]−), 145.02 |
326 |
C15H18 O8
|
Coumaroyl glucoside |
|
R16 |
8.83 |
379.10 ([M+Na]+) |
355.10 ([M-H]−) |
356 |
C16H20 O9
|
Feruloyl glucose |
|
R17 |
9.00 |
379.10 ([M+Na]+) |
355.10 ([M-H]−) |
356 |
C16H20 O9
|
Feruloyl glucose isomer 1 |
|
R18 |
9.10 |
421.11, 399.13 |
477.06 ([M-H]−) |
478 |
C17H22N2O10S2
|
Neoglucobrassicin |
|
R19 |
9.24 |
160.07 ([M+H]+) |
158.95 ([M-H]−) |
159 |
C10H9NO |
Indole acetaldehyde |
|
R20 |
9.24 |
391.09, 362.07 |
447.05 ([M-H]−) |
448 |
C16H20N2O9S2
|
Glucobrassicin isomer 2 |
|
R21 |
11.30 |
937.26 ([M+H]+) |
935.24 ([M-H]−) |
936 |
C42H48O24
|
Kaempferol-coumaroyltriglucoside |
|
R22 |
11.30 |
176.02 ([M+H]+) |
174.95 ([M-H]−) |
175 |
C6H9NOS2
|
Raphanin |
|
R23 |
11.67 |
937.26 ([M+H]+) |
935.24 ([M-H]−) |
936 |
C42H48O24
|
Kaempferol-coumaroyltriglucoside isomer 1 |
|
R24 |
12.22 |
989.25 ([M+Na]+) |
965.25 ([M-H]−) |
966 |
C43H50O25
|
Kaempferol-feruloyltriglucoside |
|
R25 |
12.52 |
989.25 ([M+Na]+) |
965.25 ([M-H]−) |
966 |
C43H50O25
|
Kaempferol-feruloyltriglucoside isomer 1 |
|
R26 |
13.71 |
1207.36 ([M+Na]+) |
1,183.30 ([M-H]−) |
1,184 |
C55H60O29
|
Kaempferol-disinapoyltriglucoside |
|
R27 |
14.18 |
1001.25 ([M+Na]+) |
977.25 ([M-H]−) |
978 |
C44H50O25
|
Kaempferol-sinapoylsophoroside-glucoside |
|
R28 |
14.18 |
1005.29 ([M]+) |
- |
1,005 |
C45H49O26
|
Cyanidin-3-O-coumaroylsophoroside-5-O-malonylglucoside |
|
R29 |
14.18 |
1021.24 ([M]+) |
- |
1,021 |
C45H49O27
|
Cyanidin-3-O-caffeoylsophoroside-5-O-malonylglucoside |
|
R30 |
14.49 |
1001.25 ([M+Na]+) |
977.25 ([M-H]−) |
978 |
C44H50O25
|
Kaempferol-sinapoylsophoroside-glucoside |
|
R31 |
14.49 |
1005.29 ([M]+) |
- |
1,005 |
C45H49O26
|
Cyanidin-3-O-coumaroylsophoroside-5-O-malonylglucoside isomer 1 |
|
R32 |
14.49 |
1021.24 ([M]+) |
- |
1,021 |
C45H49O27
|
Cyanidin-3-O-caffeoylsophoroside-5-O-malonylglucoside isomer 1 |
|
R33 |
14.94 |
949.26 ([M]+) |
|
949 |
C43H49O24
|
Cyanidin 3-xylosylsinapoylglucoside-5-O-galactoside |
|
R34 |
14.94 |
1021.24 ([M]+) |
- |
1021 |
C45H49O27
|
Cyanidin-3-O-caffeoylsophoroside-5-O-malonylglucoside isomer 2 |
|
R35 |
14.94 |
1035.26 ([M]+) |
- |
1035 |
C46H51O27
|
Cyanidin-3-O-feruloylsophoroside-5-O-malonylglucoside |
|
R36 |
16.60 |
543.19 ([M+Na]+) |
565.20 ([M-H+FA]−),
519.20 ([M-H]−) |
520 |
C26H32O11
|
Matairesinoside |
|
R37 |
16.60 |
1197.31 ([M]+) |
- |
1197 |
C52H61O32
|
Cyanidin-3-O-feruloylsophoroside-5-O-malonyldiglucoside |
|
R38 |
17.32 |
1359.34 ([M]+) |
- |
1359 |
C61H67O35
|
Cyanidin-3-O-caffeoylsophoroside-5-O-malonyldiglucoside |
|
R39 |
17.72 |
1035.26 ([M]+) |
- |
1035 |
C46H51O27
|
Cyanidin-3-O-feruloylsophoroside-5-O-malonylglucoside isomer 1 |
|
R40 |
19.60 |
1343.35 ([M]+) |
- |
1343 |
C61H67O34
|
Cyanidin-3-O-coumaroylferuloylsophoroside-5-O-malonylsophoroside |
|
R41 |
19.60 |
1181.30 ([M]+) |
- |
1181 |
C55H57O29
|
Cyanidin-3-O-coumaroylferuloylsophoroside-5-O-malonylglucoside |
|
R42 |
19.80 |
1373.36 ([M]+) |
- |
1373 |
C62H69O35
|
Cyanidin-3-O-coumaroylsinapoylsophoroside 5-O-malonylsophoroside |
|
R43 |
20.43 |
1181.29 (M+H]+), |
- |
1181 |
C55H57O29
|
Cyanidin-3-O-coumaroylcaffeoylsophoroside-5-O-succinoylglucoside |
|
R44 |
20.58 |
1211.30 ([M]+) |
- |
1211 |
C56H59O30
|
Cyanidin-3-O-diferuloylglucoside-5-O-malonylglucoside |
|
R45 |
25.48 |
351.24 ([M+Na]+) |
327.21 ([M-H]−) |
328 |
C18H32O5
|
9,12,13-Trihydroxy-10,15-octadecadienoic acid |
|
R46 |
26.39 |
353.23 ([M+Na]+) |
329.23 ([M-H]−) |
330 |
C18H34O5
|
9,12,13-Trihydroxy-10-octadecenoic acid |
|
R47 |
31.26 |
699.37 ([M+Na]+) |
721.37 ([M-H+FA]−),
675.36 ([M-H]−) |
676 |
C33H56O14
|
Digalactosyldiacylglycerol (DGMG) 18:3 |
|
R48 |
36.72 |
353.26 ([M+H]+), 261.22 |
- |
352 |
C21H37O4
|
Monolinolenin |
Download Excel Table
Fig. 4.
Principal component analysis (PCA) score plot (A) and loading plot (B) of different radish cultivar roots (cv. Mubyeongjangsu, cv. Sweet baby, cv. Jeonwoonmu, and cv. Boraking).
R1-R48 are metabolite number presented in Table 3.
Download Original Figure
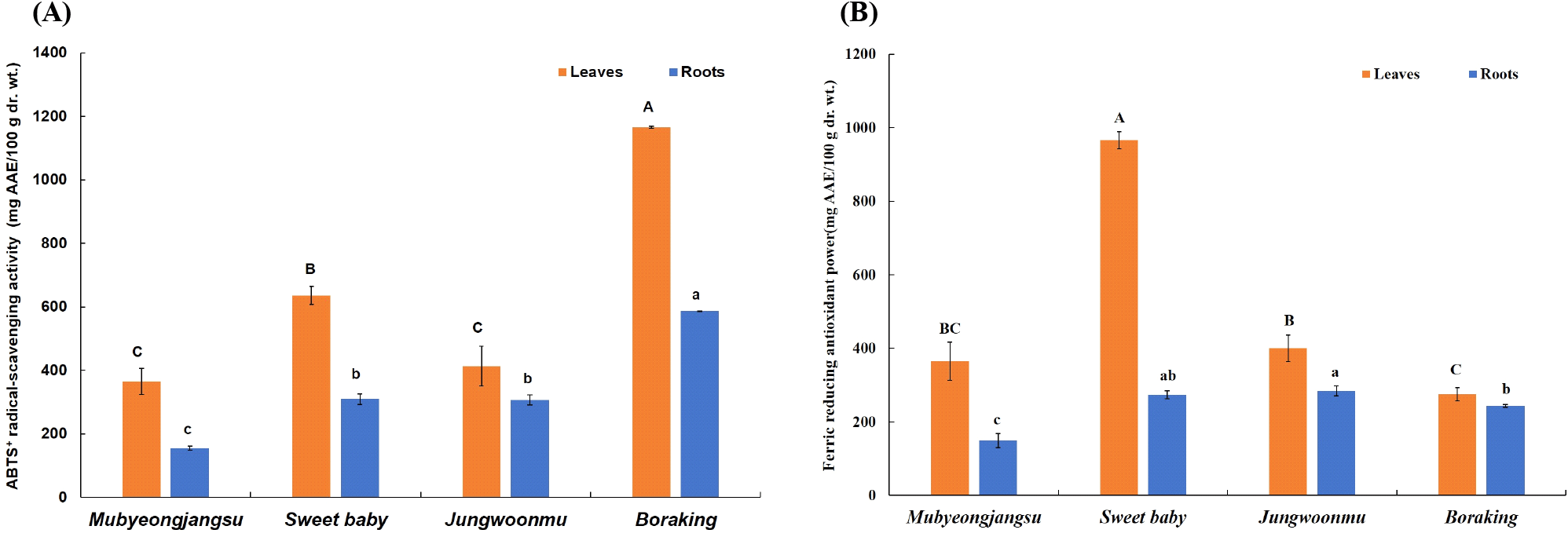
3.5. ABTS+ radical 소거 활성 및 철 환원력 평가
자색무 3종을 대상으로 ABTS+ radical 소거 및 철 환원력 평가를 통하여 무와 무청의 항산화 활성을 비교하였다. 무청은 자색무와 백색무 품종 모두에서 무보다 ABTS+ radical 소거 활성이 유의적으로 높았다(Fig. 5A). 무청의 경우 자색무 품종들이 대조군으로 사용한 백색무인 무병장수의 무청에 비해 높은 ABTS+ radical 소거 활성이었으며, 자색무 품종들 중 보라킹의 무청이 가장 높은 활성(1,186.4±0.7 mg AAE/100 g dr. wt.)이었다. 무의 경우 자색무 3품종의 ABTS+ radical 소거 활성(307.3-586.4 mg AAE/100 g dr. wt.)은 대조군인 백색무(155.7±6.6 mg AAE/100 g dr. wt.)보다 유의적으로 높았으며, 그 중 자색무 품종인 보라킹의 무가 무청에서와 같이 가장 높은 활성(586.4±0.7 mg AAE/100 g dr. wt.)을 나타냈다.
Fig. 5.
ABTS+ radical-scavenging activity (A) and ferric reducing antioxidant power (B) of different radish cultivar leaves and roots.
Different letters above the bars indicate significant differences (p<0.05). The bars and error bars represent mean±SD (n=3). Different capital letters on the bars represent significant differences between different cultivar leaves. Different small letters on the bars represent significant differences between different cultivar roots. AAE, Ascorbic acid equivalent.
Download Original Figure
또한, 무와 무청의 철환원력은 ABTS+ radical 소거 활성과 유사한 경향이었으나 자색무 품종들 간의 그 활성은 다소 차이가 있음이 관찰되었다(Fig. 5B). 즉, 무청의 철환원력은 무에 비해 높은 경향이었으며, 자색무 품종 중 스위트베이비가 유의적으로 가장 높은 활성을 나타냈다. 그러나, ABTS+ radical 소거 활성이 가장 높았던 보라킹 품종의 무청은 두 자색무 품종들과 백색무에 비해 유의적으로 가장 낮은 철환원력을 나타냈다. 무의 경우 자색무 3품종이 백색무에 비해 유의적으로 높은 철환원력이었으나 ABTS+ radical 소거 활성이 가장 높았던 보라킹 품종은 다른 두 자색무 품종에 비해 다소 낮거나 유사하였다.
무청은 DPPH, ABTS+ radical, 그리고 철환원력 등을 이용한 활성 검증에서 무에 비해 항산화 활성이 우수하였다고 보고된 바 있으며(Goyeneche 등, 2015), 이는 본 연구 결과와 유사하였다. 또한, 자색무의 경우 상기 유용 화합물들을 비롯하여 항산화 활성이 우수하다고 잘 알려진 anthocyanin류를 함유하고 있으며, 이 화합물은 무청에 비해 무에 다량 존재하고 있다(Kim 등, 2021). 본 연구에서도 자색무의 무청과 무가 백색무에 비해 ABTS+ radical 소거 활성과 철환원력이 더 높게 나타난 것으로 보아 페놀성 화합물, flavonoid류, 그리고 glucosinolate류를 포함한 항산화 화합물들이 다수 존재하거나 이 중 항산화 활성에 관여하는 화합물들의 높은 함량에 기인한 것으로 여겨진다. 특히 무의 경우 자색무 품종에 따라 항산화 활성이 다소 차이가 있으나 대조군인 백색무에 비해 높은 활성을 나타내 anthocyanin류도 그 활성에 크게 기여한 것으로 해석된다.
4. 요약
국내에서 재배되고 있는 자색무 3품종(스위트 베이비, 정운무, 그리고 보라킹)에 대상으로 LC-MS 대사체 분석을 통해 성분학적 특성을 파악하고 항산화 활성을 비교하였다. 자색무 무청은 무에 비하여 총페놀성 화합물, 총 flavonoid, 그리고 glucosinolate 함량이 상대적으로 높았으며, 이들 함량은 품종 및 부위에 따라 다소 차이를 나타냈다. 자색무 중 보라킹은 다른 2품종(스위트 베이비와 정운무)에 비해 무에서 높은 anthocyanin 함량이었다. LC-QToF-ESI-MS를 이용한 대사체 분석을 실시한 결과, 무청에는 coumaric acid 유도체들과 flavonoid glycoside류가, 그리고 무에서는 cyanidin glycoside류와 kaempferol glycoside류가 주요 화합들로 동정되었으며, 그 개별 대사체들의 함량은 자색무 품종에 따라 차이가 있는 것으로 관찰되었다. 자색무의 무청은 무에 비해 높은 ABTS+ radical 소거 활성 및 철환원력이었으나, 그 품종들에 따른 항산화 활성 및 그 활성 화합물 함량과 비례적 상관관계는 나타나지 않았다. 본 연구 결과들은 국내에서 소비되고 있는 자색무들의 성분 특성을 이해하는데 유용한 기초 자료로 활용이 기대된다. 또한, 대부분 버려지고 있는 자색무의 무청을 쌈채소나 나물과 같은 다양한 식품소재로 활용이 기대된다.
Acknowledgements
The authors wish to thank Rural Development Administrationfor providing samples for this research.
References
Ban EJ, Kim JH, Oh GY, Lee SY, Moon JH, Cho JY. Comparison of the antioxidative activities and bioactive compound contents of green tea, roasted green tea, and black. J Kor Tea Soc. 24:64-71 2018;


Biondi F, Balducci F, Capocasa F, Visciglio M, Mei E, Vagnoni M, Mezzetti B, Mazzoni L. Environmental conditions and agronomical factors influencing the levels of phytochemicals in brassica vegetables responsible for nutritional and sensorial properties. Appl Sci. 11:1927 2021;


Chae SH, Lee SJ, Moon JH, Cho JY, Lee SK, Kim PH, Lee YS. Chemical and antioxidant characteristics of safflower leaf tea. J Kor Tea Soc. 29:44-51 2023;


Chorol S. Antioxidant content in different parts of radish (
Raphanus sativus L.) from cold arid ladakh region of trans-himalaya (Jammu and Kashmir). Pharmacogn J. 11:1064-1070 2019;


Clarke DB. Glucosinolates, structures and analysis in food. Anal Methods. 2:310-325 2010;


Gamba M, Asllanaj E, Raguindin PF, Glisic M, Franco OH, Minder B, Bussler W, Metzger B, Kern H, Muka T. Nutritional and phytochemical characterization of radish (
Raphanus sativus L.): A systematic review. Trends Food Sci Technol. 113:205-218 2021;


Giusti MM, Wrolstad RE. Acylated anthocyanins from edible sources and their applications in food systems. Biochem Eng J. 14:217-225 2003;


Goyeneche R, Roura S, Ponce A, Vega-Gálvez A, Quispe-Fuentes I, Uribe E, Di Scala K. Chemical characterization and antioxidant capacity of red radish (
Raphanus sativus L.) leaves and roots. J Funct Foods. 16:256-264 2015;


Hanlon PR, Barnes DM. Phytochemical composition and biological activity of 8 varieties of radish (
Raphanus sativus L.) sprouts and mature taproots. J Food Sci. 76:C185-C192 2011;


Hwang EJ, Lee YG, Lee HJ, Cho JY, Moon JH. Major constituents and antioxidant activities of domestic onion (
Allium cepa L.) cultivars. Korean J Food Sci Technol. 53:434-445 2021;

Jing P, Zhao SJ, Ruan SY, Xie ZH, Dong Y, Yu LL. Anthocyanin and glucosinolate occurrences in the roots of chinese red radish (
Raphanus sativus L.), and their stability to heat and pH. Food Chem. 133:1569-1576 2012;


Kim BR, Park JH, Kim SH, Cho KJ, Chang MJ. Antihypertensive properties of dried radish leaves powder in spontaneously hypertensive rats. Korean J Nutr. 43:561-569 2010;


Koley TK, Khan Z, Oulkar D, Singh BK, Maurya A, Singh B, Banerjee K. High resolution LC-MS characterization of phenolic compounds and the evaluation of antioxidant properties of a tropical purple radish genotype. Arabian J Chem. 13:1355-1366 2020;


Kwak JY, Kim SH, Seong KH, Yoo MJ, Park KB, Lim Y, Park JT. Relationship between major components and physicochemical properties of radish (
Raphanus sativus L.) combinations for developing new cultivars targeting chinese market. Hortic Sci. 35:577-587 2017;


Lee SW, Nugroho ABD, Nugroho D, Kim DH. Correlation analysis of glucosinolate profiles and GSL biosynthetic genes in radishes (
Raphanus sativus L.). Hort Environ Biotechnol. 65:157-167 2024;


Lin LZ, Sun J, Chen P, Harnly JA. LC-PDA-ESI/MS n identification of new anthocyanins in purple bordeaux radish (
Raphanus sativus L. variety). J Agric Food Chem. 59:6616-6627 2011;



Liu H, Zhou K, Jiang H, Wen L, He Y, Lu S, Wang B, Li J. Current advances in anthocyanins: Structure, bioactivity and human health. J Food Nutr Res. 60:203-216 2021;

Mithen R. Glucosinolates–biochemistry, genetics and biological activity. Plant Growth Regul. 34:91-103 2001;


Mohammed EA, Abdalla IG, Alfawaz MA, Mohammed MA, Al Maiman SA, Osman MA, Yagoub AEA, Hassan AB. Effects of extraction solvents on the total phenolic content, total flavonoid content, and antioxidant activity in the aerial part of root vegetables. Agriculture. 12:1820 2022;


Muminović J, Merz A, Melchinger AE, Lübberstedt T. Genetic structure and diversity among radish varieties as inferred from AFLP and ISSR analyses. J Am Soc Hort Sci. 130:79-87 2005;


Noman OM, Nasr FA, Alqahtani AS, Al-Zharani M, Cordero MAW, Alotaibi AA, Bepari A, Alarifi S, Daoud A. Comparative study of antioxidant and anticancer activities and HPTLC quantification of rutin in white radish (
Raphanus sativus L.) leaves and root extracts grown in Saudi Arabia. Open Chem. 19:408-416 2021;


Noreen Z, Ashraf M. Changes in antioxidant enzymes and some key metabolites in some genetically diverse cultivars of radish (
Raphanus sativus L.). Environ Exp Bot. 67:395-402 2009;


Orak HH. Total antioxidant activities, phenolics, anthocyanins, polyphenoloxidase activities of selected red grape cultivars and their correlations. Sci Hortic. 111:235-241 2007;


Pang Q, Yu W, Sadeghnezhad E, Chen X, Hong P, Pervaiz T, Ren Y, Zhang Y, Dong T, Jia H, Fang J. Omic analysis of anthocyanin synthesis in wine grape leaves under low-temperature. Sci Hortic. 307:111483 2023;


Park CH, Park SY, Park YJ, Kim JK, Park SU. Metabolite profiling and comparative analysis of secondary metabolites in chinese cabbage, radish, and hybrid
Brassicoraphanus. J Agric Food Chem. 68:13711-13719 2020;



Selyutina G, Gapontseva O. Component composition of radish root essential oil. Ukr Food J. :653-666 2016;


Shehata AN, Mahmoud AE, Abdou HM. Quantification of total phenolic and total flavonoid contents in extracts of some Egyptian green leaves and estimation of antioxidant activity. Res J Pharm Biol Chem Sci. 5:266-273 2014;

Shin T, Ahn M, Kim GO, Park SU. Biological activity of various radish species. Orient Pharm Exp Med. 15:105-111 2015;


Song SH, Wi G, Moon JH, Cho JY. Changes in LC-MS-based untargeted non-volatile metabolites of infused black tea according to different storage temperature and period. J Kor Tea Soc. 30:58-71 2024;


Tong L, Cheng S, Lv H, Zhao C, Zhu J, Liu P, Wang Z, Yang L, Zhang Y. Analysis of glucosinolate content, composition and expression level of biosynthesis pathway genes in different chinese kale varieties. Horticulturae. 7:398 2021;


Wang Y, Pan Y, Liu Z, Zhu X, Zhai L, Xu L, Yu R, Gong Y, Liu L.
De novo transcriptome sequencing of radish (
Raphanus sativus L.) and analysis of major genes involved in glucosinolate metabolism. BMC Genomics. 14:836 2013;




Wu Y, Han T, Yang H, Lyu L, Li W, Wu W. Known and potential health benefits and mechanisms of blueberry anthocyanins: A review. Food Biosci. 55:103050 2023;


Yuan Y, Fan Q, Xu X, Wang O, Zhao L, Zhao L. Nanocarriers based on polysaccharides for improving the stability and bioavailability of anthocyanins: A review. Carbohydr Polym, Technol Appl. 6:100346 2023;


Zhang J, Qiu X, Tan Q, Xiao Q, Mei S. A comparative metabolomics study of flavonoids in radish with different skin and flesh colors (
Raphanus sativus L.). J Agric Food Chem. 68:14463-14470 2020;