1. 서론
땅콩(Arachis hypogaea)은 남미가 원산지인 콩과식물로 열대 및 아열대지역에서 널리 재배되고 있으며, 식품 공급원으로서 경제적으로 중요한 작물 중 하나이다(Hammons 등, 2016). 땅콩은 올레산, 리놀레산과 같은 불포화지방산 함량이 높고, 레스베라트롤, 페놀산, 플라보노이드와 같은 항산화 물질은 물론, 단백질, 비타민, 미네랄과 같은 생리활성 성분을 함유하고 있어 우수한 식품소재로 알려져 있다(Arya 등, 2016; Lim 등, 2017). 땅콩은 높은 유지 함량으로 인해 주로 유지원료 작물로 재배되나, 생땅콩, 구운땅콩, 땅콩가루, 땅콩버터 등 식품용이나 간식용, 가공제품 원료로도 이용되고 있다(Park과 Park, 2002).
땅콩의 생산단계 전반에 걸쳐 안전성 및 품질에 가장 큰 영향을 미치는 것은 Aspergillus 속 곰팡이에 의해 생성되는 aflatoxin 독소이다. Aflatoxin은 A. flavus와 A. parasiticus와 같은 곰팡이에서 생성되는 2차 대사산물로, 발암, 돌연변이, 기형유발, 면역력 억제 등 인간과 동물에 대한 위해성으로 인해 Group 1 발암물질로 분류, 규제하고 있는 독성물질이다(Groopman 등, 2008; Wu, 2014). Aflatoxin은 곡류, 두류, 견과류에서뿐만 아니라 향신료, 생약제 등의 다양한 농산물과 그 가공품에서 광범위하게 발견된다(Bankole 등, 2006; Cho 등, 2008; Klich, 2007; Romagnoli 등, 2007). 특히, 땅콩 및 그 가공식품은 aflatoxin 오염이 가장 빈번하게 보고되는 식품 중 하나로(Meneely 등, 2022), 국내에서도 국산 땅콩과 땅콩버터에서 14%(4/28건), 17% (2/17건)에서 aflatoxin B1 오염이 보고된(Park, 2006) 이후, 시판 견과류 157점 중 0.35%(Suh 등, 2007), 땅콩과 땅콩버터 각각 31점 중 3.2%와 16점 중 87.5%(Choi 등, 2011), 109점 중 28.4%(Hong과 Park, 2019), 106건 중 13%(Sung 등, 2021) 등 땅콩과 그 가공품에서 aflatoxin 검출 사례가 지속적으로 보고되고 있다.
국내에서 땅콩은 재배규모가 확대되고 있으며, 다양한 기능성 품종들이 육종, 재배되고 있다(RDA, 2021). 주로 볶음땅콩 형태로 가공되어 간식용으로 많이 소비되고, 제과, 제빵용, 건강식용으로도 이용되고 있다. 하지만 국내에서 유통 중인 땅콩과 그 가공품에 대한 독소 오염실태 조사는 수행되고 있으나, 땅콩의 저장 중 독성 곰팡이 및 곰팡이독소 관련 연구는 전무한 실정이다. Aflatoxin은 독성 곰팡이 발생이 용이한 조건에서 장기간 저장된 땅콩에서 생성될 가능성이 높으며, 이를 원료로 가공품을 생산하면 가공품도 aflatoxin에 오염될 수 있다. 이에 본 연구에서는 땅콩의 저장 중 독성 곰팡이 및 곰팡이독소 오염 실태 조사를 통해 현장의 저장 조건에서 땅콩의 독소 발생을 조사하고, 독성 곰팡이 및 곰팡이독소 오염을 최소화할 수 있는 저장 조건을 탐색하고자 하였다.
2. 재료 및 방법
2020년 10월 고창과 부안 지역에서 수확한 땅콩을 겉껍질을 제거하지 않은 피땅콩과, 겉껍질을 제거한 알땅콩으로 구분하여 구입하였다. 땅콩 시료는 각각 20 kg 폴리프로필렌 백에 담아 2020년 10월부터 2021년 10월까지 1년 동안 저장 실험을 수행하였다(Fig. 1(A)). 저장 조건은 땅콩을 수매하여 저장, 가공, 판매를 진행하는 현장의 저장 조건을 참조하여 냉장(4°C, 상대습도 75%), 저온(8°C, 상대습도 50%), 항온항습(13°C, 상대습도 75%), 상온(21°C, 상대습도 50%) 으로 설정하였다. 저장 기간 동안 온도와 상대습도는 온도/습도 로거(HOBO Pro v2, U23-002A, ONSET, Bourne, MA, USA)를 이용하여 1시간 단위로 기록하였다. 저장 기간은 피땅콩 12개월과 알땅콩 6개월이었으며, 2개월마다 각각 1 kg의 시료를 채집하여 독성 곰팡이 및 곰팡이독소 발생 현황을 분석하였다.

수집된 피땅콩은 겉껍질 제거 후 분석에 이용하였으며, 알땅콩은 속껍질 제거 없이 바로 사용하였다. 땅콩은 반으로 쪼개어 50 mL 폴리프로필렌 tube에 나누어 담고, 1% 차아염소산 나트륨 용액에 3분간 침지 소독 후, 살균수로 2회 세척하고 여과지에 올려 여분의 물기를 제거하였다. 표면 소독된 땅콩은 streptomycin(600 μg/mL, Biosesang, Seongnam, Korea)이 첨가된 potato dextrose agar (PDA, BD, Detroit, MI, USA) 배지와 dichloran-glycerol (DG18, BD, Detroit, MI, USA) agar 배지에 각각 50알을 치상하였다. 땅콩이 치상된 PDA 배지는 25°C에서 5일 동안 배양 후 총곰팡이 오염도를 조사하였고(Fig. 1(B) and (C)), DG18 배지는 25°C에서 7일 동안 배양 후 Aspergillus 속 및 Penicillium 속 곰팡이 오염도를 조사하였다. 곰팡이 균총들은 Samson 등(2019)과 Leslie와 Summerell(2008)이 기술한 방법을 따라 실체현미경(Leica M205 C, Leica Microsystems, Wetzlar, Germany)을 이용하여 형태학적 동정 및 오염도 조사를 수행하였다. 형태학적으로 동정된 곰팡이는 단일 균총에서 균사 및 포자를 일회용 loop 또는 needle을 이용하여 carnation leaf agar(Fusarium) 및 water agar(Aspergillus와 Penicillium) 배지에 계대하였다. 이후 현미경하에서 발아된 단포자를 선발하여 PDA 배지에 옮겨 25°C에서 5일간 배양하였다. 분리된 균주는 형태학적 특성 확인 후 균 동정 및 장기 보관(-80°C)하였다.
분리된 곰팡이들은 분류군에 따라 적합한 분자생물학적 마커 유전자를 적용하여 동정하였다. Aspergillus 및 Penicillium 속 곰팡이는 internal transcribed spacer region(ITS), beta-tubulin(BT), calmodulin(CaM) 유전자를, Fusarium 속 곰팡이는 translation elongation factor 1 α(TEF-1α) 유전자를, 그 외 다른 속 곰팡이는 ITS 유전자를 이용하여 동정하였다(Glass와 Donaldson, 1995; Hong 등, 2006; O’Donnell 등, 1998; White 등, 1990). Aspergillus flavus/ oryzae/ parasiticus 균주는 정확한 동정을 위해 aflatoxin 생합성 유전자(norB-cypA)를 추가 분석하였다(Ehrlich 등, 2004). 분리된 균주는 PDA 배지에서 균사를 취해 Chi 등(2009)의 방법에 따라 DNA를 추출하였다. 각 마커 유전자는 특이 primer set과 TaKaRa Ex-Taq(TaKaRa Biomedical Inc., Shiga, Japan)으로 용법에 따라 PCR을 수행하였고, 증폭산물 정제 후 DNA 서열을 결정하였다. 염기서열들은 NCBI GenBank BLAST와 Fusarium MLST database(http://fusarium.mycobank.org)를 이용하여 염기서열 간 유사도를 평가하였다. 또한, 염기서열들은 BioEdit software(version 7.2.5)를 이용하여 서열을 정렬하고, MEGA X software(version 10.0.5)로 계통수를 작성하였다. 각 분리균주들은 염기서열 유사도 및 계통수 근연관계 분석을 통해 동정하였다.
땅콩 시료의 aflatoxin과 ochratoxin A 분석은 Lee 등(2021)의 방법을 따라 면역친화성 컬럼 VICAM AflaTest와 OchraTest(VICAM, Milford, MA, USA)를 이용하여 정제하고, ultra-performance liquid chromatography (UPLC, Waters Acquity UPLC H Class, Waters Corp., Milford, MA, USA)를 동일조건으로 설정하여 정량분석하였다. 시료 3 g에 1 g NaCl과 15 mL 추출용액(MeOH: 0.5% NaHCO3 =7:3, v/v)을 가하여 300 rpm에서 1시간 동안 교반하여 aflatoxin과 ochratoxin A를 동시 추출하였다. 각 7 mL의 추출액은 28 mL phosphate buffered saline(PBS, 1% tween 20 함유) 용액과 혼합하여 면역친화칼럼에 전량 주입하였다. 각 컬럼은 3 mL PBS(10 mM)와 5 mL 증류수로 순차적으로 정제, 세척하고, 2 mL MeOH로 독소를 용출 후 질소 건조하였다. Aflatoxin 분석은 건조된 용출물을 0.2 mL trifluoroacetic acid에 반응 후 0.8 mL acetonitrile(ACN)을 가하고 0.2 μm 실린지 필터로 여과하였고, ochratoxin A 분석은 용출액을 질소건조 후 1 mL 50% ACN(0.5% acetic acid 함유)에 재용출하고 필터 여과하여 분석에 사용하였다. UPLC 분석 조건은 Lee 등(2021)이 기술한 조건과 동일하게 설정하였다.
저장 중 땅콩에서 분리된 독성 곰팡이의 독소 생성능 검정을 위해 aflatoxin, ochratoxin A, patulin, fumonisin을 생성하는 것으로 보고된 A. flavus, A. parasiticus, A. niger, A. ochraceus, A. tubingensis, A. welwitschiae, A. westerdijkiae, P. crustosum, P. expansum, P. polonicum 균주를 시료별, 시기별로 무작위 선발하였다. 선발된 134점의 균주는 PDA 배지에 접종하여 25°C에서 7일간 배양 후, 균사가 포함된 배지를 취하여 독소 분석을 수행하였다.
분리 균주에 의해 생성된 aflatoxin과 ochratoxin A는 땅콩 시료 분석과 동일한 방법으로 추출하여 정량분석하였고, patulin과 fumonisin 독소 분석은 QuEChERS법(Lehotay 등, 2005)을 변형하여 추출하였다. Patulin과 fumonisin은 3 g 시료에 3 mL 증류수와 5 mL ACN (0.1% formic acid 함유)을 가하여 300 rpm에서 1시간 교반하고 0.5 g NaCl과 2 g MgSO4 를 첨가하여 혼합 후 3,600 rpm에서 10분 원심분리하여 동시 추출하였다. 추출된 상등액 2 mL는 0.2 μm 실린지 필터로 여과하여 분석에 사용하였다.
Fumonisin 분석은 Choi 등(2018)에 기술된 liquid chromatography-mass spectrometry(LC-MS)의 분석 조건과 동일하게 설정하여 수행하였다. Patulin은 UPLC, C18 컬럼(ACQUITY UPLC BEH C18, 2.1 mm×100 mm, 1.7 μm, Waters Corp., Milford, MA, USA)을 사용하여 시료 주입량 10 μL, 유속 0.3 mL/min, 90% MeOH 등용매 조건으로 10분 동안 분석하였다. 컬럼 온도는 40°C, PDA 검출기 파장은 276 nm로 설정하였다. 각 독소의 회수율, 검출 및 정량한계는 Table 1에 나타내었다.
1) AFB1, B2, G1 and G2, aflatoxin B1, B2, G1 and G2; OTA, ochratoxin A; PAT, patulin; FB1 and FB2, fumonisin B1 and B2.
3. 결과 및 고찰
각 저장고별 오염도는 항온항습(13°C/RH 75%), 냉장(4°C/RH 75%), 상온(21°C/RH 50%), 저온(8°C/RH 50%) 저장고 순으로 높았다(Fig. 2(A)). 이는 상대습도가 높을수록, 온도가 높을수록 곰팡이 발생이 많았음을 나타낸다. 피땅콩은 저장 기간 동안 곰팡이 오염도가 지수적으로 증가하여 저장 12개월 후 최대 79.1±20.3%의 오염도를 나타내었다. Aspergillus 속 곰팡이는 서서히 증가하다가 저장 12개월 후 오염도가 급격히 증가하여 가장 우점하였다(Fig. 2(B)). Penicillium 속 곰팡이도 저장 기간이 길어짐에 따라 다소 증가하는 경향을 나타내었고, 평균 오염도는 7.6±7.2%였다(Fig. 2(C)). 그러나 Fusarium 속 곰팡이는 저장 기간에 따른 변화가 거의 없었으며, 평균 3.2±2.1% 의 오염도를 나타내었다(Fig. 2(D)). Aflatoxin을 생성하는 A. flavus는 피땅콩 저장 시료 125점 중 22점(17.6%)의 시료에서 0.5±0.8%(2-12% 범위)의 오염도를, ochratoxin A를 생성하는 것으로 알려진 A. niger, A. welwitschiae, A. westerdijkiae는 21점(16.8%)의 시료에서 0.3±0.8% (2-4% 범위)의 오염도를 나타내었다. 두 독성 곰팡이 그룹 모두 저장 기간에 상관없이 검출되었다(data not shown).
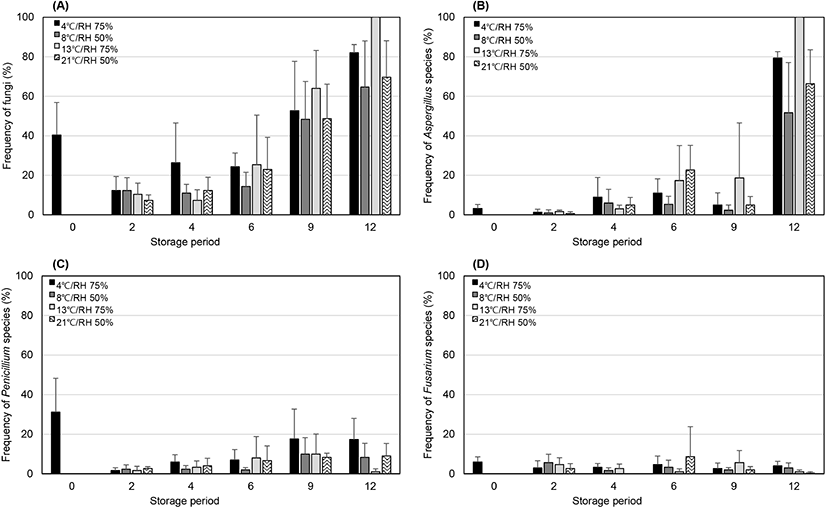
알땅콩의 경우, 저장 2개월 후 모든 저장 조건에서 곰팡이 오염도가 급격히 증가하여 약 100%(99.5±0.9%)에 이르렀으며, Penicillium 속 곰팡이가 가장 우점하였다(Fig. 3(A) and (C)). 반면, Aspergillus 속과 Fusarium 속 곰팡이의 평균 오염도는 각각 8.2±13.8%와 4.3±6.7%로 나타났다(Fig. 3(B) and (D)). A. flavus는 시료 47점 중 14점(29.8%)의 시료에서 2.6±6.2%(1-28% 범위)의 오염도를, A. niger, A. welwitschiae, A. westerdijkiae는 12점(25.5%)의 시료에서 0.4±1.1%(2-8% 범위)의 오염도를 나타내었다. 피땅콩과 같이, 두 독성 곰팡이 모두 저장 기간에 상관없이 검출되었다.
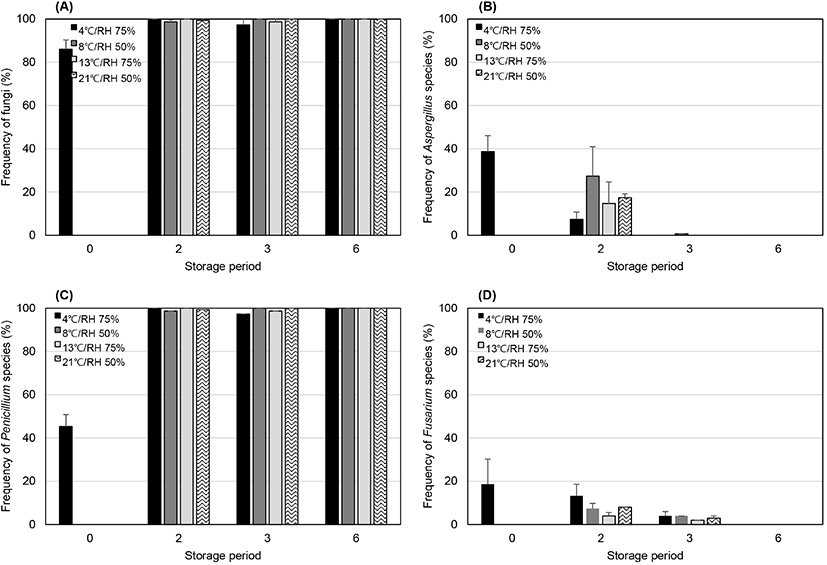
피땅콩과 알땅콩 모두 저장 동안 Aspergillus 속과 Penicillium 속 곰팡이가 주로 우점하였고, 저장 기간이 길어질수록 오염도도 증가하였다. 그러나, 피땅콩에서는 Aspergillus 속이 우점하였고, 알땅콩에서는 Penicillium 속 곰팡이가 주요 우점종으로 나타났다. 저장 초기에 총곰팡이, Aspergillus 속, Fusarium 속 곰팡이 오염도 모두 피땅콩에 비해 알땅콩에서 2배 이상 높게 나타났고, Penicillium 속 곰팡이도 알땅콩에서 평균 오염도가 13%가량 높게 나타났다. 이는 중국(Ding 등, 2015), 브라질(Nakai 등, 2008), 미얀마(Chein 등, 2019) 등의 땅콩에서 Aspergillus 속과 Penicillium 속 곰팡이가 주요 우점종으로 발생한 결과와 일치한다. 또한, Ding 등(2015)은 저장 기간이 증가할수록 Aspergillus 속과 Penicillium 속 곰팡이가 증가하며, Xing 등(2016)은 피땅콩에 비해 알땅콩에서 Aspergillus 속과 Penicillium 속 곰팡이의 오염도가 더 높게 나타났다고 보고하였다. 이는 피땅콩은 겉껍질 로 둘러싸여 있어 땅콩 알 자체의 오염이 방지되는 효과가 있는 반면, 알땅콩은 껍질이 제거된 상태로 오염에 직접적으로 노출되기 때문인 것으로 추정된다.
저장 중 땅콩의 aflatoxin과 ochratoxin A 분석결과, 알땅콩 시료 1점(상온 저장, 저장 6개월 차)에서만 ochratoxin A가 37.31 μg/kg 농도로 검출되었고, aflatoxin은 모든 시료에서 검출되지 않았다. A. flavus의 aflatoxin 생성 최적 온도는 30°C(25-35°C), 상대습도 85%(83-95%)로 알려져 있는데(Abdel-Hadi 등, 2012; Ogundero, 1987), 본 연구의 저장 실험조건은 이를 충족하지 못했기 때문인 것으로 보인다. 본 연구에서 저장 기간 동안 각 저장고의 평균 온도 및 평균 상대습도는 4.6±1.2°C/73.5±5.4%(냉장 저장고), 8.8±3.7°C/48.4±3.7%(저온 저장고), 13.6±0.1°C/76.0±3.1%(항온항습 저장고), 21.9±5.9°C/45.6±12.2% (상온 저장고)이었다. Torres 등(2014)은 25-27°C, 상대습도 70%에 저장 시 1년 이상 독성 곰팡이의 성장을 방지할 수 있을 것으로 보고하였다. 국내의 경우, 땅콩의 장기 저장은 4°C, 상대습도 40% 이하가 적합하지만, 10-15°C의 저온 저장고에서 저장하는 경우, 상대 습도를 56-69%로 유지하는 것을 권장하고 있다(Li 등, 2008; RDA, 2021).
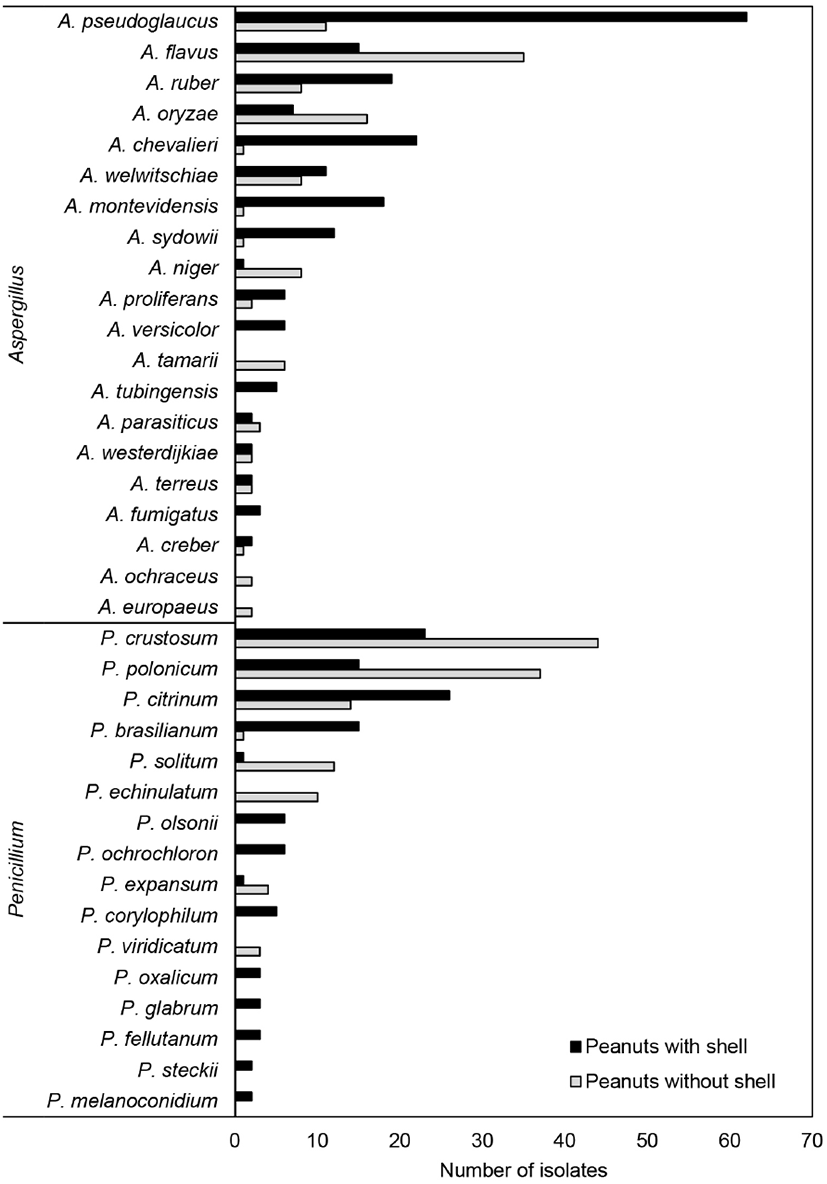
저장 땅콩에서 분리된 총 889점의 곰팡이는 Aspergillus (34.9%), Penicillium(27.7%), Fusarium(22.8%) 3속이 우점하였고(Fig. 4), 그 외에 Talaromyces(8.1%) , Chaetomium (1.3%) , Emmia(1.0%) , Clonostachys(0.7%) , Arthrinium, Epicoccum, Humicola, Mucor, Neurospora, Trametes 속 등 30개 속(genus)에 속하는 곰팡이들이 분리되었다. Aspergillus 속 곰팡이는 A. pseudoglaucus, A. flavus, A. ruber, A. chevalieri, A. oryzae, A. montevidensis, A. welwitschiae 등 26종이 동정되었고, Penicillium 속 곰팡이는 P. crustosum, P. polonicum, P. citrinum, P. brasilianum, P. solitum 등 26종이 동정되었다. Fusarium 속 곰팡이는 F. oxysporum, F. solani, F. equiseti 등 10종이 동정되었다. Aspergillus 속의 경우, 피땅콩에서는 A. pseudoglaucus, A. ruber, A. chevalieri, A. montevidensis 등 section Aspergillus에 속하는 종들이 많이 분리된 반면, 알땅콩에서는 A. flavus/A. oryzae, A. niger/A. welwitschiae 등 section Flavi와 Nigri에 속하는 종들이 주로 분리되었다. Penicillium 속의 경우 피땅콩에서는 P. citrinum, P. brasilianum이, 알땅콩에서는 P. crustosum, P. polonicum, P. solitum, P. echinulatum 등 section Fasciculata에 속하는 종들이 분리되었다. 이는 저장 중 알땅콩에서 Aspergillus와 Penicillium 속 곰팡이 A. flavus, A. niger, A. terreus, P. citrinum을 주로 분리한 Chein 등(2019)의 결과와 유사하다. 그러나 pyrosequencing을 이용한 땅콩의 mycobiome 분석 결과와는 차이가 있었다. 중국의 저장 땅콩에서는 Rhizopus, Emericella, Clonostachys, Aspergillus 속 곰팡이가 주로 우점하며, Aspergillus 속 곰팡이는 A. flavus(0.12-10.33%)와 A. penicillioides(0.26-31.59%)가, Penicillium 속에서는 P. georgiense가 우점하였다(Ding 등, 2015). Xing 등(2016)의 결과에서는 피땅콩(in-shell peanuts)은 Rhizopus, Eurotium, Wallemia 속이, 알땅콩(peanut kernels)은 Rhizopus, Eurotium 속 곰팡이가 우점하였다. Aspergillus 속 곰팡이의 경우, 피땅콩(12.1%)에서는 A. aculeatus, A. candidus, A. flavipes, A. flavus, A. gracilis, A. niger, A. ochraceus, A. penicillioides 등이, 알땅콩(10.1%)에서는 A. aculeatus, A. ellipticus, A. flavipes, A. flavus, A. glaucus, A. niger 등이 우점한다고 보고하였다.
땅콩에서 분리된 Aspergillus, Penicillium, Fusarium 속 곰팡이 중 독소 생성 종 균주 총 184점을 선발하여 독소 생성능을 검정하였다(Table 2). A. flavus 균주는 41점 모두 aflatoxin B1을 생성하였으며, 그중 22점은 aflatoxin B2, 10점은 aflatoxin G1, 2점은 aflatoxin G2를 함께 생성하였고, 1점은 aflatoxin B1, B2, G1, G2를 모두 생성하였다. 총aflatoxin 생성량은 평균 326.738±441.944 μg/kg이었다. A. parasiticus 균주는 4점 모두 aflatoxin B1과 G1을 생성하였으며, 총aflatoxin 생성량은 평균 691.994± 265.381 μg/kg으로 A. flavus 균주보다 높았다. A. westerdijkiae 균주 4점은 모두 ochratoxin A를 생성하였으며, 평균 생성량은 99.649±79.907 μg/kg이었다. A. niger 균주 1점 , A. tubingensis 균주 1점, A. welwitschiae 균주 4점은 모두 fumonisin B2를 생성하였고, A. welwitschiae의 fumonisin B2 평균 생성량은 3.89± 3.723 mg/kg이었다. 그러나 이들은 모두 PDA 배지에서 ochratoxin A를 생성하지 않았다. P. expansum 균주 4점은 평균 387.261±383.215 mg/kg의 patulin을 생성하였다. 이 외 A. ochraceus(n=1), P. crustosum(n=19), P. polonicum(n=20) 균주들에서는 곰팡이독소가 검출되 지 않았다. Wei와 Jong(1986)은 A. flavus 그룹의 ATCC (American Type Culture Collection) 표준 균주를 대상으로 aflatoxin 생성능을 분석하였다. 73점의 A. flavus 중 41%가 aflatoxin을 생성하였고, 그중 85%는 aflatoxin B1, 76%는 aflatoxin B2, 26%는 aflatoxin G1과 G2를 생성하며, aflatoxin B1 기준 0.1-1,212.5 μg/kg 농도로 생성하였음을 보고하였다. 또한, A. parasiticus(26점)의 85%는 0.1-6,410 μg/kg 농도의 aflatoxin G1을 생성하였다. 브라질 땅콩에서 분리된 A. parasiticus 균주는 17점 모두 aflatoxin B와 G를 생성한 반면, A. flavus는 515점 중 50%의 균주만 aflatoxin B를 생성하였다(Martins 등, 2017). 그 외에 옥수수에서 분리된 A. niger의 72%, A. welwitschiae의 36.6%는 fumonisin B2를 생성하였다(Frisvad 등, 2007; Susca 등, 2014). Frisvad 등(2011)은 A. niger 228균주의 독소 생성능을 평가한 결과, 81%의 균주가 fumonisin B2, B4, B6를 생성하였고, 17%는 ochratoxin A, 10%는 fumonisin과 ochratoxin A를 동시에 생성할 수 있음을 확인하였다. 국내 땅콩에서 분리된 A. flavus는 모두 aflatoxin을 생성한 반면, 국외에서 분리된 균주는 50%가량만이 aflatoxin을 생성하였다. A. parasiticus 균주는 국내외 연구결과들과 유사한 양상을 나타냈다. A. tubingensis는 fumonisin을 생성하지 않는 것으로 알려져 있으나(Frisvad 등, 2011; Onami 등, 2018), 국내 저장 땅콩에서 분리된 균주 1점이 식품 규제 수준(옥수수 및 수수 기준, 4,000 μg/kg) 이상의 fumonisin을 생성하는 것으로 확인되었다.
본 연구 결과, 피땅콩과 알땅콩 저장 중 독소를 생성하는 독성 곰팡이의 오염도는 평균 5% 미만(1-28% 범위)이었으며, 곰팡이독소는 알땅콩 시료 1점을 제외한 모든 시료에서 불검출되었다. 또한, 땅콩을 피땅콩 상태로 온도 8°C, 상대습도 50%, 저장기간이 짧을수록 곰팡이 오염이 낮았다. 이는 같은 조건에서 곰팡이독소 오염도 방지할 수 있음을 나타낸다. 한편, aflatoxin과 ochratoxin A를 비롯하여 patulin과 fumonisin을 생성할 수 있는 다양한 곰팡이 종들이 분리된 바, 저장 땅콩에서의 patulin과 fumonisin에 대한 독소 오염현황에 대한 추가 모니터링이 필요할 것으로 사료된다.










