1. 서론
식초는 발효식품 중의 하나로 신맛을 주는 대표적인 조미식품이며, 발효 기질에 따라 초산발효로 생성된 다양한 유기산과 아미노산을 함유하여 항균, 항산화, 항당뇨, 항비만 효과와 심혈관 질환을 예방할 수 있는 기능성을 가지고 있다(Budak 등, 2014).
발효식초는 발효 중 초산균의 우점에 따라 초산 농도가 다르게 나타난다. 또한, 균주의 초산 생성 능력과 발효 방법에 따라 다르며, 발효 방법보다는 초산균의 특성에 따라 큰 영향을 받는다 (Park 등, 2002). 초산균은 에탄올 및 초산 농도에 대한 내성을 나타내는 그람 음성의 호기성 미생물이다. Acetobacter 및 Gluconacetobacter 속의 초산균은 alcohol dehydrogenase 및 aldehyde dehydrogenase 효소를 통해 에탄올을 초산으로 변환할 수 있으며, 식초의 산업적 생산에 사용된다(Andrés-Barrao 등, 2012).
종균첨가제(starter culture)는 미생물이 가지고 있는 대사 능력을 이용하여 발효식품의 빠른 제조를 위해 종균을 배양하고 증식시킨 첨가용 균체이다. 발효 식품에 종균첨가제를 적용할 경우, 발효식품의 안정성 및 품질 균일화 등이 가능하다(Jeong과 Lee, 2014). 최근 국산 종균의 발굴과 약주 제조용 종균 첨가제(Chae 등, 2021), 된장 제조를 위한 종균첨가제의 개발 연구가 보고되어 있다(Lee 등, 2019). 그러나 식초 제조를 위한 종균첨가제에 대한 연구는 미흡한 상황이다. 대부분의 농가에서 제조되는 식초는 종균을 사용하지 않고 자연 발효를 통해 식초를 제조한다. 자연발효는 발효기간의 장기화로 인해 품질 안정성과 표준화가 유지되기 어렵고, 저장 중 갈변이나 침전물 생성 등 품질 저하가 발생된다. 또한, 발효 종료액인 종초를 남겨 이를 다시 다음 발효 시에 사용하고 있다(Park 등, 1994). 반복 사용된 종초에는 초산균뿐만 아니라, 각종 불필요한 세균도 증식을 하게 된다. 이에 품질 향상을 위한 식초 발효 종균의 확보와 보급이 필요한 상황이다(Baek 등, 2015).
발효식초용 종균의 산업적 사용을 위하여 종균첨가제를 제조하기 위해서는 높은 균체량 생산 수율은 가장 중요한 요소 중 하나이다. 미생물에 따라 생육 특성이 각각 다르기 때문에 균체량은 배지의 성분과 배양 조건에 따라 큰 영향을 받는다. 따라서 미생물의 배지 및 배양 조건의 최적화가 선행되어야 한다(Ha 등, 2018). 최근 최적 조건을 탐색하기 위해 통계적 시험법인 반응표면분석법(response surface methodology)이 사용되고 있다. 반응표면분석법을 통해 여러 인자들의 상호작용에 따른 변수 패턴과 최적 조건까지 예측할 수 있는 장점이 있다(Yang 등, 2016).
따라서 본 연구에서는 식품 원료로 이용이 허가된 Acetobacter pasteurianus 중, 알코올 저항성과 초산 생성능이 우수한 SRCM101388을 발효식초 제조를 위한 종균첨가제로 산업화하기 위해 통계학적 분석 방법인 반응표면분석법을 사용하여 균체량 증가를 위한 배양 조건 최적화 연구를 수행하였다.
2. 재료 및 방법
본 실험에는 재단법인 발효미생물산업진흥원에서 자원화한 Acetobacter pasteurianus SRCM101388을 사용하였다. 균주 보관은 균 배양액을 20% glycerol과 5% skim milk(Sigma-Aldrich Co., St. Louis, MO, USA)가 포함된 용액에 현탁하여 stock으로 제조하여 −80°C에 보관하였다. 균주 활성화는 stock을 녹여 1 μL를 GY(glucose 5%, yeast extract 1%) agar에 도말하고 얻어진 단일 집락을 50 mL GY broth를 포함한 250 mL flask에 접종한 후 shaking incubator(VS-8480SF, Vision Scientific Co. Ltd., Daejeon, Korea)에서 30°C에서 24시간 배양하였다. 활성화된 배양액을 50 mL GY 배지를 포함한 250 mL flask에 1%를 접종하여 30°C에서 24시간 배양하였고, 이를 전배양액으로 하였다.
배양시간에 따른 초산균의 성장을 조사하기 위해 50 mL GY 배지를 포함한 250 mL flask에 전배양액 1%를 접종한 후 33시간 동안 30°C, 150 rpm에서 배양하고, 3시간 간격으로 배양액을 회수하여 생균수(CFU/mL)와 흡광도(600 nm)를 측정하였다. 배양 최적온도는 GY broth에 전배양액 1%를 접종한 후 배양온도 23°C, 25°C, 28°C, 30°C, 32°C, 35°C, 37°C, 40°C로 조정된 shaking incubator에서 GY broth에 전배양액 1%를 접종하여 21시간 배양한 후에 생균수를 측정하여 비교하였다. 최적 초기 pH는 0.1N HCl과 0.1M NaOH(Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 pH 4.0, 4.5, 5.0, 5.5, 6.0, 6.5, 7.0으로 조정한 GY broth에 전배양액 1%를 접종한 후 28°C shaking incubator에서 21시간 배양 후 생균수를 측정하여 비교하였다.
최적조건의 배지를 설정하기 위해 19개의 배지성분 중 균체량 증가에 효과가 있는 성분을 Plackett-Burman design(PBD)을 이용하여 선별하였다(Zeng 등, 2011). 19가지의 배지성분을 이용한 23개의 실험들(run)의 실험설계 및 실험군의 생균수(R1)는 Table 1에 나타내었으며 factor로 사용된 glucose, mannitol, glycerol, sucrose, fructose, soy peptone, yeast extract, malt extract, corn steep powder, ammonium sulfate, ammonium phosphate, sodium phosphate monobasic, potassium phosphate dibasic, sodium citrate, sodium acetate, magnesium sulfate, calcium chloride, aspartic acid, glutamic acid는 Sigma Aldrich Co., St. Louis, MO, USA의 제품을 사용하였다. 각각의 독립변수의 성분들을 중심값(0), 저농도(−1), 고농도(+1)로 나타내었으며 탄소원과 질소원의 중심값 설정은 Sari 등(2021)과 Dayal 등(2013)을 참고하여 탄소원 2.75 g/L, 질소원 2.75 g/L로 설정하였다. 기타 미량원소는 Yin 등(2017), Menzel과 Gottschalk(1985)를 참고하여 0.275, 0,0275로 설정하였다.
PBD 통계분석 결과에 따라 Acetobacter pasteurianus SRCM101388의 생균수에 가장 큰 영향을 미치는 성분 3종을 선별하였다. 선별된 성분의 농도 최적화를 위해 중심합성계획법(central composite design, CCD)을 통한 실험설계를 진행하였다. 중심점 3개를 포함한 17개의 실험구에 대한 각각의 독립변수를 5개의 수준(−3, −1, 0, +1, +3)으로 설정하였다(Table 2). Acetobacter pasteurianus SRCM101388의 균체량 증가를 위한 3개의 독립변수와 종속변수에 대하여 회귀분석을 위한 방정식은 다음과 같다.
Y는 종속변수, Xi는 독립변수를, β0는 상수계수, βi, βii, βij는 독립변수들의 상호작용의 계수를 나타낸다(Yang 등, 2016). Design expert 11(Version 11.1.2.0, Stat-Ease inc, Minneapolis, USA)을 이용하여 모델식을 예측하였고, 회귀분석 결과를 바탕으로 균체량 증가를 위한 성분 3종의 최적농도를 결정하였으며, 분산분석을 통해 통계적 유의성을 확인하였다.
기타 미량원소는 탄소원과 질소원에 비해 생균수에 큰 영향을 미치진 않지만, 산업적 규모의 대량 배양의 경우 배양시간 감소와 배양 안정성을 위해 필수적이다(Sunda 등, 2005). PBD 결과 ammonium sulfate, sodium phosphate, magnesium sulfate는 생균수를 증가시키는 경향을 보였으며, 이들을 각각의 독립변수로 하여 CCD를 통한 최적농도의 배지에 추가로 첨가하여 조사하였다. Magnesium sulfate는 0-1,500 mg/L까지 각각 농도별로 첨가하여 배지를 제조하고 15-18시간 동안의 비증식속도와 18시간 배양 후의 생균수를 측정하였다. Ammonium sulfate, sodium phosphate는 0-8 g/L까지 각각 농도별로 첨가하여 배지를 제조하고, 12-20시간 동안의 비증식속도와 20시간 배양 후의 생균수를 측정하였다.
비증식속도(specific growth rate, μ)에 대한 방정식은 다음과 같다.
X는 균체 농도(g/L), t는 시간(h), 그리고 μ는 비증식속도(h−1)이다.
Lab scale의 flask에서 얻어진 최적 배지조성을 바탕으로 scale-up에 따르는 배양 최적 조건을 확립하기 위해 5 L jar fermenter에 최적 배지조성(glucose 11 g/L, sucrose 4 g/L, yeast extract 19 g/L, ammonium sulfate 1 g/L, magnesium sulfate 0.5 g/L, sodium phosphate monobasic 2 g/L, sodium phosphate dibasic 2 g/L)으로 3.5 L를 제조하여 첨가하였다. 접종 전 에어 공급을 통해 충분히 포화시킨 후 전배양액을 1% 접종하였다. Mesa 등(1996)을 참고하여 통기량은 0.5 vvm으로 고정하였고, 온도는 28°C로 유지하였다. 배양 중 pH는 2M NaOH를 첨가하여 6.0으로 일정하게 조절하였으며 교반속도를 각각 150, 250, 350 rpm으로 하여 배양 중 DO(desolved oxygen)값과 흡광도, 생균수의 변화를 측정하였다.
3. 결과 및 고찰
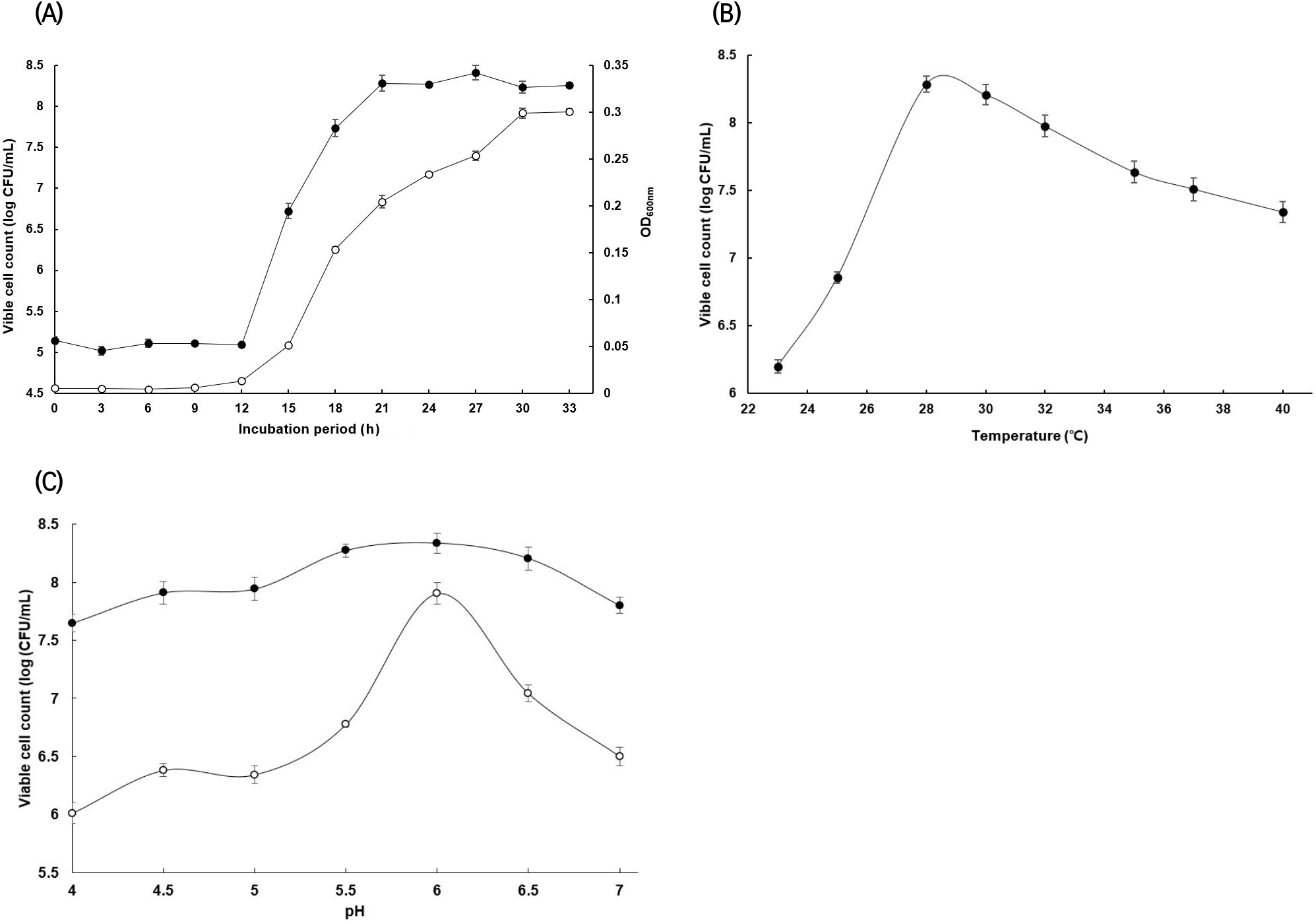
Acetobacter pasteurianus SRCM101388 균주의 배양시간에 따른 생균수와 흡광도의 분석결과는 유사한 패턴을 보였다. Lag phase는 0-12시간으로 나타났으며 stationary phase는 12-21시간이었다. SRCM101388은 21시간에서 최대 성장을 보였으며, 이때의 생균수는 2.55×108 CFU/mL, 흡광도는 0.2045이었다. 따라서 생균수가 높고 흡광도가 가장 크게 증가한 21시간을 배양시간으로 결정하였다(Fig. 1(A)). 배양온도는 배지의 산소 용해성 및 세포의 반응속도에 영향을 주며, 이에 따른 균주별 배양온도의 최적화를 확립하였다. 배양시간에 따른 SRCM101388의 최적온도는 28°C와 30°C에서 생균수는 각각 1.94×108 CFU/mL와 1.62×108 CFU/mL로 나타났다. 초산균의 성장은 28-30°C를 기준으로 낮은 온도보다는 높은 온도에서 더 높게 나타났다(Fig. 1(B)). SRCM101388의 초기 pH에 따른 생균수는 pH 6.0에서 가장 높게 나타났으며, 특히 stationary phase의 중간지점인 배양 18시간에서 큰 차이를 보였고 21시간 이후 pH 4와 7에서도 생균수가 크게 증가한 것을 확인할 수 있었다(Fig. 1(C)). Bang 등(2022)의 연구에 따르면 Acetobacter pasteurianus의 최적 온도는 30°C, pH는 6.0에서 가장 높은 생육을 나타내었는데, 이는 본 연구에 사용된 SRCM1388의 최적 배양 조건과 유사한 결과를 보였다.
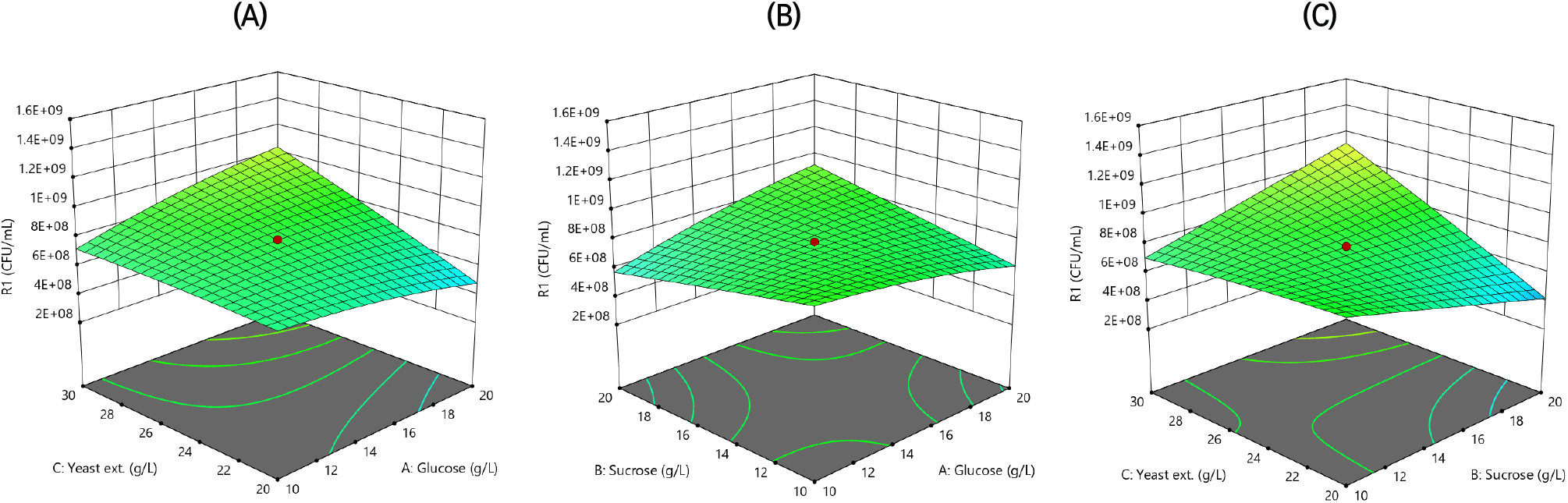
Plackett-Burman design에 의한 실험설계는 적은 실험 횟수로 각 독립변수가 결과에 미치는 영향을 예측할 수 있는 방법으로, 시간과 비용면에서 효율적이며 변수 선별 시 효과적이다(Yang 등 2016). Table 1의 결과값으로부터 각각의 변수가 생균수 증가에 미치는 영향을 분석한 plot은 Fig. 2에 나타내었으며, 결과값(R1)에 대한 factor들의 영향 및 모델의 적합성에 대한 통계 분석 결과는 Table 3에 나타내었다. 탄소원인 glucose, mannitol, sucrose, fructose는 생균수를 증가시키는 경향을 보였으며, 그중 glucose와 sucrose는 높은 수준에서 생균수를 증가시켰다. 질소원은 soy peptone, yeast extract와 malt extract에서 생균수를 증가시키는 경향을 보였으며 yeast extract가 가장 높은 수준에서 생균수를 증가시켰다. 생균수에 미치는 기타 미량원소는 ammonium sulfate, sodium phosphate, potassium phosphate, magnesium sulfate가 생균수를 증가시키는 경향을 보였으나, 첨가량에 따른 큰 차이를 나타내지 않았다. 본 연구에서는 통계분석 결과를 바탕으로 높은 수준에서 생균수를 증가시킨 glucose, sucrose, yeast extract를 선별하였다.
PBD를 통해 선별한 glucose, sucrose, yeast extract의 최적농도를 조사하기 위해 중심합성계획법을 이용하여 5개의 수준에서 3개의 중심점을 포함한 17개의 실험구에 대한 분산분석 결과는 Table 4에 나타내었다. Design expert 11 program를 이용한 회귀방정식은 다음과 같다.
반응값에 대한 분산분석을 실시한 결과, 결정계수(R-square)값이 0.9823으로 1에 가까운 수치를 나타내었고 모델의 p-value가 0.0001로 0.05보다 낮은 값을 나타내어 높은 유의성 및 실험의 적합도를 확인하였다. Lack of fit은 모형의 적합도를 검정하는 통계량으로 적합성 검정을 위해 lack of fit의 p-value를 확인하였다. 그 결과, 0.0664로 적합성을 판단하는 기준값인 0.05보다 높아 lack of fit의 결과가 회귀모형을 설명하기 적합함을 확인하였다. 또한, 3가지 변수 중 독립변수 하나를 최적점에 고정한 후 나머지 2개의 변수를 이용하여 3차원 형태로 교호작용을 확인한 결과를 Fig. 3에 나타내었다. 3가지 변수 모두 첨가량이 증가할수록 생균수 또한 증가하였으나, 예측 농도 중 가장 낮은 농도로 높은 생균수값을 가지는 최적배지농도를 선택하였다. 그 결과, glucose 10.73 g/L, sucrose 3.98 g/L, yeast extract 18.73 g/L로 나타났으며, 이때의 Acetobacter pasteurianus SRCM101388의 생균수는 1.49±0.197× 109CFU/mL로 예측되었다.
Acetobacter pasteurianus SRCM101388의 생균수를 검증하기 위하여 예측된 배지농도를 이용하여 21시간 후 생균수를 측정하였다. 측정결과, 생균수는 1.55±0.150×109 CFU/mL로 나타났으며, 실험모델에 의해 예측된 값(1.49±0.197×109)의 오차범위 내에 존재하여 예측된 값과 검증값이 신뢰할 수 있음을 확인하였다. Zhang 등(2016)에 따르면 Acetobacter xylinum는 glucose 20g/L 이상의 농도부터 흡광도값이 크게 감소하였으며, 질소원으로 peptone을 사용하였을 경우 20 g/L에서 가장 높은 흡광도값을 보이고, 그 이상의 농도부터는 흡광도값이 감소하는 경향을 보였다. 이는 탄소원과 질소원이 20 g/L 이상부터 생육에 저해를 줄 수 있음을 의미한다. 본 연구의 CCD 설계를 통한 시험결과, 탄소원과 질소원이 20 g/L를 넘지 않으므로 고농도로 인한 저해는 받지 않을 것으로 판단하였다.
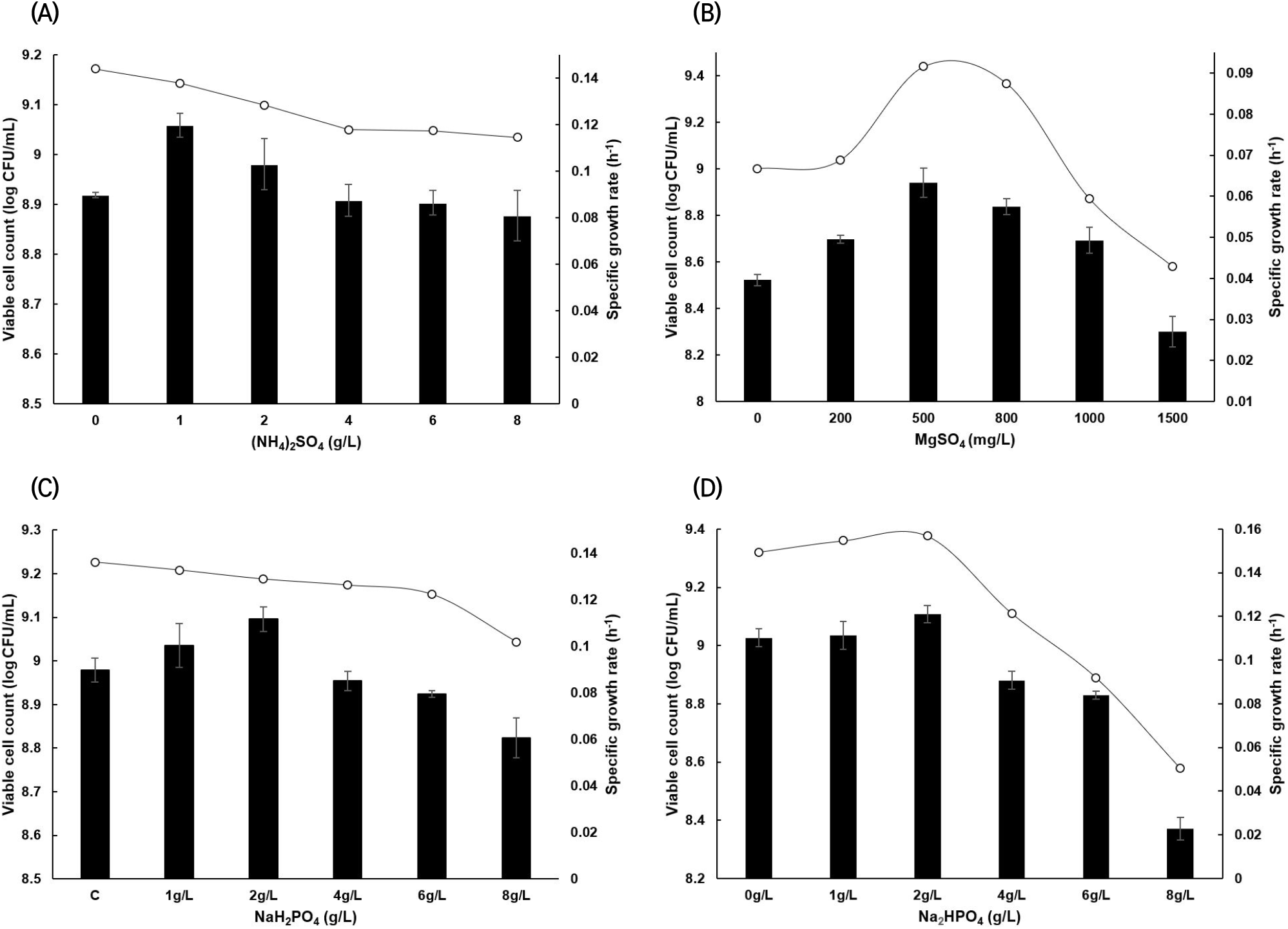
균체량 증가에 영향을 미치는 기타 미량원소의 최적농도는 생균수와 비증식속도에 미치는 영향을 고려하여 결정하였다. 또한, scale-up에 따른 배양 공정의 단순화와 설비의 최소화를 위해 기타 미량원소는 균체 성장에 저해받지 않는 최대농도를 조사하여 모두 첨가하였다. Ammonium sulfate는 1 g/L를 첨가하였을 경우, 비첨가구에 비해 생균수가 증가하는 경향을 보였고, 2 g/L 농도 이후에는 생균수가 감소하는 경향을 보였다. 비증식속도는 0-4 g/L까지 농도가 높아질수록 감소하였으나 1 g/L 농도에서의 비증식속도 감소는 다소 미미하였으며, 생균수의 증가가 가장 큰 농도인 1 g/L를 최적농도로 판단하였다(Fig. 4(A)). Magnesium sulfate의 경우, 500 mg/L의 농도까지 비증식속도가 증가하였으나, 그 이상의 농도에서는 농도가 증가함에 따라 비증식속도가 감소하는 경향을 보였다. 이때의 생균수는 비증식속도와 같은 경향을 보였으며, 800 mg/L 이상의 농도에서는 균체 성장이 저해받기 시작하였다. 따라서 비증식 속도와 생균수가 가장 높은 500 mg/L가 최적 농도라고 판단하였다(Fig. 4(B)). Sodium phosphate monobasic은 0-2 g/L의 농도까지 생균수가 증가하였으나 4 g/L 농도 이후 감소하는 경향을 보였다. 비증식속도는 농도가 높아짐에 따라 감소하였으나, 6 g/L 이하의 농도에서는 영향이 미미하였다(Fig. 4(C)). Sodium phosphate monobasic 2 g/L를 첨가하고 초기 배지의 최적 pH 조절과 buffer의 기능을 고려하여 sodium phosphate dibasic의 농도를 조사하였다(Fig. 4(D)). 0-2 g/L 농도까지는 비증식속도와 생균수가 모두 증가하였으나, 4 g/L 이상의 농도에서는 급격하게 감소하였다. 따라서 sodium phosphate monobasic 2 g/L를 함유한 배지에 추가로 sodium phosphate dibasic를 2 g/L를 첨가하였다. Adebayo-Tayo 등(2017)은 Acetobacter sp.를 이용한 효율적인 biocellulose(BC) 생산을 위해 sodium phosphate dibasic 등을 첨가한 복합 배지의 필요성에 대해 보고하였으며, Gomes(2013)는 ammonium sulfate와 potassium phosphate monobasic를 각각 1 g/L 첨가하였을 때 Gluconacetobacter sacchari의 BC 생산량이 2배 증가하였고, 질소 및 인을 추가 공급할 경우 세포성장이 BC 생산보다 더 선호되었다고 보고하였다. 이는 본 실험의 4 g/L sodium phosphate와 1g/L ammonium sulfate의 첨가가 생균수 증가를 나타낸 것과 유사하였다.
초산균은 유전적 불안정성으로 인해 외부환경에 민감하다(Azuma 등, 2009). 특히 산소가 부족한 조건에 극도로 민감하며, 이러한 조건에서는 대사 감소 및 성장이 억제된다(Hromatka 등, 1962). 따라서 호기적인 조건을 유지시키기 위한 연속적인 제어가 필요하다(Drysdale 등, 1989). 배양 중 호기적인 조건을 가장 쉽고 효과적으로 유지시키기 위한 제어로 교반속도(rpm), 통기량, 압력조절이 있으며, 이러한 조건을 확립하기 위하여 최적화된 배지 3.5 L를 함유한 5 L jar fermenter의 통기량을 0.5 vvm으로 고정한 후 교반속도 조건을 150, 250, 350 rpm으로 하여 DO의 변화와 생균수 및 흡광도값을 확인하였다(Fig 5(A)-(C)). 실험결과, rpm을 증가시킬수록 DO값이 증가하였으나, rpm이 높을수록 lag phase가 6시간(150 rpm)에서 10시간(350 rpm)까지 증가하였고, stationary phase에서의 생균수와 흡광도값 또한 낮게 나타났다. 150 rpm에서 초기 DO값의 감소가 가장 컸으며, 350 rpm에서는 4시간 이후부터 DO값이 감소하였으나 10시간 이후 다시 증가하여 유지되는 경향을 보였다. 이는 150 rpm에서 초산균의 성장이 가장 활발하게 일어난 것으로 보이며, rpm이 증가할수록 성장에 저해를 받는 것으로 판단된다. Fig. 5(A)의 결과에서도 같은 경향을 보였고 150 rpm과 250 rpm에서의 생균수와 OD의 차이는 미미하였으나 stationary phase에서의 성장은 150 rpm에서 더 높게 나타났다. 150과 250 rpm 조건에서는 배양 8시간과 12시간 이후 DO값이 5 이하의 값을 보이다가 각각 16시간과 18시간 이후 다시 증가하였고, 이에 따라 생균수 증가 또한 나타나지 않았다. 즉, DO값의 감소는 균체의 성장을 의미하며, 따라서 성장이 감소하면 DO값이 증가한다(Mathiazhakan 등, 2016). 본 연구에서 SRCM101388는 rpm 증가에 저해를 받는 것으로 나타났으며, DO값이 5% 이하로 유지된 상황 즉, 완전한 호기상태는 아니지만 통기가 유지되는 상황에서는 성장 가능한 것으로 판단된다.
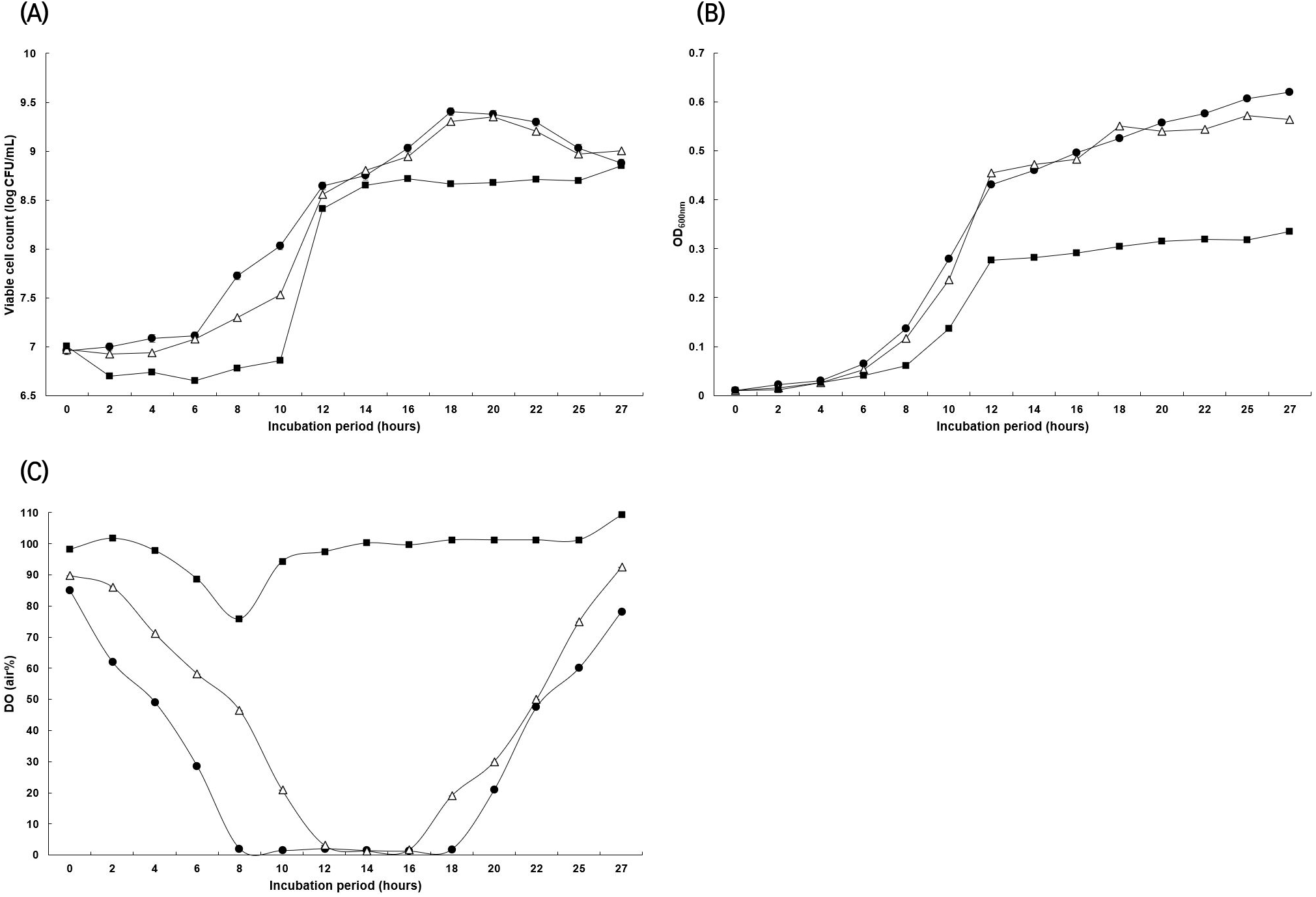
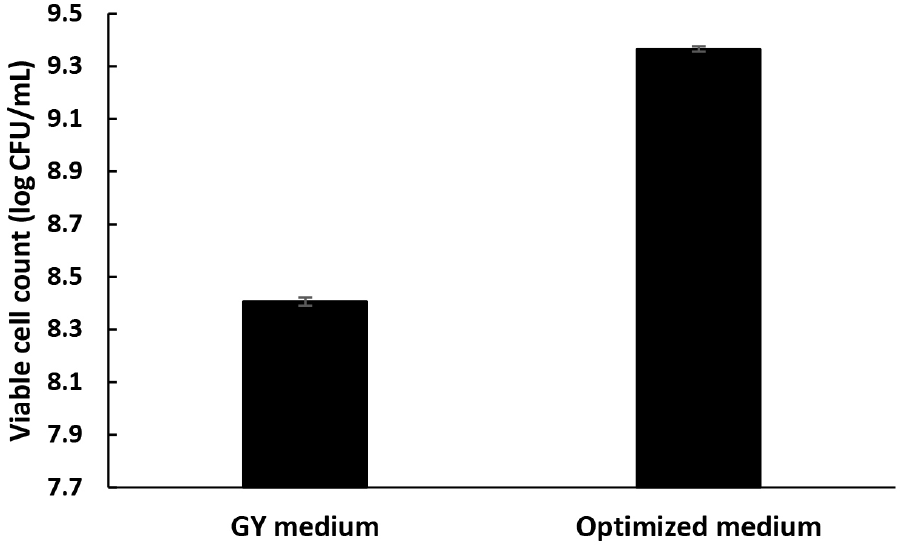
최종적으로 5 L jar fermenter에서 150 rpm, 0.5 vvm, pH 6.0, 28°C 조건에서 18시간 배양했을 때, 가장 높은 생균수(2.53±0.12×109CFU/mL)를 나타내었으며, 이는 최적화 이전의 21시간 배양된 GY 배지에 비해 5배 이상이었다(Fig. 6). 18시간 이후 DO값의 증가는 영양원 고갈이 유력해 보이며, 계속된 낮은 DO 또한 영향이 있을 것으로 보인다. 전단력에 의한 저해를 최소화하고 DO값을 증가시키기 위한 방법으로 기존 통기교반형 발효조(stirred tank fermenter)에서 공기부상형 발효조(air lift fermenter) 사용이 고려될 수 있다. 통기교반형 발효조는 통기에 의해 교반되고 기계적 교반이 필요하지 않기 때문에 낮은 전단력 및 에너지 절약 또한 기대할 수 있다(Muller 등, 2007). 또한, feeding을 통한 영양원 공급, 즉 fed-batch 배양이 병행된다면 18시간 이후 균체량을 더욱 증가시킬 수 있을 것으로 판단된다(Bae 등, 2004). 본 연구를 통하여 발효식초의 stater로서 활용할 수 있는 SRCM101388의 최적배지 조성 및 농도, 배양조건을 확립하였다. 향후 산업적 활용을 위한 scale-up 및 제형조건 최적화 등 추가적인 연구가 수행되어야 할 것으로 판단된다.
4. 요약
본 연구에서는 식품 원료로 이용이 허가된 Acetobacter pasteurianus SRCM101388을 사용하여 바이오매스 고농도배양을 위한 최적화 연구를 실시하였다. SRCM101388의 최적 배양온도와 pH 조건은 각각 28°C와 pH 6.0으로 나타났다. 배지조건을 확립하기 위하여 Plackett-Burman design을 실시한 결과, glucose, sucrose, yeast extract가 biomass 증가에 가장 높은 효과를 보였다. Glucose, sucrose, yeast extract의 최적농도를 알아보기 위하여 central composite design을 실시하였으며, 최적농도는 glucose 10.73 g/L, sucrose 3.98 g/L, yeast extract 18.73 g/L로 나타났다. Plackett-Burman design에서 biomass 증가에 영향이 있는 기타 미량원소에 대한 최적농도를 조사한 결과, ammonium sulfate 1 g/L, magnesium sulfate 0.5 g/L, sodium phosphate monobasic 2 g/L, sodium phosphate dibasic 2 g/L로 나타났으며, 최종 최적화된 배지 제조 시 pH는 6.10으로 최적 pH 조건과도 일치하였다. 최적화된 배지 3.5 L를 함유한 5 L jar fermenter에서의 배양결과, SRCM101388은 DO가 낮은 rpm에서 DO 감소가 더 빠르게 나타났다. 최대 생균수는 150 rpm, 0.5 vvm, pH 6.0, 28°C 조건에서 18시간 배양 시 2.53± 0.12×109 CFU/mL로 나타났다.











