1. 서론
현대사회는 의학 및 과학기술의 발달로 평균수명이 증대되었으나, 노화를 비롯한 신경병성 질환들의 발생이 증가됨에 따라 이를 예방하기 위한 관심이 증대되고 있다(Lee 등, 2023). 그 중, 알츠하이머성 치매는 65세 이상 성인의 사망원인 중 5위를 차지하며, 65세 이상 성인 4명 중 1명에게 나타나는 것으로 보고되었다(Wong, 2020). 알츠하이머성 치매는 뇌의 기능적 및 구조적 변화로 인해 기억력과 인지능력이 저하되는 점진적 신경 퇴행성 질환으로(Kim 등, 2020), 발병 원인은 완전히 밝혀지지 않았지만, 수많은 연구 결과에 따르면 산화적 스트레스(oxidative stress)와 비정상적인 단백질 응집으로 유발된 세포사멸과 밀접한 관련이 있다고 보고되었다(Feng 등, 2023; Kim 등, 2020).
산화적 스트레스는 과도한 스트레스, 흡연, 피로 등으로 인한 체내 대사의 불균형으로 인해 산화 유발 물질의 생성과 제거 간의 균형이 무너짐으로써 발생한다(Kang 등, 2021). 특히, 세포 호흡 과정에서 발생하는 활성산소종(reactive oxygen species, ROS)은 화학적으로 반응성이 높아 생체 분자들과 빠르게 반응하여 DNA 손상, 지질 과산화 및 단백질 변성 등을 일으킨다(Joo 등, 2023). 이러한 ROS을 조절하기 위해서 체내에는 항산화 방어 시스템을 가지고 있지만, 지속적으로 산화적 스트레스에 노출되게 되면 체내 항산화 체계가 무너져 활성산소종을 제거하는 능력이 떨어지게 된다(Kim 등, 2020). 따라서 산화적 스트레스로부터 인체를 보호하기 위해 폴리페놀 및 플라보노이드 등과 같은 식이 항산화제의 적절한 섭취가 요구된다(Feng 등, 2023). 특히, 식품에서 유래하여 안전성이 입증된 항산화제의 섭취는 체내에서 산화적 스트레스를 효과적으로 저해시킬 수 있다고 보고되고 있어 식품 소재로부터 항산화제를 찾는 연구가 활발히 진행되고 있다(Joo 등, 2023).
적하수오(Polygonum multiflorum)는 마디풀과에 속하는 다년생 덩굴 모양의 식물로 한국, 중국, 일본에서 생산된다. Wang 등(2017)의 연구에 의하면 적하수오를 UPLC-Q-TOF-MS로 분석한 결과, 적하수오에는 stilbenes, flavonoids, anthraquinones 및 naphthoquinone 등의 기능성 물질이 존재하며, 이들 중 2,3,5,4’-tetrahydroxystilbene-2-Ο-beta-D-glucoside (TSG)가 다른 물질대비 상대적으로 높은 peak를 나타내었다고 보고되어 있으며, 약리학적 연구들에 따르면 적하수오는 당뇨병 유발 골다공증, 산화적 스트레스 유발 간 손상, 국소 뇌 허혈을 개선하는 동시에 학습 및 기억 능력을 촉진하는 것으로 나타났다(Choi 등, 2021). 또한, 적하수오의 주요 생리활성 지표인 TSG는 항염증, 항산화, 심혈관 보호, 간 보호 등 다양한 질병의 예방 및 치료에 크게 기여하는 역할을 수행한다고 밝혀졌으며, 현재 TSG를 활용하기 위해 임상 유효성과 안전성을 평가하기 위한 연구가 진행 중이다(Wang등, 2022). 적하수오를 소재로 다양한 생리활성 연구가 수행되었음에도, 항산화 활성 및 뇌 신경세포 보호 효과와 관련한 연구는 부족한 실정이다. 따라서 본 연구에서 적하수오의 추출물을 활용하여 in vitro 항산화 활성 평가와 α-glucosidase 및 아세틸콜린 분해 억제 효과, H2O2로 유도된 뇌 신경세포 손상에 대한 보호 효과, 주요 생리활성 물질을 동정 및 정량함으로써 건강기능식품 소재로서의 활용 가능성을 평가하고자 연구를 수행하였다.
2. 재료 및 방법
Folin-Ciocalteu’s phenol reagent, rutin, 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS), 2-thiobarbituric acid(TBA), catechin, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetra-zoliumbromide(MTT), 2’,7’-dichlorodihydrofluorescein diacetate(DCF-DA), Dulbecco’s modified eagle medium(DMEM), penicillin, streptomycin, H2O2 및 ascorbic acid는 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하여 사용하였고, Na2CO3, dimethyl sulfoxide(DMSO), NaOH, sodium phosphate buffer는 Daejung Chemicals & Metals Co.(Siheung, Korea)에서 구입하여 사용하였으며, 2,3,5,4’-tetrahydroxystilbene-2-Ο-beta-D-glucoside(TSG)는 Tokyo Chemical Industry Co. (Tokyo, Japan)에서 구입하여 사용하였다. 이외에 사용된 용매 및 시약은 모두 extra pure(1급) 이상을 사용하였다.
본 연구에 사용된 적하수오는 2022년 충남 서산의 농가에서 재배하여 판매하는 것을 구매하여 사용하였다. 동결건조기(FDU-8612, Operon, Gimpo, Korea)에서 적하수오를 건조 후 분쇄하여, 분쇄한 적하수오 20 g을 각각 0, 20, 40, 60, 80, 95% 에탄올 1 L와 혼합하여 환류냉각하에서 2시간 동안 추출하였으며, 추출액은 여과하여 회전진공농축기(N-N series, Eyela Co., Tokyo, Japan)로 농축하였고, 이를 동결건조기(FDU-8612, Operon)를 이용하여 건조한 뒤, −20°C에 냉동 보관한 후 실험에 사용하였다.
0, 20, 40, 60, 80 및 95% 에탄올 추출물 중 우수한 활성을 나타내는 에탄올 추출물 농도를 확인하기 위해 총페놀성 화합물 함량 및 총플라보노이드 함량 측정 실험을 진행하였다. 총페놀성 화합물 함량을 측정하기 위해 시료 용액에 증류수 및 Folin-Ciocalteu’s 시약을 첨가하여 5분간 실온에서 반응시킨 뒤, 7% Na2CO3 및 증류수를 첨가하여 2시간 동안 실온에서 반응시켰다. 반응 용액을 760 nm 파장에서 분광광도계(UV-1800, Shimadzu, Tokyo, Japan)를 이용하여 흡광도를 측정하였으며, 시료의 총페놀성 화합물 함량은 gallic acid(Yakuri, Kyoto, Japan)을 사용하여 시료와 같은 방법으로 작성된 표준곡선을 통해 계산하였다.
총플라보노이드 함량을 측정하기 위해 시료 용액에 diethylene glycol(Samchun, Pyeongtaek, Korea)과 NaOH를 넣고 혼합하여 1시간 동안 30°C에서 반응시켰다. 반응 용액을 420 nm 파장에서 흡광도를 측정하였으며, 시료의 총플라보노이드 화합물 함량은 rutin을 사용하여 시료와 같은 방법으로 작성된 표준곡선을 통해 계산하였다.
ABTS 라디칼 소거 활성을 측정하기 위해 1 mM 2,2’-azobis (2-amidinopropane) dihydrochloride(AAPH), 0.15 M NaCl이 함유된 0.1 M monopotassium phosphate buffer(pH 7.4) 및 2.5 mM ABTS 시약을 혼합하여 30분간 68°C의 항온수조에서 반응시켰다. 이후 실온에서 10분간 냉각 후 제조된 용액을 0.45 μm syringe filter로 여과한 다음 약 24시간 냉장 보관 이후 실험에 사용하였다. ABTS 용액은 734 nm 파장에서 흡광도 값이 0.70±0.02가 나오도록 맞춘 이후 준비된 시료와 혼합하여 10분간 37°C에서 반응시키고, 734 nm 파장에서 흡광도를 측정하였다.
지질과산화물 생성 억제 활성을 측정하기 위해 Samtako (Osan, Korea)로부터 4주령의 수컷 Institute of Cancer Research (ICR) 마우스를 구입하여 12시간 주기로 낮/밤을 교대시키며 항온(22±2°C), 항습(50-55°C) 조건으로 1주일간 사육하였다. 이후 뇌를 적출하여 조직 무게의 10배에 해당하는 0.02 M Tris hydrochloride buffer (pH 7.4)를 넣어 균질화한 후 15분 동안 12,000 ×g, 4°C 조건으로 원심분리하여 얻은 상층액을 이용하여 실험을 진행하였다. 시료에 전처리하여 얻은 뇌 조직 상층액, 0.01 mM FeSO4, 0.1 mM ascorbic acid를 가한 뒤 1시간 동안 37°C에서 반응시켰다. 이후 30% TCA (Kanto, Tokyo, Japan)와 1% TBA를 첨가하여 20분간 80°C 항온수조에서 반응시킨 후, 원심분리하여 불순물을 제거하고, 532 nm 파장에서 흡광도를 측정하였다(Chang 등, 2001). 본 연구는 경상국립대학교 IACUC 승인을 받아 수행하였다(경상국립대학교 동물실험 승인 번호: GNU-220429-M0042, 승인일: 2022.04.29.).
α-Glucosidase 억제 활성 측정을 위해 0.1 M sodium phosphate buffer(pH 6.9)에 시료 및 0.5 unit/mL 농도의 α-glucosidase 효소액을 혼합하여 37°C에서 10분간 배양한 후, 기질인 3 mM 4-nitrophenyl-α-D-glucopyranoside를 가하여 37°C에서 5분간 반응시켰다. 이후 반응 용액을 마이크로플레이트 리더기(Epoch 2, Bio-Tek Instruments, Inc., Winooski, VT, USA)를 이용하여 405 nm 파장에서 흡광도를 측정하였다.
AChE 억제 활성을 측정하기 위해 acetylthiocholine iodide (ATCI)을 기질로, 5,5’-dithiobis(2-nitrobenzoic aicd)(DTNB)를 발색 시약으로 사용하였다. 적하수오 40% 에탄올 추출물과 AChE(0.1 U/mL)를 PBS에 첨가하고, 37°C에서 5분간 방치하였다. 이후 DTNB(5 mM)와 ATCI(15 mM)를 첨가한 뒤 37°C 배양기에서 10분간 정치시킨 후, 마이크로플레이트 리더기(Epoch 2, Bio-Tek Instruments, Inc.)를 이용하여 405 nm 파장에서 흡광도를 측정하였다.
HT22 세포는 마우스의 뇌 해마 조직에서 유래한 것으로 뇌 신경세포의 특성을 나타내며, 경상국립대학교 수의과대학 조직학실험실(Jinju, Korea)에서 2021년 12월에 분양받아 사용하였다. HT22 세포는 10% calf serum(CS, Gibco, Grand Island, NY, USA), 1% 50 units/mL penicillin 및 100 μg/mL streptomycin이 포함된 DMEM 배지를 이용하여 37°C, 5% CO2 조건으로 배양하였다.
SK-N-MC 세포는 인체에서 유래한 신경모세포종 세포주로 한국세포주은행(Seoul, Korea)에서 분양받아 사용하였다. SK-N-MC 세포는 DMEM 배지에 10% fetal bovine serum(FBS, Corning, Glendale, Arizona, USA), 1% 50 units/mL penicillin 및 100 μg/mL streptomycin을 첨가하여 이용하였으며, 37°C, 5% CO2 조건으로 배양하였다.
뇌 신경세포 생존율을 확인하기 위해 세포를 1×106 cells/10 mL로 계수한 후 96-well cell culture plate에 100 μL씩 분주하여 24시간 배양하였다. 이후 시료 용액을 처리하여 24시간 배양한 뒤 0.2 mM H2O2를 처리하여 3시간 동안 반응시켰다. 마지막으로 세포에 10 μM MTT 용액을 처리하여 2시간 동안 반응시킨 뒤 배지를 제거하고 DMSO를 처리하였다. 이를 마이크로플레이트 리더기(Epoch 2, Bio-Tek Instruments, Inc.)를 이용하여 determination wavelength(570 nm)와 reference wavelength (655 nm)에서 흡광도를 측정하였다.
세포 내 ROS 수준을 측정하기 위해 세포를 1×106 cells/10 mL로 계수한 후 96-well black plate에 100 μL씩 분주하여 24시간 동안 배양하였다. 이후 시료 용액을 처리하여 24시간 동안 배양한 뒤 0.2 mM H2O2를 처리하여 3시간 동안 반응시켰다. 마지막으로 세포에 10 μM DCF-DA를 차광하여 처리한 다음 50분 뒤 형광광도계(Infinite F200, Tecan, Männedorf, Switzerland)를 이용하여 485 nm(excitation wavelength)와 535 nm(emission wavelength)에서 형광 광도를 측정하였다.
시료 내 함유된 생리활성 물질은 고성능 액체크로마토그래피(Ultimate 3000 series, Dionex, Sunnyvale, CA, USA)를 이용하여 분석하였다. Column은 YMC-Triart C18(250×4.6 mm, 5 μm, YMC Korea, Seongnam, Korea)를 사용하였으며, 50% MeOH에 용해하여 0.45 μm filter로 여과한 시료 20 μL로 주입하였으며, 이동상은 증류수(0.1% formic acid)(A) 및 acetonitrile (0.1% formic acid)(B)로 구성되었으며 용매 조성은 0%-100% (2-32 min), 100%(32-35 min), 100-0%(35-40 min)로 설정하여 총 40분간 분석하였다. 유속은 1 mL/min, 검출기는 diode array detector(DAD)를 이용하였으며, 310 nm의 UV 파장을 측정하였다. 이후 유사성 판단을 위해 검출 파장에 대한 시료와 표준물질의 UV 스펙트럼을 비교하였으며, 검출된 물질의 정량 분석을 위해 표준물질을 6개의 농도구배로 단계 희석한 다음, 시료와 동일한 방법으로 분석한 뒤 나타난 표준물질의 농도 대비 크로마토그램 peak 면적에 대한 검량곡선을 작성하였다. 작성한 검량곡선에 시료의 크로마토그램 peak 면적을 대입함으로써, 시료에 함유된 표준물질의 함량을 계산하였다.
3. 결과 및 고찰
가장 항산화 활성이 우수한 에탄올 추출물을 선정하기 위하여 각 에탄올 농도별 추출물의 총페놀성 화합물과 총플라보노이드 함량을 측정한 결과는 Fig. 1A, 1B와 같다. 0, 20, 40, 60, 80 및 95% 추출물의 총페놀성 화합물 함량은 각각 63.74, 98.83, 105.69, 55.87, 93.93, 124.66 mg of GAE/g이며, 총플라보노이드 함량은 각각 not detected(ND), 26.10, 28.92, 25.85, 30.59, 38.54 mg of RE/g으로 나타났다. 추출 수율과 총페놀성 화합물 및 총플라보노이드 함량 측정 결과를 고려하였을 때, 40% 에탄올 추출물이 우수하여 이후의 실험에서는 적하수오 40% 에탄올 추출물을 이용하여 진행하였다.
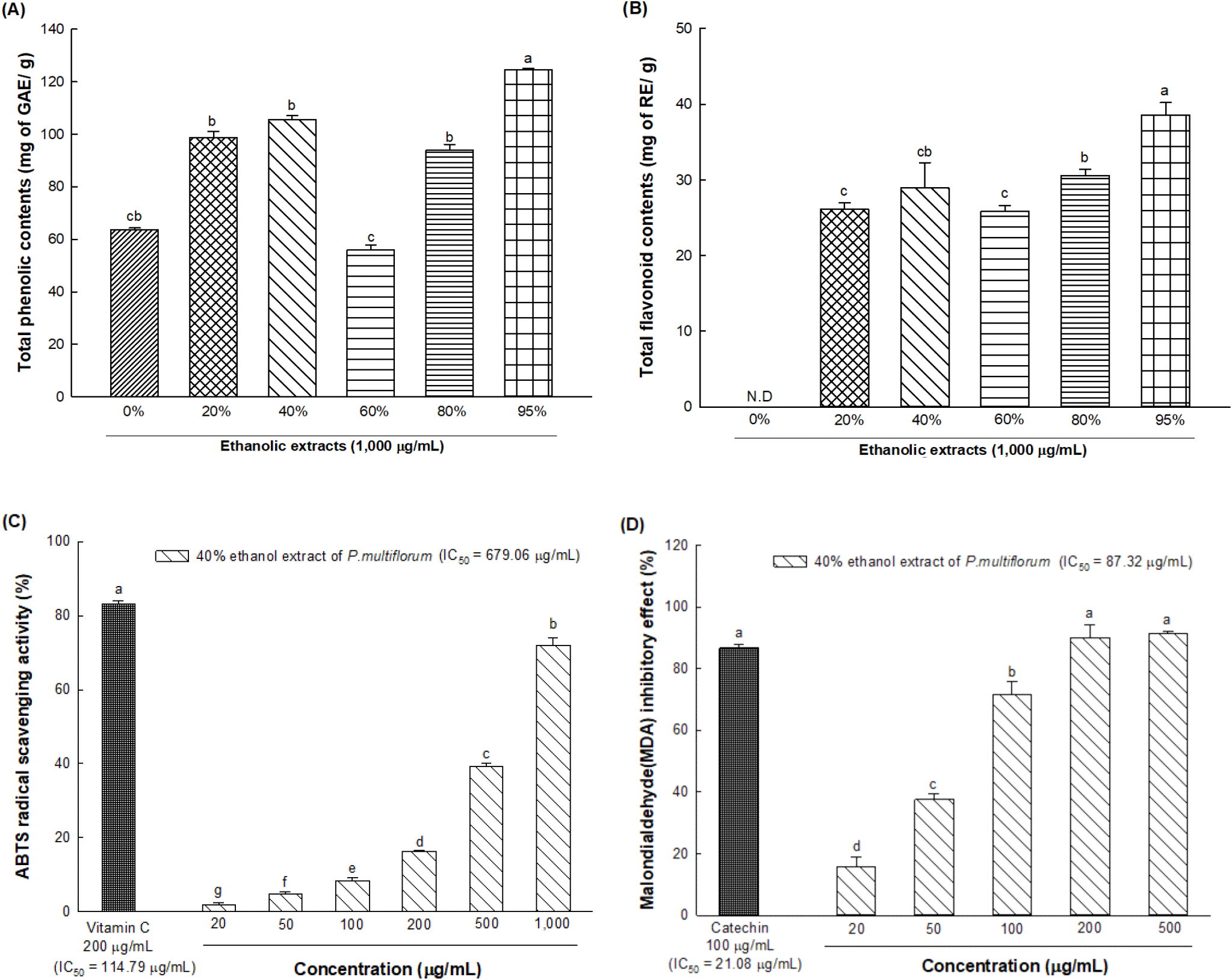
적하수오 40% 에탄올 추출물의 ABTS 라디칼 제거 활성을 측정한 결과, IC50은 679.06 μg/mL로 나타났고 양성 대조군인 비타민 C의 IC50은 114.79 μg/mL로 나타났다(Fig. 1C). 또한, 지질과산화물 생성 억제 활성은 TBA의 반응에 의한 malondialdehyde (MDA)-TBA adduct를 검출함으로써 평가되었다. MDA 억제 활성을 측정한 결과, 적하수오 40% 에탄올 추출물의 IC50은 87.32 μg/mL, 양성 대조군인 카테킨의 IC50은 21.08 μg/mL이었으며, 적하수오 40% 에탄올 추출물의 지질과산화물 생성 억제 활성은 200 μg/mL 농도에서 89.91%로 양성 대조군인 카테킨(86.73%)의 억제 능력 대비 유의적으로 우수한 지방질 과산화물 생성 억제 효과를 나타내었다(Fig. 1D).
식물의 2차 대사산물인 페놀성 화합물과 플라보노이드는 과일 및 채소류에 많이 함유되어 있으며, 방향족 고리에 1개 이상의 hydroxyl기를 가지고 있어 자유 라디칼을 소거하여 항산화 활성에 중요한 역할을 하는 것으로 알려져 있다(Nagarajan 등, 2020). Liu 등(2018)에 따르면 적하수오에는 gallic acid, catechin, rutin, quercetin과 같은 생리활성 물질들이 풍부하며, 이에 따라 체내 활성산소를 중화시키고 활성산소를 안정한 물질로 환원시켜 활성산소 연쇄반응을 효과적으로 방지하는 것으로 보고하였다. 따라서 본 연구에서 사용된 적하수오 40% 에탄올 추출물의 항산화 활성은 다른 추출물 대비 높은 총페놀성 화합물 및 플라보노이드 화합물과 같은 생리활성 물질에서 기인한 것으로 판단된다.
뇌는 다른 조직에 비해 불포화지방산 함량이 풍부하고 산소 요구량이 높으며, 상대적으로 약한 내인성 항산화 방어 시스템을 가지고 있어 산화환원 항상성의 불균형에 취약하다(Feng 등, 2023). 또한, Fe2+ 및 Cu2+와 같은 산화환원 활성 전이 금속은 뇌에 풍부하여 펜톤 반응에 의해 생성되는 ROS가 세포막의 지질로부터 전자를 빼앗아 세포를 손상시키는 지질 과산화가 일어나 MDA와 같은 지질과산화물의 생성을 야기한다(Lee 등, 2020). Lv 등(2007) 연구에 따르면 적하수오에 함유된 stilbene 배당체는 노화로 인한 산화적 스트레스로부터 쥐 조직(심장, 뇌 및 간)을 보호하는 강력한 항산화제 역할을 한다는 결과를 보고하였다. 또한, Wang 등(2022)에 의하면 적하수오에 함유된 TSG는 산화적 스트레스를 억제하고 신경세포 사멸과 자가포식을 감소시킴으로써 중뇌동맥 폐쇄 모델에서 뇌 경색량 감소, 허혈성 피질과 해마의 신경 손상 개선 및 발현 억제를 통해 뇌 허혈/재관류 손상을 약화시키고 신경학적 결핍 증상을 완화시키는 것으로 보고하였다. 따라서 적하수오 40% 에탄올 추출물은 지질과산화물의 억제뿐만 아니라 산화 방지 효소 활성을 증가시켜 산화적 스트레스로부터 뇌 신경세포 보호에 도움을 줄 수 있을 것으로 판단된다.
적하수오 40% 에탄올 추출물의 α-glucosidase 억제 효과는 농도 의존적으로 증가하는 경향을 보였으며, 적하수오 40% 에탄올 추출물의 IC50은 3.27 μg/mL로 나타났고, 양성 대조군으로 사용된 acarbose의 IC50값은 168.14 μg/mL로 적하수오 에탄올 추출물이 현저하게 높은 α-glucosidase 억제 효과를 나타냈다(Fig. 2A). 적하수오 40% 에탄올 추출물의 AChE 억제 활성을 측정한 결과, IC50은 19.71 μg/mL로 나타났고 양성 대조군으로 사용된 tacrine의 IC50값은 0.028 μg/mL로 나타났다. 적하수오 40% 에탄올 추출물 30 μg/mL 농도에서 66.52%의 억제 활성을 나타냈으며, 농도가 낮아짐에 따라 억제 활성이 감소하는 경향을 보였다(Fig. 2B).
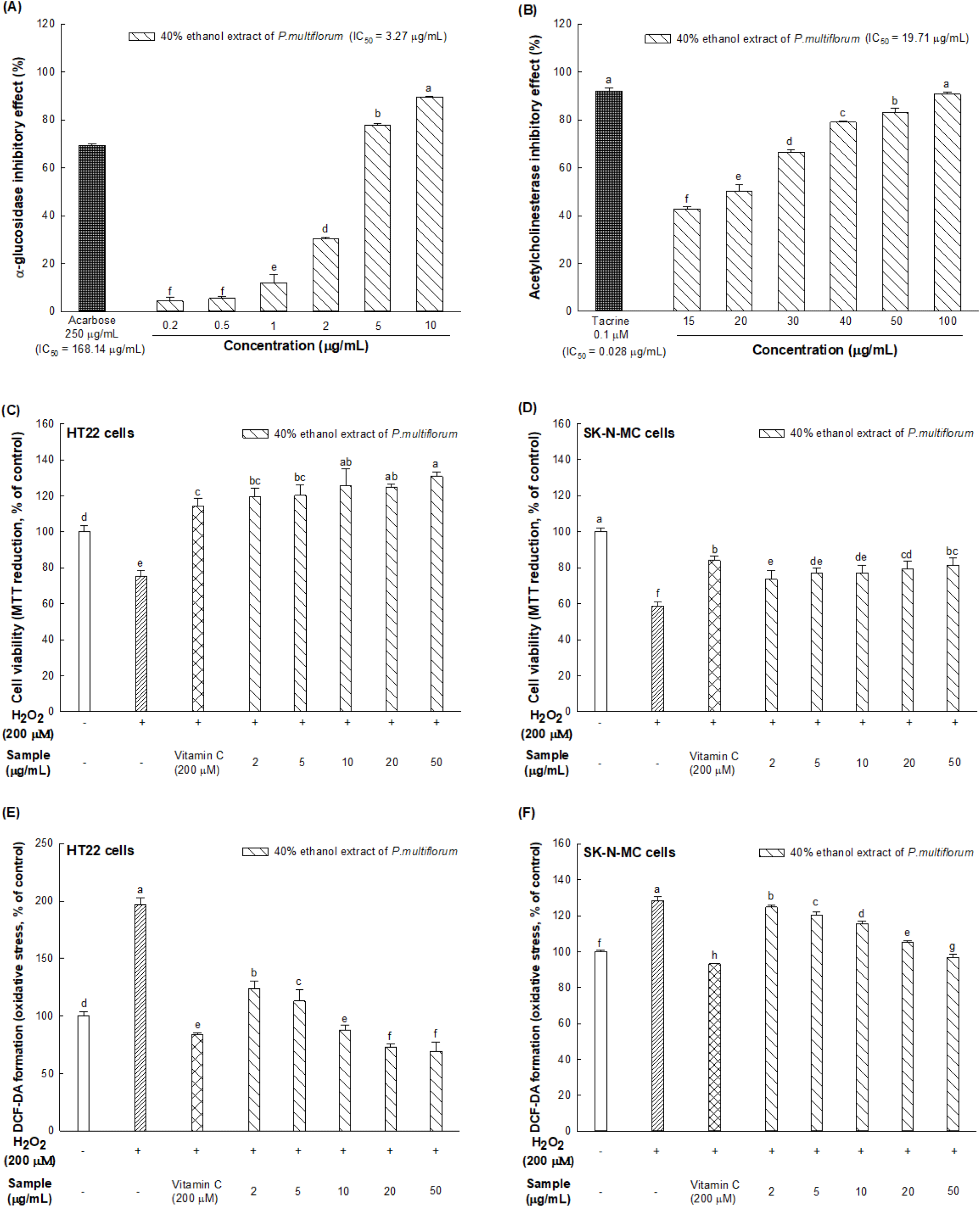
혈중 포도당 농도가 조절되지 않아 고혈당 상태가 지속되는 만성 고혈당증은 뉴런 독성, 최종 당화산물 생성으로 산화적 스트레스와 염증 증가로 신경 손상을 초래할 뿐만 아니라, 신경 퇴행 및 인지 장애를 유발한다(Gupta 등, 2023). 이러한 고혈당증 치료를 위해 acarbose와 같은 α-glucosidase 억제제를 활용하는데, 이는 탄수화물 소화의 최종단계에서 이당류가 단당류로 가수분해되는 것을 억제하여 식후 포도당 흡수를 지연시키는 작용을 한다(Papoutsis 등, 2021). 또한, 만성 고혈당증에 의한 산화적 스트레스로 인해 항상성이 파괴되면 아세틸콜린(acetylcholine, ACh)의 생성을 감소시키고, AChE의 활성을 과도하게 증가시킴으로써 인지기능 장애에 영향을 미칠 수 있는 것으로 알려져 있다(Moon 등, 2022). ACh은 콜린성 뉴런에 의해 합성되는 주요 신경전달물질이며, 콜린성 뉴런은 뇌에 널리 분포되어 있을 뿐만 아니라 학습, 기억, 주의력 및 사고 능력과 같은 많은 인지 기능 조절에 관여한다(Bekdash, 2021). 이러한 ACh의 분해를 저해하기 위해 tacrine과 같은 AChE 억제제를 사용하여 ACh의 분해를 억제시킬 수 있다(Xie 등, 2023). 하지만, acarbose와 tacrine과 같은 약물은 복통, 설사 등과 같은 위장장애 및 간 독성의 부작용을 가지고 있다. 따라서, 고혈당 및 인지기능 장애를 예방 및 치료를 위한 목적으로 부작용이 적은 천연소재로부터 효능을 확인하기 위한 연구가 활발히 진행 중이다(Xie 등, 2023).
적하수오에 함유된 stilbene 및 anthraquinone은 스코폴라민(scopolamine)에 의해 유도된 학습 및 기억 능력 장애 모델에서 콜린성 및 시냅스 관련 단백질을 강화함으로써 개선하는 것으로 알려져 있다(Xie 등, 2023). 또한, 적하수오에 함유된 것으로 알려진 TSG는 고지방식이로 유도된 당뇨병 마우스에서 효과가 있을 뿐 아니라, 당뇨병성 골다공증 발병에 중요한 역할을 하는 renin-angiotensin 시스템을 억제할 수 있다고 보고되고 있다(Gu 등, 2020).
Kim(2012)에 따르면 고혈당증과 관련된 대사질환들이 뇌혈관질환을 일으키는 주요한 위험인자이며, 우리나라에서도 고혈당증이 혈관성 치매뿐만 아니라, 알츠하이머병의 위험을 높인다고 보고하였다. 따라서 본 연구 결과는 stilbene 화합물과 anthraquinone이 풍부한 적하수오 40% 에탄올 추출물이 산화적 스트레스를 줄이고, 포도당 대사와 아세틸콜린 감소에 관여하는 효소를 억제함으로써 고혈당증의 신경 퇴행성 변화를 예방하고 개선에 도움을 줄 수 있는 천연소재로서의 이용 가치가 있음을 확인하였다.
적하수오 40% 에탄올 추출물의 신경세포 보호 효과를 확인하기 위해 HT22, SK-N-MC 세포에서 H2O2로 산화적 스트레스를 유도하였다. Lee 등(2014) 연구에 따르면 RAW 264.7 세포에 적하수오 70% 에탄올 추출물 25-500 μg/mL를 처리하였을 때, 250 μg/mL 이상의 농도에서는 세포독성을 나타내었으며, Lin 등(2018)은 HepG2 세포에 적하수오 50% 에탄올 추출물 0-100 μg/mL를 처리하였을 때, 세포독성을 나타내지 않았다고 보고하였다. 따라서 본 연구에서는 세포독성이 없다고 판단되는 적하수오 40% 에탄올 추출물의 농도를 결정하여 2-50 μg/mL로 처리하였다. 세포 생존율을 확인하기 위해 살아있는 세포 속 미토콘드리아가 생성한 탈수소효소에 의해 MTT를 환원시켜 보라색의 formazan crystal을 형성하는 것을 이용하였다. H2O2를 단독으로 처리한 HT22, SK-N-MC 세포에서 세포 생존율은 정상 대조군 대비 각각 75.23%, 52.72%로 나타났으며, 2 μg/mL의 농도로 적하수오 40% 에탄올 추출물을 처리한 세포의 생존율은 각각 119.71%, 73.64%로 나타나 적하수오 40% 에탄올 추출물이 H2O2로 유도된 산화적 스트레스에 대한 신경세포 생존율을 증가시키는 것을 확인할 수 있었다(Fig. 2C와 2D). 다만, HT22 세포에서 적하수오 40% 에탄올 추출물 처리군의 세포 생존율이 100%를 초과한 것은 세포밀도가 포화되어 생존세포와 흡광도 사이의 선형 비례 관계를 넘어선 것으로 추측된다(Benov, 2021).
세포 내 ROS 수준을 측정하기 위해 세포 투과성 형광원성 프로브인 DCFH-DA가 세포 내 분해효소에 의해 탈 아세틸화되어 비형광성 DCFH로 되고, 이는 ROS에 의해 빠르게 형광성이 높은 DCF로 산화되는 것을 이용하였다(Kim 등, 2020). H2O2를 단독으로 처리한 HT22, SK-N-MC 세포 내 ROS 수준은 각각 정상 대조군(100%) 대비 196.72%, 128.40% 증가한 것으로 나타났으며, 2 μg/mL의 농도로 적하수오 40% 에탄올 추출물을 처리한 세포 내 ROS 수준은 각각 123.58%, 124.80%로 나타났다(Fig. 2E와 2F).
신경세포 퇴화 및 손상의 중요한 원인인 산화적 스트레스는 DNA 손상, 지질 과산화, 단백질 산화, 세포사멸 유전자의 발현 등의 세포 산화적 손상을 통해 세포사멸 또는 괴사를 유도한다(Kim 등, 2020). Jiang 등(2017)의 연구에서 적하수오에서 분리된 TSG는 인간 뇌 미세혈관 내피세포에서 superoxide dismutase (SOD)와 glutathione의 활성을 증가시키고 MDA와 ROS의 함량을 감소시켜 H2O2로 유도된 산화적 스트레스에 대한 보호 효과를 보고하였다. 또한, Teka 등(2021)에 의하면 적하수오의 주요 성분인 anthraquinone 및 stilbene은 면역조절, 항염증, 항돌연변이, 항균 및 항고지혈증과 같은 다양한 치료 활성을 담당한다고 보고하였다. 이러한 결과들을 고려해 보았을 때, 본 연구에서 나타난 적하수오 40% 에탄올 추출물의 α-glucosidase 억제 효과, AChE 억제 효과 및 뇌 신경세포 보호 효과는 TSG를 포함한 anthraquinone 및 stilbene 화합물에서 기인한 것으로 추측된다.
적하수오 40% 에탄올 추출물의 생리활성 물질을 확인하기 위해 고성능 액체크로마토그래피 분석(HPLC)을 진행하였다. 적하수오 40% 에탄올 추출물의 HPLC 분석 결과는 표준물질의 머무름 시간(retention time, RT)과 UV-Vis spectrum을 비교하여 나타내었다. 310 nm 파장에서 15.28분에 나타난 peak은 15.29분에 peak을 나타낸 표준물질인 2,3,5,4’-tetrahydroxystilbene-2-Ο-beta-D-glucoside(TSG)와 999.95의 상동성(similarity)을 나타냈다(Fig. 3A). 따라서, 적하수오 40% 에탄올 추출물에서 15.28분에 나타난 peak은 TSG로 확인된다. 또한, 적하수오 40% 에탄올 추출물에 함유된 TSG를 정량 분석한 결과, 93.62±5.82 μg/mg of dried weight로 나타났다(Fig. 3B).
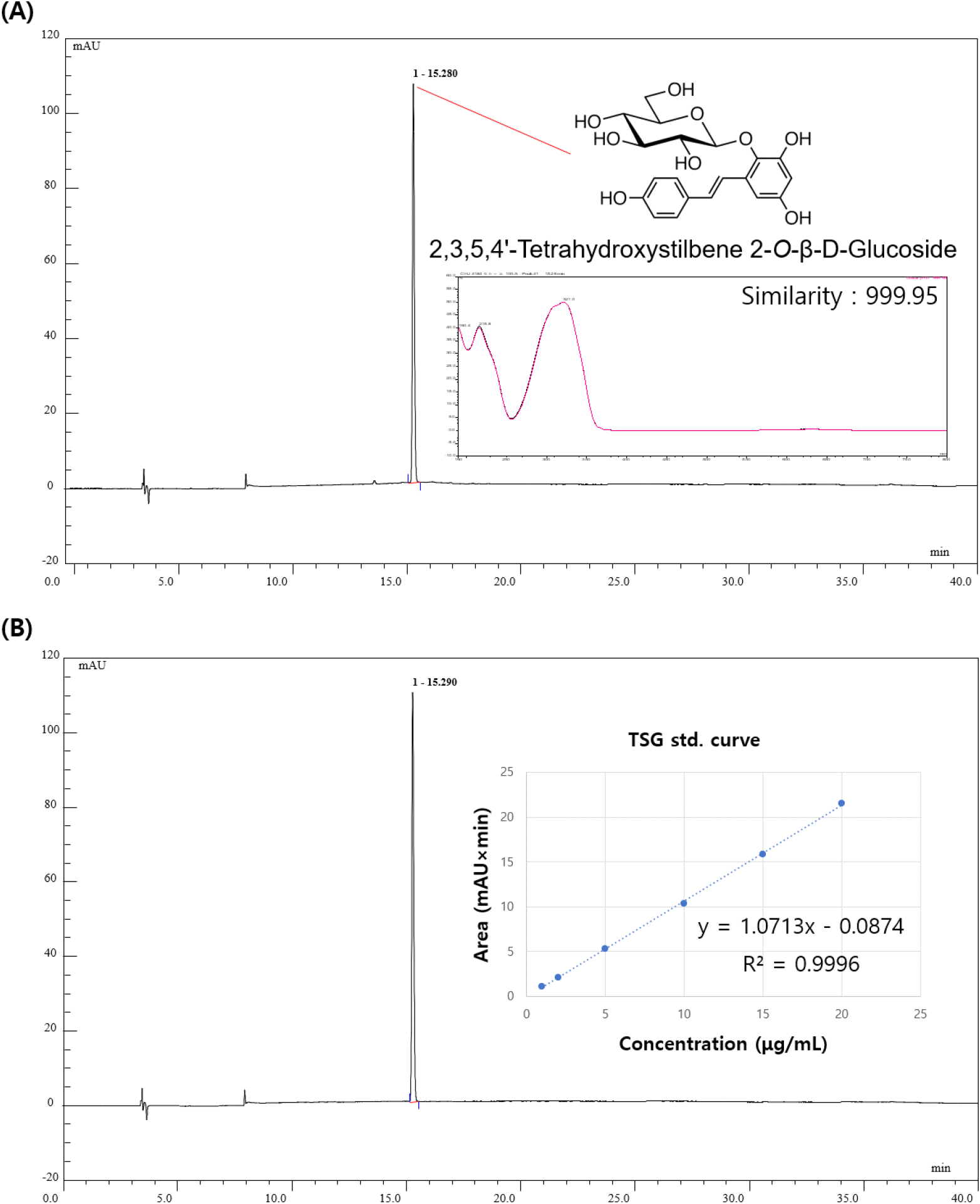
적하수오에 함유된 것으로 알려진 TSG의 구조는 특히 심혈관 보호 및 신경 보호에서 수많은 생물학적 활성을 나타내는 것으로 알려진 resveratrol(3,4’,5-trihydroxy-trans-stilbene)의 구조와 유사하다(Zhang 등, 2018). TSG는 H2O2로 유도된 PC12 세포(neuronal cells)에서 heme oxygenase-1 및 nuclear factor E2 관련 인자의 전위를 통해 산화적 스트레스에 대한 세포 보호 효과를 나타낸 것으로 보고되었으며(Jiang 등, 2017), Wang 등(2022)에 따르면 TSG는 LPS로 유도된 소교세포에서 NADPH 산화효소 활성화를 약화시킬 뿐만 아니라, tumor necrosis factor-α(TNF-α), interleukin-1 beta(IL-1β) 및 nitric oxide (NO)와 같은 전 염증성 사이토카인의 방출을 감소시켜 뇌의 면역세포 보호함으로써 신경세포 손상을 보호한다고 보고하였다. 또한, Jiang 등(2017)에 따르면 TSG는 인간 뇌 미세혈관 내피세포에서 산화적 스트레스로 인한 DNA 손상을 억제할 수 있으며, TSG가 상류 전사 인자로서 염증 반응을 조절할 수 있는 nuclear factor kappa-light-chain-enhancer of activated B cells(NF-κB) 단백질 발현 수준을 억제할 수 있음을 나타내었다. 따라서, 본 연구를 통해 확인된 적하수오 40% 에탄올 추출물의 항산화 활성 및 뇌 신경세포 보호 효과는 적하수오 40% 에탄올 추출물에 함유되어 있는 주요 생리활성 물질인 TSG에서 기인한 것으로 판단된다.
4. 요약
본 연구를 통해 적하수오(Polygonum multiflorum) 에탄올 추출물이 갖는 in vitro 항산화 활성 및 뇌 신경세포 보호 효과를 확인하고자 하였다. 적하수오 0%, 20%, 40%, 60%, 80% 및 95% 에탄올 추출물 중 40% 에탄올 추출물이 다른 추출물에 비해 상대적으로 많은 총페놀성 화합물 및 총플라보노이드 함량을 나타냈으며, 적하수오 40% 에탄올 추출물은 우수한 ABTS 라디칼 소거 활성과 MDA 생성 억제 효과를 나타내었다. 특히, 40% 에탄올 추출물은 높은 α-glucosidase 및 acetylcholinesterase (AChE) 억제 활성을 나타내었다. 또한, 적하수오 40% 에탄올 추출물은 H2O2 유도 HT22와 SK-N-MC 세포에서 세포 생존율을 증가시키고 세포 내 산화적 스트레스를 감소시킴으로써 효과적인 세포 보호 효과를 나타냈다. 마지막으로, HPLC 분석 결과 적하수오 40% 에탄올 추출물의 주요 생리활성 물질은 2,3,5,4’-tetrahydroxystilbene-2-Ο-beta-D-glucoside(TSG)로 확인되었다. 따라서, 본 연구에서 나타난 적하수오의 항산화 활성 및 뇌 신경세포 보호 효과는 TSG를 포함한 다양한 생리활성 물질에서 기인한 것으로 판단되며, 건강기능식품에 소재로서의 활용 가능성이 기대된다.











