Research Article
만성 알코올 처리 쥐에 대한 헛개나무 열매 농축액을 함유한 콩나물 혼합물의 숙취해소 및 간 기능 개선 효과
허지안1
,
민혜지1
,
박울림1
,
김정호2
,
원영선3
,
서권일1,*
Effects of a soybean sprouts mixture containing Hovenia dulcis Thunb. fruit concentrate on hangover relief and liver function improvement in chronically alcohol-treated rats
Ji-An Heo1
,
Hye-Ji Min1
,
Wool-Lim Park1
,
Jeong-Ho Kim2
,
Yeong-Seon Won3
,
Kwon-Il Seo1,*
Author Information & Copyright ▼
1Department of Food Biotechnology, Dong-A University, Busan 49315, Korea
2Suncheon Research Center for Bio Health Care, Suncheon 57922, Korea
3HONAM National Institute of Biological Resources (HNIBR), Mokpo 58762, Korea
*Corresponding author Kwon-Il Seo, Tel: +82-51-200-7565, E-mail:
kseo@dau.ac.kr
Citation: Heo JA, Min HJ, Park WL, Kim JH, Won YS, Seo KI. Effects of a soybean sprouts mixture containing Hovenia dulcis Thunb. fruit concentrate on hangover relief and liver function improvement in chronically alcohol-treated rats. Food Sci. Preserv., 31(3), 486-498 (2024)
Copyright © The Korean Society of Food Preservation. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Feb 22, 2024; Revised: May 22, 2024; Accepted: May 22, 2024
Published Online: Jun 30, 2024
Abstract
This study examined the effects of a soybean sprouts mixture containing 1.5% Hovenia dulcis Thunb. fruit concentrate (SHM) on relieving hangovers and improving liver function in chronically alcohol-treated rats. The ampelopsin and L-asparagine contents in the SHM were 10.52, 35.19 ppm. When chronic alcohol-induced rats were treated with SHM, the body weight increased and the liver weight decreased. The serum alcohol and acetaldehyde concentrations were lowest in the SHM group, and the hepatic ADH and ALDH activities were highest in the SHM group. Chronic alcohol induction increased the activity of liver function indicator enzymes such as ALT, AST, and GGT, but the activity was decreased significantly with the SHM treatment. The triglyceride content in hepatic and serum blood samples was lowest in the SHM group. The serum total cholesterol and LDL cholesterol contents decreased in the SHM group, and the HDL cholesterol content increased. The color of the hepatic observed morphologically in the SHM group was reddish brown, and the size and number of lipid droplets in the hepatic observed pathologically decreased. The hepatic and serum lipid peroxidation content of the SHM group decreased. The hepatic and serum GSH content increased in the SHM group. Therefore, SHM can be a functional food that can help hangovers and improve liver function.
Keywords: soybean sprouts; Hovenia dulcis Thunb.; alcohol; lipid accumulation; oxidative stress
1. 서론
알코올은 의식, 축제 등 인류의 생활과 밀접한 관계가 있는 기호식품이나 섭취 시 간을 비롯한 각종 장기들에 간접 및 직접적으로 영향을 미쳐 대사작용 및 기질적인 변화를 일으킨다고 알려져 있다(Jung, 1991; Lee 등, 2000). 알코올이 체내로 들어와 흡수되기 시작하면 간에서 alcohol dehydrogenase (ADH)에 의해 acetaldehyde로 분해되고, 분해된 acetaldehyde는 다시 acetaldehyde dehydrogenase (ALDH)에 의해 무독성인 acetic acid로 분해되어 acetaldehyde 축적 및 그에 따른 부작용을 방지할 수 있다(Kim, 1999). 그러나 알코올을 과하게 섭취하거나 만성적으로 섭취하게 되면 독성이 강한 acetaldehyde가 간에 축적되면서 활성산소종이 증가하여 숙취가 발생하고 대사기능에 장애가 올 뿐 만 아니라 지방산 및 중성지방의 합성이 증가함으로써 알코올성 지방간과 같은 간 질환을 초래한다(Jung, 1991; Lieber, 2003; Liu, 2014; Umulis 등, 2005). 이에 숙취제거 및 간 손상 억제에 대한 관심이 꾸준히 증가하고 있는 추세이다.
콩은 만주지방이 원산지로 삼국시대부터 전국적으로 재배되었고, 단백질 함량이 높으며, saponin, pinitol, isoflavone 등 다양한 생리활성물질이 함유되어 있다(Shon 등, 2009). 이러한 콩의 발아로 얻어지는 콩나물은 생육기간이 짧고, 장소 및 계절에 상관없이 쉽게 재배할 수 있다는 장점이 있으며, 발아과정에서 retinol, riboflavin, thiamin, carotene 및 ascorbic acid 등 비타민 함량이 증가하는 것으로 알려져 있다(Kim 등, 2002; Kim 등, 2002). 또한, 콩나물은 숙취해독에 탁월한 효과를 지닌 asparagine을 함유하고 있어 nicotinamide adenine dinucleotide (NAD)를 생성하여 ADH의 합성을 촉진시킴으로 체내에 흡수된 ethanol이 acetate로 분해되는 것을 도와준다(Jeong 등, 2008; Park, 1994). 이에 콩나물에 관한 선행연구들로는 고농도 산소수로 재배한 콩나물 추출 음료의 알코올 분해 효능(Sung 등, 2014), 알코올 투여한 흰쥐 간세포내 알코올 탈수소효소에 미치는 콩나물 추출물의 영향(Cho 등, 2001) 등과 같이 급성 알코올 분해 효능에 관한 연구가 많았으나, 만성 알코올 숙취해소 및 간 기능 개선 효과에 대한 자료가 부족하여 연구가 필요한 실정이다.
헛개나무(Hovenia dulcis Thunb.)는 갈매나무과의 교목으로 높이는 10-17 m이며, 수피는 흑회색을 띤다(Park과 Chang, 2007). 헛개나무의 줄기 및 잎에는 3-methoxy-4-hydroxybenzoic acid 및 3-methoxy-4-hydroxycinnamic acid와 같은 성분이 함유되어 있어 항산화 및 항균작용을 나타낸다고 보고되고 있다(Cho 등, 2000). 또한, 은은한 향기와 단맛이 나는 지름 8 mm 정도의 닭 발톱모양을 한 헛개나무의 열매는 지구자라고도 불리며 amepelopsin과 같은 알코올 분해 효능이 탁월한 성분을 함유하고 있어 체내 알코올 대사물질 분해를 촉진하고, acetaldehyde의 축적을 억제시켜 숙취해소에 효과적일 뿐 아니라 알코올성 간 손상을 막고, 간 기능 개선에도 도움이 되는 것으로 알려져 있다(Kim 등, 2006; Park 등, 2006). 이와 같이 헛개의 기능성에 대한 다양한 연구가 지속적으로 보고되고 있으나 다른 식품소재와의 혼합 및 이의 기능성에 대한 연구는 미비한 실정이다.
현대사회는 1인 가구 및 맞벌이 부부 증가 등 사회 구조적, 문화적 변화에 의해 시간 절약 및 간편함과 같은 식생활 문화를 추구하여 높은 편의성을 가지는 가정간편식(home meal replacement, HMR)이 각광받고 있다(Jeong 등, 2021; Kim과 Chun, 2021). 과거 ‘인스턴트 식품’이라 불리며 편의성을 맞추어 개발된 제품들에 맛과 영양이 더해지며 가정간편식 시장은 2018년에 비해 2020년 22%가 증가하였고, 매해 10%씩 꾸준히 증가하는 추세이다(aT, 2022; Lee, 2017). 이에 닭 육수(Kim 등, 2010), 바지락 육수(Choi 등, 2014), 대게 육수(Bae 등, 2007) 등 다양한 재료를 활용한 간편식 육수 제조 연구가 진행되고 있다. 특히 항산화 효능이 있는 표고버섯 첨가 복어 육수(Kim 등, 2017), 토마토 및 한약재 첨가 냉면 육수(Kim 등, 2018) 등의 연구가 보고되어 있으나 다양한 기능성을 겸비한 육수에 대한 연구는 부족하여 개발이 필요할 것으로 판단된다.
따라서 본 연구에서는 식생활 문화 트렌드에 맞춰 가정에서 간편하게 육수처럼 사용할 수 있도록 부재료들과 콩나물을 혼합한 HMR형 콩나물 혼합물을 제조한 후 헛개나무 열매 농축액을 첨가하여 숙취해소 및 간 기능 개선 효능을 검증함으로써 편의성 및 기능성이 증진된 식품 개발의 기초자료로 제공하고자 하였다.
2. 재료 및 방법
2.1. 혼합물 제조
본 연구에 사용된 다시마, 건표고버섯, 바지락살, 키조개관자, 홍합살, 대파, 무, 양파, 천일염 및 콩나물은 부산시 사상구 소재에 있는 대형마트에서 국내산 원료들로 구입하여 사용하였으며, 60 °Brix 헛개나무 열매 농축액은 ㈜힘찬걸음(Iksan, Korea)에서 중국산 원료로 생산된 제품을 구입하여 4°C에 냉장 보관하면서 시료로 사용하였다. 콩나물 혼합물의 부재료 혼합물을 제조하기 위한 재료 배합비는 Table 1과 같으며, Heo 등(2023)의 방법에 따라 제조하였다. 100°C 끓는 정제수에 다시마, 건표고버섯을 넣고 1분간 추출 후 다시마를 제거하였다. 그 후 바지락살, 키조개관자, 홍합살을 넣어 2시간 동안 추출하고, 대파, 무, 양파, 천일염을 넣고 35분간 추출하고 여과하였다. 이렇게 제조된 부재료 혼합물 67%에 콩나물 33%를 첨가(w/w)하여 20분간 추출 후 여과를 통해 고형물을 제거하고 콩나물 혼합물(SM)을 얻었다. 60 °Brix 헛개나무 열매 농축액 1.5%와 정제수를 혼합(w/v)하여 헛개나무 열매 혼합물(HM) 및 SM에 60 °Brix 헛개나무 열매 농축액 1.5%를 첨가(w/v)하여 헛개나무 열매 농축액을 함유한 콩나물 혼합물(SHM)을 얻었으며, HM 및 SHM에 사용된 60 °Brix 헛개나무 열매 농축액 1.5%는 Park 등(2023)의 방법에 준하여 국내에서 시판되는 숙취해소 음료 제품에 함유된 헛개나무 열매 농축액 함량을 고려하여 설정하였다.
Table 1.
Composition of soybean sprouts mixture sub-materials
| Component |
Sub-materials (1,000 mL) |
| Mixture ratio (%) |
Quantity (g) |
| Water |
85.63 |
856.3 |
| Kelp |
0.1 |
1 |
| Shiitake |
0.07 |
0.7 |
| Manila clam |
7 |
70 |
| Pen sell adductor |
2 |
20 |
| Mussel |
2 |
20 |
| Large green onion |
1.2 |
12 |
| Daikon |
1 |
10 |
| Onion |
0.8 |
8 |
| Bay salt |
0.2 |
2 |
Download Excel Table
2.2. 지표성분 분석
지표성분을 측정하기 위하여 SM, HM 및 SHM을 0.45 μm syringe filter(Pall Corp., Port Washington, NY, USA)로 여과한 후 각 시료를 10 μL씩 주입하여 high-performance liquid chromatography-photodiode array(HPLC-PDA, Shimadzu Co., Kyoto, Japan)를 사용하여 분석하였다. Ampelopsin은 C18 (4.6×250 mm, 5 μm) column을 사용했으며, 30°C 온도에서 UV-290 nm 파장으로 검출하였다. 이동상은 A 용매(0.05% phosphoric acid)와 B 용매(ACN)로 구성하여 1 mL/min의 유속으로 A: 95%, 0-4분; A: 95-50%, 4-10분; A: 50-10%, 10-20분; A: 10-50%, 20-22분; A: 50-95%, 22-23분; A: 95%, 30분으로 분석을 진행하였다. L-asparagine은 C18(4.6×250 mm, 5 μm) column을 사용했으며, 30°C 온도에서 UV-190 nm 파장으로 검출하였고, 이동상은 A 용매(0.05% phosphoric acid)와 B 용매(ACN)로 1 mL/min의 유속으로 A: 95%, 0-10분; A: 50%, 10-12분; A: 95%, 12-15분으로 분석을 진행하였다. 지표물질로 사용된 ampelopsin 및 L-asparagine은 Chem Faces Co., Ltd.(Wuhan, China)에서 구입하였다.
2.3. 동물실험
실험동물은 5주령 Sprague-Dawley 수컷 흰쥐 36마리를 효창 사이언스(Daegu, Korea)로부터 구입하였으며, 동아대학교 동물실험 윤리심의 위원회의 사전 승인(DIACUC-20-19)을 받아 동물실험을 진행하였다. 동물 사육은 온도(22±2°C), 습도(50±5%) 및 12시간의 명암주기로 조건을 일정하게 유지하였고, 물과 식이를 자유 급여한 후 사용하였다. 실험군들을 난괴법에 따라 6마리씩 배정하였으며, 아무것도 처리하지 않은 정상군(N), 알코올 단독 투여군(C), 실리마린 투여군(PC), 콩나물 혼합물군(SM), 헛개나무 열매 혼합물군(HM) 및 헛개나무 열매 농축액을 함유한 콩나물 혼합물군(SHM)으로 나누었다. N을 제외한 나머지 군들은 6주간 물 대신 알코올을 섭취하게 하였고, 이때 알코올에 의한 급성 독성을 방지하기 위하여 각 일주일간 10, 20% 알코올을 급여했으며, 나머지 4주 동안은 30%의 농도로 알코올을 급여했다. 30% 알코올 급여 시 각 시료들은 성인의 1회 섭취량을 고려하여 체중 kg당 7 mL씩 경구 투여를 통해 주입하였고, 양성 대조군으로 사용된 실리마린은 성인기준 일일 권장량을 고려하였을 때 체중 kg당 50 mg의 농도로 처리시 간 손상으로부터 보호 효과가 있는 것으로 보고된 바 있어 이에 본 연구에서도 50 mg/kg의 농도로 실리마린을 투여하였다(Clichici 등, 2015; Shaker 등, 2011). 실험동물은 12시간 절식 후 ethyl ether로 마취시켜 희생시켰으며, 하대정맥에서 공복 혈액을 채취하였다. 채취한 혈액은 상온에서 방치한 후 10,000 ×g로 10분간 원심분리하여 혈청을 분리하였으며, 장기 조직은 혈액을 채취한 다음 즉시 적출하여 식염수로 여러 차례 헹군 후 실험에 사용해주었고, 모든 샘플은 −80°C에 냉동 보관하였다.
2.4. Alcohol 및 acetaldehyde 농도 측정
혈중 alcohol 및 acetaldehyde 농도는 혈청 분리 후 즉시 시판용 ethanol 분석 kit(K-ETOHLQR, Megazyme Ltd., Bray, Ireland) 및 acetaldehyde 분석 kit(K-ACHYD, Megazyme Ltd.)를 사용하여 측정하였다.
2.5. ADH 및 ALDH 활성 측정
1× PBS 500 μL에 간 조직 100 mg을 첨가하여 균질화하고 13,000 ×g로 10분간 원심분리 하였다. 이후 상층액을 취하여 ADH 분석 kit(K787, Bioviosion Inc., Milpitas, CA, USA) 및 ALDH 분석 kit(K731, Bioviosion Inc.)로 측정하였다.
2.6. 간 기능 지표 효소 활성 변화 및 지질 농도 측정
혈중 alanine aminotransferase(ALT), aspartate aminotransferase (AST) 및 gamma-glutamyl transferase(GGT) 분석과 triglyceride, low-density lipoprotein(LDL) cholesterol 및 high-density lipoprotein(HDL) cholesterol의 농도는 전문 분석 기관인 Southeast Medi-Chem Institute(Busan, Korea)에 측정을 맡겼으며, 혈중 total cholesterol(E-BC-K109, Elabscience Biotechnology Inc., Huston, Tx, USA)및 간 조직 triglyceride(E-BC-K238, Elabscience Biotechnology Inc.)의 함량 측정은 시판용 kit로 진행하였다.
2.7. 지질 과산화 농도 측정
간 조직 시료는 300 μL malondialdehyde(MDA) lysis buffer에 간 조직 10 mg을 첨가하여 균질화시킨 후 10분간 13,000 ×g로 원심분리 하여 상층액을 사용하였다. 혈청 시료는 혈청 20 μL에 42 mM sulfuric acid(Daejung, Seoul, Korea) 500 ¼L 및 phosphotungastic acid solution 125 ¼L와 혼합하여 5분간 실온에서 방치하였다. 그 후 13,000 ×g로 원심분리하고 상등액을 제거하였으며, 얼음 위에서 수집된 pellet을 butylated hydroxytoluene 2 ¼L가 포함된 DW 100 ¼L로 재현탁하였다. 간 조직 및 혈중 지질 과산화 농도 측정은 MDA 분석 kit (K739, Bioviosion Inc.)로 측정하였다.
2.8. Glutathione(GSH) 함량 측정
간 조직 시료는 0.05 g의 간 조직을 단백질 침전제에 첨가하여 균질화하고 10,000 ×g로 10분간 원심분리하여 상등액을 사용하였다. 혈청 시료는 혈청 100 ¼L에 단백질 침전제 400 ¼L를 첨가하여 30초간 vortex한 뒤 4°C에서 5분간 방치하였고, 10,000 ×g로 10분간 원심분리하여 상등액을 취해 간 조직 및 혈중 GSH 분석 kit(E-BC-K097, Elabscience Biotechnology Inc.)로 측정하였다.
2.9. 간 조직 병리학적 관찰
적출한 간 조직을 phosphate buffered saline 용액으로 세척하여 일부분을 취하고, 4% formalin 용액(Junsei Chemical Co., Ltd., Tokyo, Japan)에 고정시킨 후 4 ¼m 크기로 잘라 hematoxylin and eosin(H&E)으로 염색하여 광학현미경(Olympus BX41, Olympus Co., Tokyo, Japan)을 통해 관찰하였다.
2.10. 통계처리
통계분석은 각 시료의 유의적인 변화를 one-way ANOVA 검정에 의한 평균과 표준편차(±SD)로 표시하였으며, 각 시료의 통계적 유의성에 대한 검증은 Statistical Analysis System (Software 9.4, SAS institute Inc., Cary, NC, USA)를 사용하여 Duncan’s multiple range test로 나타냈다(p<0.05).
3. 결과 및 고찰
3.1. 지표성분 확인
Ampelopsin은 acetaldehyde와 같은 알코올 대사물질의 잔류를 억제하여 숙취해소 및 간 독소 해소에 도움을 준다(Kim과 Lee, 2011; Kwon 등, 2020; Na 등, 2013). Ampelopsin 함량을 분석한 결과는 Fig. 1과 같다. SM군, HM군 및 SHM군은 각각 1.95, 10.22, 10.52 ppm으로 나타났으며, HM군 및 SHM군이 SM군보다 높은 함량의 ampelopsin을 함유하고 있는 것으로 확인되었다. Kim 등(2008)은 flavonoid 계열의 ampelopsin이 헛개나무 열매의 유효성분 중 하나라고 보고한 바 있다. Asparagine은 NAD+를 보충함으로써 체내에 흡수된 알코올이 acetate로 분해되는 것을 도와 숙취에 이르지 않도록 작용한다(Park, 1993; Park 등, 1994). L-asapargine 함량을 측정한 결과, SM군 및 SHM군에서는 35.64, 35.19 ppm으로 나타났으나 HM군에서는 검출되지 않았다(Fig. 2). Sung 등(2014)은 asparagine이 콩나물의 주요 유리아미노산이라고 보고하였다. 본 연구에서 ampelopsin의 함량은 SM군보다 HM군 및 SHM군에서 증가한 수치를 보였으며, L-asparagine의 함량은 HM군을 제외한 SM군 및 SHM군에서 검출되었다. 이는 ampelopsin을 유효성분으로 가지는 헛개나무 열매와 asparagine을 유효성분으로 가지는 콩나물의 첨가 유무로 인해 지표성분의 함량에 차이가 나타나는 것으로 사료되며, ampelopsin 및 L-asparagine을 함유한 SHM군에서 숙취해소 및 간 독성 저해 효능을 상승시킬 것으로 판단된다.
Fig. 1.
Ampelopsin in SHM analyzed by HPLC.
(A) Ampelopsin: standard compound, (B) SM: soybean sprouts mixture, (C) HM: Hovenia dulcis Thunb. fruit mixture, and (D) SHM: soybean sprouts mixture containing Hovenia dulcis Thunb. fruit concentrate.
Download Original Figure
Fig. 2.
L-Asparagine in SHM analyzed by HPLC.
(A) L-asparagine: standard compound, (B) SM: soybean sprouts mixture, (C) HM: Hovenia dulcis Thunb. fruit mixture, and (D) SHM: soybean sprouts mixture containing Hovenia dulcis Thunb. fruit concentrate.
Download Original Figure
3.2. 체중, 간 중량 및 식수 섭취량
만성 알코올 유도 흰쥐의 체중, 간 중량 및 식수 섭취량은 Table 2에 나타냈다. SM군, HM군 및 SHM군 모두 초기 무게 및 식수 섭취량에서는 각 실험군 간의 변화가 관찰되지 않았으나, 후기 무게 및 체중 증가량에서 C군보다 SM군, HM군 및 SHM군에서 체중 증가가 나타났다. 또한, 간 중량은 C군에서 가장 증가한 것을 확인할 수 있었고, C군을 제외한 나머지군에서는 유의적인 차이가 나타나지 않았다. Faulkner 등(1969)은 알코올이 소장에서 영양소 및 식이성분 흡수를 방해하여 영양 불균형을 초래하기 때문에 체중의 감소가 일어난다고 보고하였으며, Kim 등(2022)은 알코올 섭취가 지방생성 유전자의 발현을 증가시켜 간 조직 내 중성지방 축적을 야기하므로 간의 무게가 증가한다고 보고하였다. 또한, Kim과 Lee(2007)은 콩나물 분말이 알코올 유도로 감소된 흰쥐의 체중을 증가시켰으며, 증가된 간 무게를 감소하였다고 보고하였고, Hong 등(2015)은 알코올성 간 손상 동물 모델에서 간 무게가 증가하였지만, 헛개나무과병 추출 분말 투여 시 간 무게를 유의적으로 감소하였다고 보고하였다. 본 연구에서도 정상군에 비해 만성 알코올을 유도한 모든 군에서 후기 무게 및 체중 증가량이 감소하였으며, 간 중량이 증가하였다. 그러나 SM 및 HM를 투여하자 이러한 증상들이 완화되었으며, 특히 SHM 섭취 시 후기 무게 및 체중 증가량이 유의적으로 증가하였고, 간 중량이 감소하였다. 이는 헛개나무 열매 및 콩나물의 단독 처리보다 이들을 혼합하였을 때 시너지 효과로 인해 영양소 및 식이성분의 흡수가 원활하며, 중성지방 축적을 억제하는 효과가 증가된 것으로 사료된다.
Table 2.
Effects of SHM on body, liver weight and water consumption in chronically alcohol-treated rats
|
|
N1) |
C |
PC |
SM |
HM |
SHM |
| Body weight (g) |
| Initial |
254.50±5.362)a3) |
253.75±13.74a |
253.67±17.76a |
255.17±11.54a |
254.17±15.87a |
254.33±1.75a |
| Final |
434.50±32.40a |
353.75±21.70c |
371.33±30.14bc |
364.50±31.51bc |
369.80±30.11bc |
393.58±17.57b |
| Weight gain |
180.00±32.49a |
100.00±24.00c |
117.67±25.26bc |
109.33±33.98bc |
118.80±22.76bc |
139.25±18.72b |
| Liver weight (g) |
10.63±0.46b |
12.93±0.48a |
10.91±0.36b |
11.10±1.10b |
11.22±0.50b |
10.67±0.23b |
| Water consumption (mL/day) |
46.69±8.33a |
42.16±12.20a |
40.13±14.17a |
45.79±14.09a |
42.63±11.94a |
41.79±11.14a |
Download Excel Table
3.3. 알코올 대사
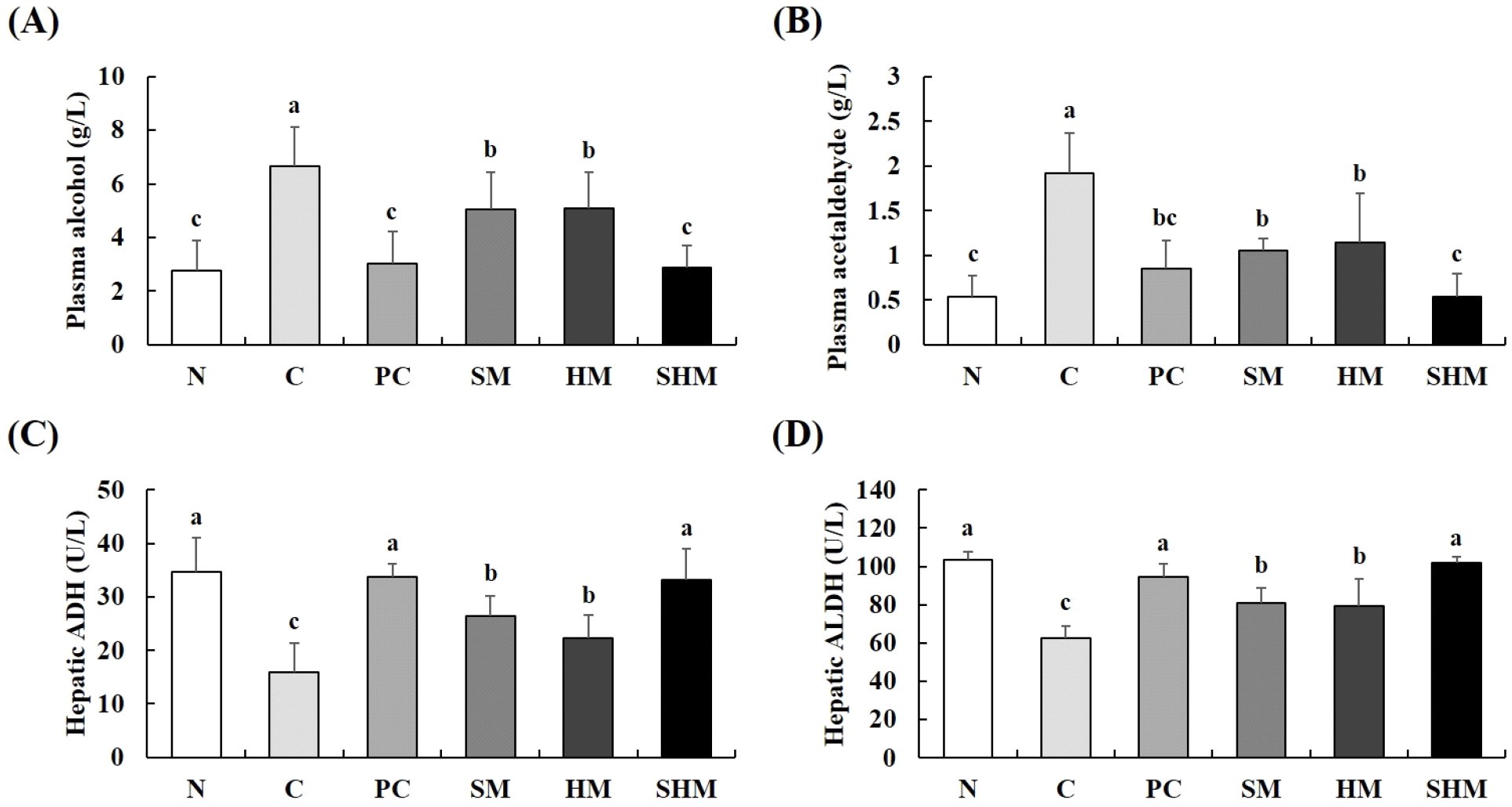
알코올은 간에서 ADH에 의해 acetaldehyde로 분해되고, acetaldehyde는 ALDH에 의해 분해되는데, 과도한 음주 및 만성적인 음주 섭취 시 acetaldehyde가 축적되어 간 독성 유발뿐 아니라 두통, 메스꺼움 및 구토 등 숙취 증상을 야기한다(Tuma와 Casey, 2003). 만성 알코올 유도 흰쥐의 알코올 분해능을 확인하고자 혈중 alcohol, acetaldehyde 농도 및 간 조직에서 ADH, ALDH 효소 활성을 확인하였다(Fig. 3). SHM군의 혈중 alcohol 및 acetaldehyde 농도는 각각 2.89, 0.53 g/L를 나타냈으며, C군보다 56.61, 72.40%, SM군보다 42.77, 50.00% 및 HM군보다 43.00, 53.51% 감소하였다(Fig. 3A와 3B). 간 조직 ADH, ALDH 활성은 C군에서 15.85, 62.33 U/L로 가장 낮은 값을 보였고, C군과 비교했을 때 SM군에서 67.26, 29.84%, HM군에서 40.63, 27.39% 및 SHM군에서 108.90, 63.74% 유의적으로 증가하는 것을 관찰할 수 있었다(Fig. 3C와 3D). Crabtree와 Newsholme(1972)은 콩나물에 들어있는 aspartic acid와 alanine이 ADH의 활성을 높여 알코올 분해를 촉진시키고, asparagine이 acetaldehyde의 독성을 약화시킨다고 보고하였으며, Shen 등(2012)은 헛개나무 열매에 함유되어 있는 ampelopsin이 체내 알코올 분해 대사율을 증가시킬 수 있는 물질임을 밝힌 바 있다. 종합적으로, SM군, HM군에서 혈중 alcohol 및 acetaldehyde의 농도가 감소하고, 간 조직 ADH 및 ALDH의 활성이 증가하였다. 또한, SHM군에서 SM군 및 HM군보다 혈중 alcohol 및 acetaldehyde 농도가 유의적으로 감소하였으며, 간 조직 ADH 및 ALDH의 활성이 증가한 것으로 보아 콩나물과 헛개나무 열매 유효성분들의 시너지 효과에 의한 것으로 판단되며, SHM군의 체내 알코올 분해 및 숙취해소 효능이 뛰어남으로 SHM은 알코올 대사능이 뛰어난 것으로 사료된다.
Fig. 3.
Effects of SHM on (A) plasma alcohol, (B) plasma acetaldehyde, (C) hepatic alcohol dehydrogenase, and (D) hepatic acetaldehyde dehydrogenase concentrations in chronically alcohol-treated rats.
All values are mean±SD (n=6). Different superscript letters (a-c) on the bars indicate significant differences (p<0.05) by Duncan’s multiple range test. N, normal; C, control (alcohol); PC, positive control (silymarin); SM, soybean sprouts mixture; HM, Hovenia dulcis Thunb. fruit mixture; SHM, soybean sprouts mixture containing Hovenia dulcis Thunb. fruit concentrate.
Download Original Figure
3.4. 간 기능 지표 효소 활성 변화
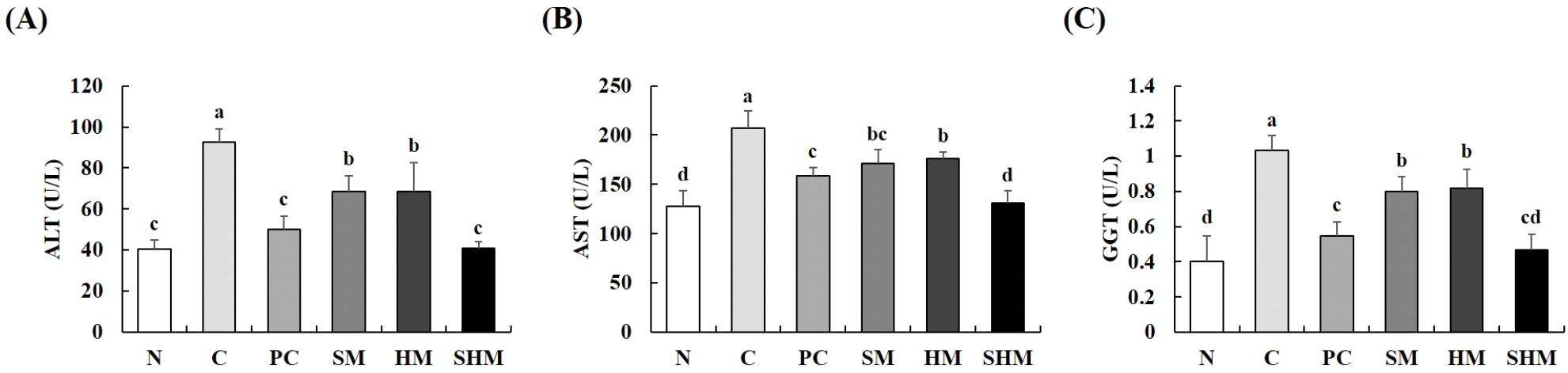
ALT, AST는 간 세포 내에 존재하는 효소이며 간이 손상될 때 혈중으로 유출되어 간 손상 지표로 사용되고 있다(Coudray 등, 1993). GGT는 여러 기관 세포 외막에 위치하는 효소로 세포 내 GSH 농도를 높게 유지하여 항산화 작용에 중요한 역할을 하는데, 과도한 alcohol 섭취 시 GSH의 농도가 떨어지게 되고 이로 인해 산화적 스트레스가 유도되면서 GGT가 증가하게 되어 산화적 스트레스 지표 또는 간 손상 지표 중 하나로 알려져 있다(Jung과 Chae, 2018; Noh 등, 2015; Qian 등, 2011). Fig. 4에서는 만성 알코올을 유도한 흰쥐의 혈중 간 기능 지표 효소 ALT, AST 및 GGT의 활성 변화를 확인하였다. 알코올을 투여한 C군은 정상군인 N군에 비해 ALT, AST 및 GGT의 활성이 127.44, 62.75, 157.50% 현저히 증가한 것을 확인할 수 있었다. 그러나 C군에 비해 SM군의 ALT, AST 및 GGT의 함량이 25.95, 17.67, 22.33%, HM 투여시 25.76, 15.26, 20.39% 그리고 SHM 섭취 시 55.68, 36.95, 54.37% 감소하였으며, 특히 SHM군은 SM군 및 HM군과 비교하였을 때 유의적인 차이를 나타냈다. Sung 등(2014)은 콩나물 추출 음료가 알코올 유도 흰쥐의 ALT 및 AST의 농도를 감소시키며, Li 등(2008)은 알코올 유도 쥐의 혈청 효소(AST 및 ALT)의 활성이 증가하였지만 asparagine이 19% 함유된 sericin 처리시 ALT 및 AST 수준이 정상군과 유사한 수준으로 감소하였다고 보고하였다. 또한 Ko 등(2006)은 헛개나무 열매를 주성분으로 한 혼합물이 장기간 알코올 투여 쥐 모델에 간 보호 효능을 통해 ALT, AST 및 GGT의 활성을 저해한다고 보고하였고, Silva 등(2020)은 ampelopsin에 의해 알코올을 섭취한 쥐의 ALT 및 AST의 활성이 크게 감소하였다고 보고한 바 있다. 이와 같은 결과는 SM군 및 HM군에 의해 ALT, AST 및 GGT의 활성이 감소한 본 연구 결과와 일치하였으며, SM군 및 HM군 단독 투여보다 이들을 병용한 SHM군에서 N군만큼 ALT, AST 및 GGT의 활성을 저해시키는 것으로 확인되었다. 이는 SHM 내 ampelopsin 및 asparagine과 같은 생리활성 물질에 의한 것으로 사료되며, 효과적인 알코올성 간 손상 보호효과를 갖는 것으로 판단된다.
Fig. 4.
Effects of SHM on (A) alanine aminotransferase, (B) aspartate aminotransferase, and (C) gamma-glutamyl transferase levels in plasma in chronically alcohol-treated rats.
All values are mean±SD (n=6). Different superscript letters (a-d) on the bars indicate significant differences (p<0.05) by Duncan’s multiple range test. N, normal; C, control (alcohol); PC, positive control (silymarin); SM, soybean sprouts mixture; HM, Hovenia dulcis Thunb. fruit mixture; SHM, soybean sprouts mixture containing Hovenia dulcis Thunb. fruit concentrate.
Download Original Figure
3.5. 지질 대사
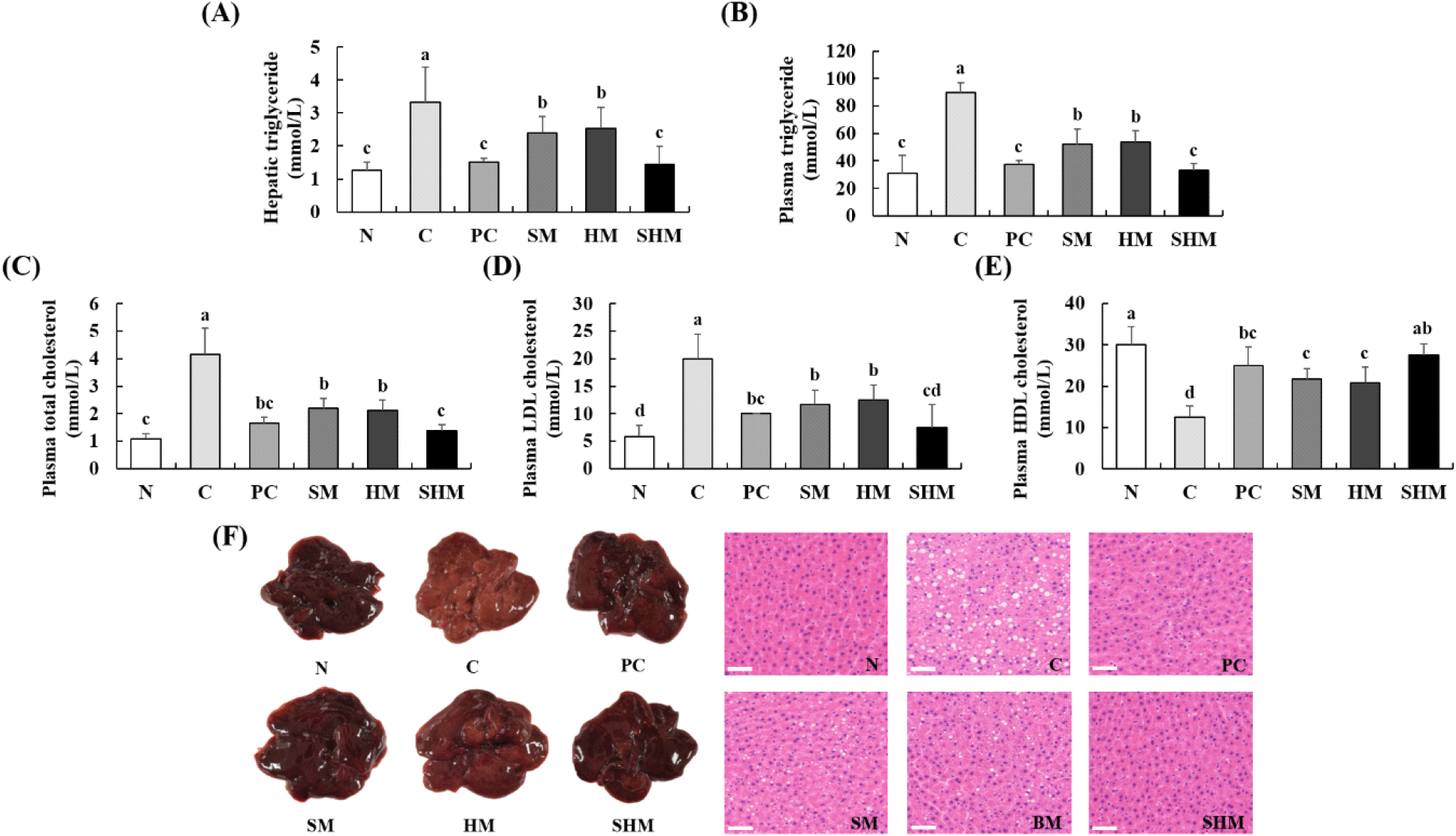
만성적인 알코올 섭취는 간에서 지방산 합성을 촉진하여 알코올성 지방간을 유발하며, 간으로부터 혈류로 방출되는 지질의 양을 증가시킴으로써 혈중 지질의 수준을 상승시킨다(Lee와 Chyun, 2009). 만성 알코올 유도 흰쥐의 간 조직 및 혈중 지질 함량 변화를 확인한 결과는 Fig. 5와 같다. 간 조직 및 혈중 triglyceride의 함량은 N군(1.26, 30.83 mmol/L)과 C군(3.32, 90.00 mmol/L)에서 유의적인 차이가 나타났다. SM군에서는 2.40, 52.50 mmol/L, HM군에서는 2.53, 53.67 mmol/L로 C군에 비해 감소하였으며, SHM군에서는 1.45, 33.00 mmol/L로 N군과 유사한 값을 나타냈다(Fig. 5A와 5B). 혈중 total cholesterol의 함량은 N군에서 1.08 mmol/L로 나타났으며 C군에서는 4.15 mmol/L로 증가하는 경향을 나타냈고, PC군, SM군, HM군 및 SHM군에서는 1.65, 2.19, 2.12 및 1.39 mmol/L로 C군에 비해 total cholesterol 함량이 감소하였다(Fig. 5C). 혈중 LDL cholesterol을 측정한 결과 C군이 20.00 mg/dL로 가장 높은 함량을 나타냈으나, SM군, HM군 및 SHM군에서 각각 41.65, 37.50, 62.50%로 감소하였다(Fig. 5D). 반면, 혈중 HDL cholesterol 함량은 C군에서 12.50 mg/dL로 가장 낮은 함량을 나타냈으며, SM군(21.67 mg/dL), HM군(20.83 mg/dL) 및 SHM군(27.50 mg/dL)에서 증가하는 경향을 나타냈다(Fig. 5E). 만성 알코올 섭취는 지방간을 유도하는데, 이는 간 손상의 초기단계이며 지방 방울의 수 및 부피가 증가하는 것으로 알려져 있다(Seong 등, 1985; Shon 등, 2007; Song 등, 2017). 이에 Fig. 5F에서 만성 알코올을 유도한 흰쥐의 간 손상 개선을 확인하고자 형태학적 및 병리학적 간 조직 변화를 확인한 결과 C군의 간 조직은 N군에 비해 형태학적 관찰에서 황갈색을 띠었으며, 병리학적 관찰에서는 지질방울의 크기 및 수가 증가한 것을 확인할 수 있었다. 그러나 SM군, HM군 및 SHM군의 형태학적 간 조직 관찰시 적갈색으로 개선되었으며, 병리학적으로 관찰한 간 조직에서는 지질방울 크기 및 수가 감소하였고, 특히 SHM군은 N군과 형태학적 및 병리학적 차이가 거의 관찰되지 않았다. 이러한 결과는 만성 알코올 투여 시 간 조직 및 혈중 중성지질 농도가 증가할 뿐 아니라 혈중 지질 농도에도 변화를 나타내며, 간 조직 내 지방구 수 및 크기를 증가시켜 알코올성 지방간을 유발한다고 밝혀진 연구와 유사한 경향을 나타냈다(Baraona와 Lieber, 1970; Kim과 Choi, 1994; Kim 등, 1999; Kim 등, 2018b; Lee와 Chyun, 2005). Kim과 Lee(2007)은 isoflavone을 함유한 콩나물 분말이 만성 알코올 유도로 증가된 흰쥐의 triglyceride 및 total cholesterol을 감소시켰으며, HDL cholesterol을 증가시켰다고 보고하였다. 또한, Kim 등(2016)은 만성 알코올에 의해 동물 모델에서 total cholesterol 및 triglyceride의 농도가 증가하였지만, 지구자 혼합물 처리시 total cholesterol 및 triglyceride의 농도가 유의적으로 감소하였다고 보고하였으며, Urena 등(2023)은 알코올 투여 쥐에 ampelopsin을 처리하자 LDL/VLDL의 비율이 감소하며, 간 조직 및 혈청 triglyceride가 감소하였다고 보고한 바 있다. 종합적으로 N군에 비해 만성 알코올을 투여한 C군에서 높은 간 조직 및 혈중 triglyceride, 혈중 total cholesterol 및 LDL cholesterol 함량을 나타냈으며, 낮은 HDL cholesterol 함량을 나타냈을 뿐만 아니라 간 조직의 지질방울 크기 및 수가 증가하였다. 그러나 SM, HM 및 SHM 처리시 이러한 증상들이 완화되었고, 특히 SHM군은 N군과 유사한 결과 값을 나타냈다. 이는 SHM 내 헛개나무 열매의 ampelopsin과 콩나물의 isoflavone 성분들의 시너지 효과로 인해 콩나물 및 헛개나무 열매를 단독 처리하였을 때보다 지질대사가 개선되며 간 기능 개선에 효과가 있을 것으로 추정된다.
Fig. 5.
Effects of SHM on hepatic triglyceride (A), plasma triglyceride (B), plasma total cholesterol (C), plasma low-density lipoprotein cholesterol (D), plasma high-density lipoprotein cholesterol concentrations (E), and hepatic morphology change and H&E staining images (F) in chronically alcohol-treated rats.
H&E, maginification ×30, scale bar 50 ¼m. All values are mean±SD (n=6). Different superscript letters (a-d) on the bars indicate significant differences (p<0.05) by Duncan’s multiple range test. N, normal; C, control (alcohol); PC, positive control (silymarin); SM, soybean sprouts mixture; HM, Hovenia dulcis Thunb. fruit mixture; SHM, soybean sprouts mixture containing Hovenia dulcis Thunb. fruit concentrate.
Download Original Figure
3.6. 항산화 활성
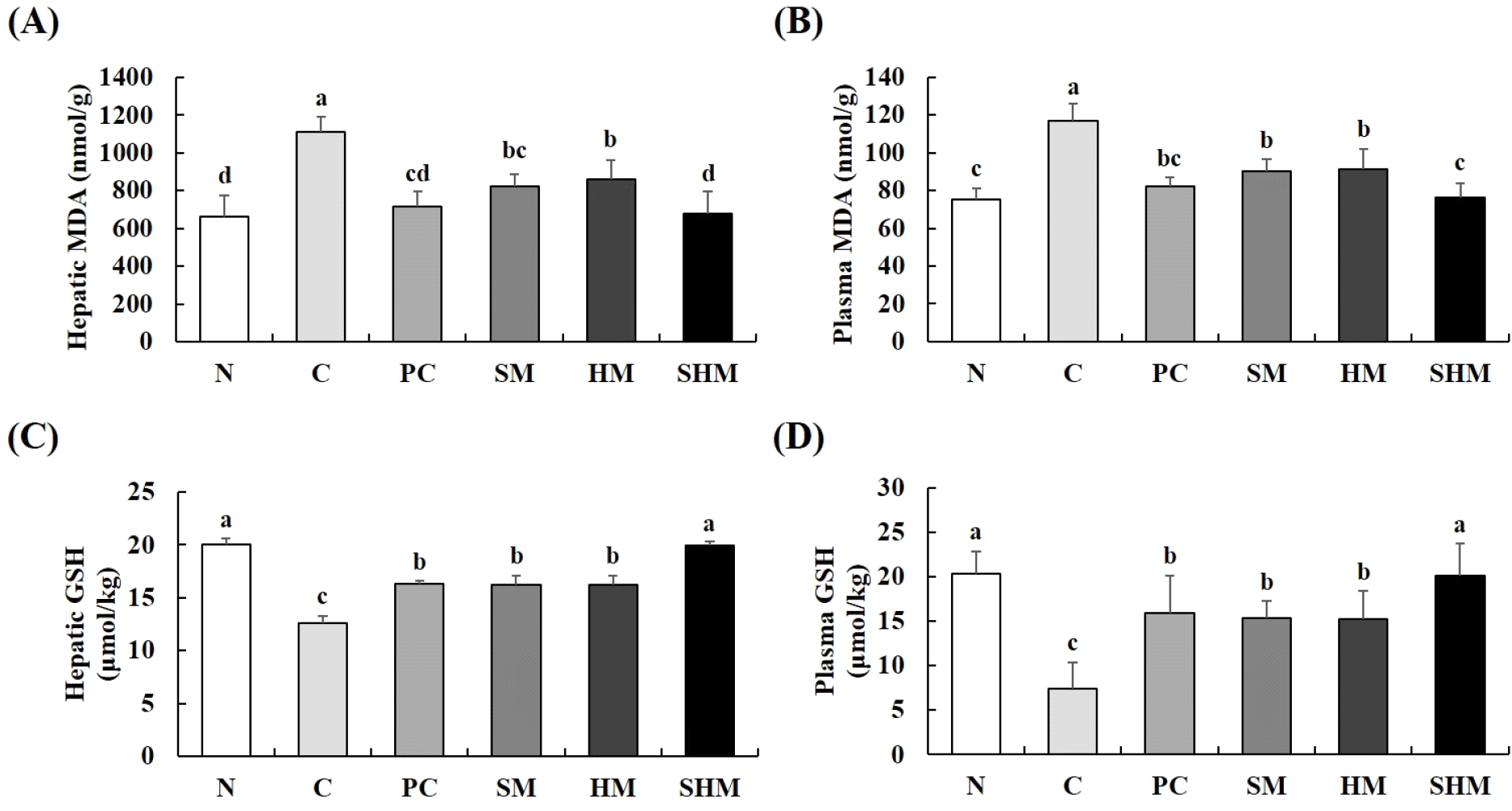
지질 과산화는 알코올 섭취로 인한 지방간 등 간 손상에 의해 체내 free radical 생성이 증가하며, 항산화능이 감소하여 발생하므로 ALT 및 AST와 같이 간 손상 지표로 사용되고 있다(Baldi 등, 1993, Li 등, 2008, Pulido 등, 2000). 만성 알코올 유도 흰쥐의 간 조직 및 혈중 지질 과산화 함량을 측정한 결과는 Fig. 6A와 6B에 나타냈다. 간 조직 및 혈중 지질 과산화 함량은 C군이 1,110.94, 116.73 mmol/g로 가장 높은 함량을 보였으며, SM군(823.52, 90.22 mmol/g), HM군(861.01, 91.26 mmol/g) 및 SHM군(677.68, 76.26 mmol/g)에서 감소하는 경향을 나타냈고, SHM군은 N군과 유사한 수치를 보였다. GSH는 간에서 생성되는 아미노산의 일종으로 산화적 손상을 방어하는 항산화 물질이다(Wu 등, 2004). 만성 알코올 유도 흰쥐의 간 조직 및 혈중 GSH 함량을 측정한 결과는 Fig. 6C와 6D와 같다. 간 조직 및 혈중 GSH는 N군에 비해 C군에서 각각 37.07, 63.82% 감소하였으며, 모든 군에서 가장 낮은 함량을 나타냈다. 반면, C군과 비교하였을 때 SM군 처리 시 28.42, 108.83%, HM군 처리시 28.35, 106.66% 및 SHM군 처리시 57.8, 172.83% 증가하였고, SHM군은 N군과 유사한 결과 값을 나타냈다. Lee 등(2009)에 따르면 알코올 투여 시 지질 과산화 함량이 증가하며, Kim 등(2020)은 알코올이 산화적 손상을 일으켜 GSH 함량을 감소시킨다고 보고하였다. 이는 본 연구의 C군에서 간 조직 및 혈중 지질 과산화 함량이 증가하고, GSH 함량이 감소한 것과 일치하는 경향을 나타냈다. Cho 등(2001)은 알코올을 투여한 흰쥐를 대상으로 알코올 단독투여군보다 콩나물 추출물군에서 지질 과산화 함량이 유의적으로 감소하였다고 보고하였으며, Kim과 Lee(2007)는 isoflavone 함량이 높은 콩나물이 에탄올 투여 흰쥐의 glutathione peroxidase 활성을 증가시켜 정상대조군과 유사한 높은 값을 나타냈다고 보고하였다. 또한, You 등(2009)은 지구자 알코올 추출물이 알코올 유도 마우스의 지질 과산화 함량을 감소시킬 뿐만 아니라 GSH의 함량을 증가시킨다고 보고하였고, Qiu 등(2017)은 ampelopsin 투여 만성 알코올 유도 쥐 모델의 간 조직 MDA 수치가 감소하였으며, 간 조직 GSH 함량이 증가한다고 보고한 바 있다. 이상의 결과들로 만성 알코올에 의해 지질 과산화 함량 증가, GSH 함량 감소가 나타났지만 SM군, HM군 및 SHM 투여 시 지질 과산화 함량이 감소하고, GSH 함량이 증가하였다. 또한, SM군 및 HM군보다 SHM군에서 지질 과산화 및 GSH의 함량이 유의적으로 개선되는 것으로 보아 콩나물과 헛개나무 열매의 단독 처리보다 이들을 병용하였을 때 isoflavone 및 ampelopsin과 같은 생리활성 물질들을 함유하고 있어 더 뛰어난 항산화 효과를 가지는 것으로 판단되며, 산화적 스트레스에 의한 간 손상으로부터 간을 보호할 수 있을 것으로 사료된다.
Fig. 6.
Effects of SHM on hepatic malondialdehyde (A), plasma malondialdehyde (B), hepatic glutathione (C), and plasma glutathione (D) in chronically alcohol-treated rats.
All values are mean±SD (n=6). Different superscript letters (a-d) on the bars indicate significant differences (p<0.05) by Duncan’s multiple range test. N, normal; C, control (alcohol); PC, positive control (silymarin); SM, soybean sprouts mixture; HM, Hovenia dulcis Thunb. fruit mixture; SHM, soybean sprouts mixture containing Hovenia dulcis Thunb. fruit concentrate.
Download Original Figure
4. 요약
본 연구는 만성 알코올 유도 쥐에 대한 1.5% 헛개나무 열매 농축액이 첨가된 콩나물 혼합물의 숙취해소 및 간 기능 개선 효과를 확인하고자 하였다. 헛개나무 열매 농축액을 함유한 콩나물 혼합물군(SHM) 내 ampelopsin 및 L-asparagine의 함량은 10.52, 35.19 ppm으로 확인되었으며, 만성 알코올 급여에 의해 체중 변화량이 감소하고, 간 중량은 증가한 반면 SHM 처리시 유의적으로 체중 변화량이 증가하였으며, 간 중량이 감소하였다. 혈중 alcohol 및 acetaldehyde의 농도는 SHM군에서 2.89, 0.53 g/L로 가장 낮은 함량을 보였으며, 간 조직 ADH 및 ALDH의 활성은 SHM군에서 33.11, 102.06 U/L로 가장 높은 활성을 나타냈다. 만성 알코올 유도는 ALT, AST 및 GGT와 같은 간 기능 지표 효소들의 활성을 증가시켰지만, SHM 처리시 각각 41.00, 130.83 및 0.47 U/L로 활성이 유의적으로 감소하였다. 간 조직 및 혈중 triglyceride 함량은 SHM군에서 1.45와 33.00 mmol/L로 가장 낮은 값으로 나타났고, 만성 알코올 투여로 증가된 혈중 total cholesterol 및 LDL cholesterol 함량은 SHM에 의해 감소하였으며, 만성 알코올 투여로 인해 감소된 혈중 HDL cholesterol 함량은 SHM 처리시 증가하였다. 간 조직을 형태학적 및 병리학적으로 관찰한 결과, 만성 알코올 유도군의 간 조직은 형태학적 관찰에서 황갈색을 띠었고, 병리학적 관찰에서는 지질방울의 크기 및 수가 증가하였다. 그러나 SHM 처리시 형태학적으로 관찰한 간 조직의 색은 적갈색으로 나타났고, 병리학적으로 관찰한 간 조직의 지질방울 크기 및 수는 감소하였다. SHM군의 간 조직 및 혈중 지질 과산화 함량은 677.68, 76.26 nmol/g으로 가장 낮은 값으로 확인되었으며, 간 조직 및 혈중 GSH 함량은 SHM군에서 가장 높은 값인 19.93 및 20.08 ¼mol/kg으로 나타났다. 따라서 콩나물 또는 헛개나무 열매의 단일 섭취보다 혼합하였을 때 ampelopsin 및 asparagine과 같은 유효성분들의 시너지에 의해 SHM군에서 증진된 숙취해소 및 간 기능 개선 효과를 확인할 수 있었으며, 이는 기능성 식품 소재화에 대한 가능성을 제시하는 기초 자료로 활용될 수 있음을 시사한다.
Acknowledgements
Following are results of a study on the “Leaders in INdustry-university Cooperation +” Project, supported by the Ministry of Education and National Research Foundation of Korea.
References
Bae GK, Byun GI, Choi SK. Quality characteristics of fish, crab and red-crab stock prepared by high pressure extract method. Korean J Culinary Res. 13:293-304 2007;


Baldi E, Burra P, Plebani M, Salvagnini M. Serum malondialdehyde and mitochondrial aspartate aminotransferase activity as markers of chronic alcohol intake and alcoholic liver disease. Ital J Gastroenterol. 25:429-432 1993; .

Cho JY, Moon JH, Park KH. Isolation and identification of 3-methoxy-4-hydroxybenzoic acid and 3-methoxy-4-hydroxycinnamic acid from hot water extracts of
Hovenia dulcis Thunb and confirmation of their antioxidative and antimicrobial activity. Korean J Food Sci Technol. 32:1403-1408 2000; .

Cho SH, Kim JC, Kim SW. Effect of plant extracts on the activity of alcohol dehydrogenase and the antioxidation in alcohol-treated rat hepatocyte. J Korean Soc Food Sci Nutr. 30:679-683 2001; .

Choi EJ, Kim DS, Bae GK, Choi SK. The effect heating time on the quality of short necked clam stock. Korean J Culinary Res. 20:65-78 2014;


Clichici S, Olteanu D, Nagy AL, Oros A, Filip A, Mircea PA. Silymarin inhibits the progression of fibrosis in the early stages of liver injury in CCl
4-treated rats. J Med Food. 18:290-298 2015;



Heo JA, Park WL, Min HJ, Kim JH, Won YS, Seo KI. Physicochemical properties and physiological activity of bean sprouts extract containing
Hovenia dulcis Thunb concentrates. Korean J Food Preserv. 30:617-629 2023;


Hong CY, Kim JB, Noh HJ, Na CS. Effects of dextrin and β-cyclodextrin on protective effect of
Hovenia dulcis fruit extract against alcohol-induced liver damage
in vivo. J Fd Hyg Safety. 30:115-119 2015;


Jeong CH, Lee SH, Kim HY. Quality and sensory properties of HMR-type pork
Tteokgalbi containing roasted garlic powder. Korean J Food Sci Technol. 53:601-606 2021; .

Jeong YS, Park HJ, Dhakal KH, Lee JD, Lee IJ, Hwang YH. Change of asparagine content in soybean sprouts by variety, root growth, and cultivation period. Agric Res Bull Kyungpook Natl Univ. 26:63-69 2008; .

Jung BS. Metabolic effects of alcohol. Korean J Food & Nutrition. 4:207-211 1991; .

Jung SJ, Chae SW. Effects of adherence to Korean diets on serum GGT and cardiovascular disease risk factors in patients with hypertension and diabetes. J Nutr Health. 51:386-399 2018;


Kim Cl. Cause and effect of hangover. Food Ind Nutr. 4:26-30 1999; .

Kim D, Chun JY. Processing optimization of onion flakes for home meal replacement type soup. J Korean Soc Food Sci Nutr. 50:155-163 2021;


Kim DS, Kim JS, Seong TJ. Amino acid properties and sensory characteristics of chicken stock by different salt contents. Korean J Culinary Res. 16:274-285 2010;


Kim EH, Lee KS. A study of matrix metalloproteinase-9 inhibitor in
Hovenia dulcis Thunberg. Anal Sci Technol. 24:135-141 2011;


Kim EJ, Lee KI, Park KY. Effects of germanium treatment during cultivation of soybean sprouts. J Korean Soc Food Sci Nutr. 31:615-620 2002;


Kim EJ, Lee KI, Park KY. Quantity analysis of nutrients in soybean sprouts cultured with germanium. J Korean Soc Food Sci Nutr. 31:1150-1154 2002;


Kim GY, Park IS, Kim SH. The effect of added shiitake mushroom on antioxidative activity of puffer fish stock. Korean J Food Nutr. 30:742-748 2017; .

Kim HK, Kwon YA, Rho SR, Hahm YT. The role of fatty acid binding protein in the fatty liver induced by alcohol or high cholesterol diet in rats. Korean J Nutr. 32:628-636 1999; .

Kim JH, Seo YM, Kim JH, Hyun SH, Lee SK, Kim CH, Kang MJ, Jeon TW, Yoon SH, Jeong TC. Protective effects of the water extracts of
Hovenia dulcis Thunb against ethanol-induced toxicity in primary cultured rat hepatocytes. Yakhak Hoeji. 52:56-61 2008; .

Kim JM, Park SK, Guoa TJ, Kang JY, Ha JS, Lee DS, Kwon OJ, Lee U, Heo HJ. Protective effect of mixed extract including
Hovenia dulcis Thunberg against chronic ethanol treatment-induced cytotoxicity in a brain and liver tissue. J Agric & Life Sci. 50:125-138 2016;


Kim JM, Song MS, Lee KS, Yoon KY. Development and property evaluation of naengmyeon broth with tomatoes and traditional medicinal herbs. J Korean Soc Food Sci Nutr. 47:320-327 2018;


Kim JY, Lee TJ, Noh SK. Blueberry wine relieves ethanol-induced fatty liver in rats. J Korean Soc Food Sci Nutr. 51:1245-1251 2022;


Kim KO, Lee HS. Effects of isoflavone-rich bean sprout on the lipid metabolism of the ethanol-treated rats. J Korean Soc Food Sci Nutr. 36:1544-1552 2007;


Kim KY, Park KI, Cho WK, Yang JH, Ma JY. Herbal formula MJY2018 protects against Alcohol-induced liver injury mice model. Herb Formula Sci. 28:189-198 2020; .

Kim MH, Choi MK. A comparative study on serum lipid levels in normal and chronic alcoholics. Korean J Nutr. 27:53-58 1994;


Kim SM, Kang SH, Ma JY, Kim JH. A study on the extraction and efficacy of bioactive compound from
Hovenia dulcis. Korean J Biotechnol Bioeng. 21:11-15 2006; .

Kim TH, Ahn HY, Kim YW, Sim SY, Seo KI, Cho YS. Hepatoprotective effect of
Bacillus substilis-fermented silkworm (
Bombyx mori L.) extract on an alcoholic fatty liver in rats. J Life Sci. 28:697-707 2018; .

Ko BS, Jang JS, Hong SM, Kim DW, Sung SR, Park HR, Lee JE, Jeon WK, Park SM. Effect of new remedies mainly comprised of
Hovenia dulcis Thunb on alcohol degradation and liver protection in Sprague Dawley male rats. J Korean Soc Food Sci Nutr. 35:828-834 2006;


Korea Agro-Fisheries & Food Trade Corporation (aT) Processed Food Detailed Market Status (Home Meal Replacement). Korea Agro-Fisheries & Food Trade Corporation, Naju,
Korea. :5 2022; .

Kwon TH, Han JH, Lee SY, Yu KH. Improvement in exercise endurance by
Honvenia dulcis fruit hot water extract in mice. Korean J Food Nutr. 33:363-371 2020; .

Lee DY. Growth of food industry from change of consumers living environment: HMR market growth factor. Food Sci Ind. 50:33-38 2017; .

Lee EH, Chyun JH. Effects of chongkukjang intake on lipid metabolism and liver function in alcoholic fatty liver rats. J Korean Soc Food Sci Nutr. 38:1506-1515 2009;


Lee EH, Cyun JH. Effects of β-carotene supplementation on lipid peroxide levels and antioxidative enzyme activities in alcoholic fatty liver rats. Korean J Nutr. 38:289-296 2005; .

Lee JS, Kim NY, Lee KH, Kim GS, Park HJ, Choi JW, Kim SH. Effects of flower of
Pueraria lobata on lipid peroxidation and activities of alcohol metabolic enzymes in alcohol-treated rats. J Korean Soc Food Sci Nutr. 29:935-942 2000; .

Lee SJ, Kang MJ, Shin JH, Kim JG, Kang SK, Sung NJ. The effect of garlic and medicinal plants extracts on the liver function and lipid metabolism of rats administrated with alcohol. J Korean Soc Food Sci Nutr. 38:561-568 2009;


Lieber CS. Relationship between nutrition, alcohol use, and liver disease. Alcohol Res Health. 27:220-231 2003; .

Na CS, Hong CY, Na DS, Kim JB, Yoon SY, Lee SB, Dong MS. Hotwater extract of
Hovenia dulcis peduncle improves exercise performance and anti-fatigue effect in mice. Kor J Pharmacogn. 44:83-90 2013; .

Noh HM, Ahn EM, Yun JM, Cho BL, Paek YJ.
Angelica keiskei Kooidzumi extracts improve some markers of liver function in habitual alcohol drinkers: A randomized double-blind clinical trial. J Med Food. 18:166-172 2015;



Park EM, Ye EJ, Kim SJ, Choi HI, Bae MJ. Eliminatory effect of health drink containing
Hovenia dulcis Thunb extract on ethanol-induced hangover in rats. Korean J Food Culture. 21:71-75 2006; .

Park SC. Ethanol oxidation is accelerated by augmentation of malate-aspartate shuttle with aspartate. Korean J Biochem. 25:137-143 1993; .

Park SC. Effect of bean sprout extracts on metabolism and biological functions of ethanol
in vitro and
in vivo. Korean Soybean Dig. 10:123-143 1994; .

Park SC, Han JC, Han JA, Park YC. Aspartate decreases lipid peroxidation and protein carbonylation in liver of chronic ethanol-fed rats. Korean J Biochem. 26:145-149 1994; .

Park SH, Chang EY. Antimutagenic and cytotoxic effects of
Hovenia dulcis Thunb leaves extracts. J Korean Soc Food Sci Nutr. 36:1371-1376 2007;


Seong SI, Park KE, Nagata M, Yoshitake N. Effect of metamorphosis on the major hemolymph proteins of the silkworm. Arch Insect Biochem Physiol. 2:91-104 1985;


Shon HK, Kim YH, Lee KA. Quality characteristics of
Kongnamulguk with commercial soy sprouts. Korean J Human Ecology. 18:1147-1153 2009;


Shon MY, Cha JY, Lee CH, Park SH, Cho YS. Protective effect of administrated glutathione-enriched
Saccharomyces cerevisiae FF-8 against carbon tetrachloride (CCl
4)-induced hepatotoxicity and oxidative stress in rats. Food Sci Biotechnol. 16:967-974 2007; .

Song EJ, Cho KH, Choo HJ, Yang EY, Jung YK, Seo MG, Kim JC, Kang EJ, Ryu GH, Park BY, Hah YS. Hepatoprotective effects of
Semisulcospira libertine hydrolysate on alcohol-induced fatty liver in mice. Food Eng Prog. 21:318-325 2017;


Sung HM, Jung HJ, Yun SK, Kim TY, Kim KM, Wee JH. Effect of a soy-sprout beverage prepared with high-concentrated oxygen water on alcohol metabolism in rats. Korean J Food Sci Technol. 46:616-621 2014;


Sung HM, Kim SJ, Kim KM, Yun SK, Jung HJ, Kim TY, Wee JH. Antioxidant activity of soy-sprout extracts prepared by enzyme and ultra high pressure. J Korean Soc Food Sci Nutr. 43:1228-1235 2014;


Tuma DJ, Casey CA. Dangerous byproducts of alcohol breakdown-focus on adducts. Alcohol Res Health. 27:285-290 2003; .

Urena IJ, Idrisoova A, Zhang M, VanDreal M, Sanghavi N, Skinner SG, Cheng S, Zhang Z, Watanabe J, Asatryan L, Cadenas E, Davies DL. Dihydromyricetin supplementation improves ethanol-induced lipid accumulation and inflammation. Front Nutr. 10:1201007 2023;




You YH, Jung KY, Lee YH, Jun WJ, Lee BY. Hepatoprotective effects of
Hovenia dulcis fruit on ethanol-induced liver damage
in vitro and
in vivo. J Korean Soc Food Sci Nutr. 38:154-159 2009;