Research Article
오미자(Schisandra chinensis) 열매의 과육과 씨에서 정유 및 리그난 성분 비교
김미선1,‡
,
권예슬1,2
,
최현진1,2
,
김영회1,‡
,
최한석2,*
Comparison of essential oils and lignans compositions from pulp and seed of Omija (Schisandra chinensis) berry
Mi-Sun Kim1,‡
,
Ye Seul Kwon1,2
,
Hyun Jin Choi1,2
,
Young-Hoi Kim1,‡
,
Han-Seok Choi2,*
Author Information & Copyright ▼
1Department of Food Science and Technology, Jeonbuk National University, Jeonju 54896, Korea
2Major of Agriculture & Fisheries FoodTech, Korea National University of Agriculture and Fisheries, Jeonju 54874, Korea
‡ These authors contributed equally to this study.
Citation: Kim MS, Kwon YS, Choi HJ, Kim YH, Choi HS. Comparison of essential oils and lignans compositions from pulp and seed of Omija (Schisandra chinensis) berry. Food Sci. Preserv., 31(4), 623-632 (2024)
Copyright © The Korean Society of Food Preservation. This is an Open Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jul 19, 2024; Revised: Aug 21, 2024; Accepted: Aug 21, 2024
Published Online: Aug 31, 2024
Abstract
Fully ripe Omija (Schisandra chinensis Baillon) berry has been used for medicinal and edible purposes for a long time due to its various physiological activities. The seeds of Omija fruit are produced during the processing of the fruit, but are often discarded in the food industry. To increase the utilization of Omija seeds, this study investigated the differences in essential oil and lignan compositions between the pulp and seed. The yield of essential oil in whole berries was 1.33% based on dry weight, 0.91% in the pulp, and 2.65% in the seed, respectively. A total of 62 constituents were identified by GC and GC–MS analysis from the oils of the two parts. The major constituents were sesquiterpenes, such as α-ylangene, cuparene, alloaromadendrene, cis-lanceol, β-himachalene, and nootkatone. The content of these ingredients was higher in the seed than in the pulp. The most abundant lignan compounds in the berry were schizandrin, followed by γ-schizandrin, schizandrin A, and schizandrol B. The content of the four lignans in the seed was significantly higher than in the pulp. The seeds of Omija have higher contents of essential oils and lignan compounds compared to the pulp, making it necessary to explore approaches for utilizing them as food ingredients.
Keywords: Omija; Schisandra chinensis; different parts; essential oil; lignans
1. 서론
오미자(Schisandra chinensis Baillon)는 오미자과(Schisandraceae)에 속하는 낙엽성의 덩굴식물로서 강원도, 경상북도, 경상남도 및 전라북도의 일부 지역에서 재배되고 있다(Lee와 Lee, 1989). 오미자 열매(이하 오미자)는 예전부터 한방에서 자양, 강장, 간 기능 개선, 진정, 해열을 목적으로 이용되어 왔으며(Lee 등, 2001; Lee 등, 2012), 이 외에 항산화 및 항균(Mocan 등, 2016; Ryu와 Kwon, 2012), 항 유전독성 및 항암효과(Hancke 등, 1999; Kim과 Park, 2012)와 더불어 간 보호, 항염증, 항당뇨, 면역증강, 해독, 심혈관 질환 예방, 항 피로, 스트레스 해소 효과가 있다는 것이 밝혀졌다(Hancke 등, 1999; Kopustinskiene과 Bernatoniene, 2021; Panossian과 Wikman, 2008).
오미자의 다양한 약리효과는 주로 오미자에 함유된 리그난 성분들에 기인한다(Chun 등, 2014; Hancke 등, 1999; Panossian과 Wikman, 2008). 최근까지 오미자에서 다수의 리그난 성분들이 존재한다는 것이 밝혀졌는데 그중에서도 양적으로 많이 함유된 성분은 schizandrin(schizandrol A), schizandrin A(deoxyschizandrin), schizandrol B(gomisin A), γ-schizandrin(schizandrin B), schizandrin C(Wuweizisu C), schizantherin(gomisin C) 등이다(Halstead 등, 2007; Wei 등, 2010).
국내산 오미자의 리그난 성분들의 조성과 관련하여 Sohn 등(1989)은 무주지역에서 재배한 오미자 중의 리그난 성분들의 조성을 GC-MS법으로 분석한 결과 shizandrin과 γ-schizandrin이 각각 약 32%를 차지하였고, 기타 schizandrin A, schizandrin C, angeloylgomisin H가 주요 구성성분이었다고 보고하였다. 또한, Lee와 Kim(2010)도 국내산 오미자에 양적으로 많이 함유된 리그난 성분은 schizandrin, γ-schizandrin, schizandrol B, schizandrin A 및 schizandrin C 등이었다고 보고하였으며, 이러한 성분들의 함량은 수집 지역 및 생산 연도에 따라 많은 차이가 있는 것으로 보고되어 있다(Kim 등, 2002; Kim 등, 2003).
오미자의 특징적인 향기는 오미자의 정유(essential oil)에 함유된 다수의 휘발성 테르페노이드 화합물의 존재에 기인하는 것으로 밝혀졌으며, 항산화, 항균, 항염 및 항암 활성 등의 효과가 보고되어 있다(Lee 등, 2021; Liu 등, 2012; Szopa 등, 2019; Teng과 Lee, 2014).
식품 이용 측면에서는 완숙한 오미자는 독특한 향기와 맛을 지니고 있어서 설탕을 첨가하여 만든 오미자 청이나 엑스(extract), 차, 음료, 술, 젤리, 스포츠 드링크, 식초 등의 제조에 이용된다(Kang 등, 1992; Oh 등, 2002). 이 과정에서 씨 부위가 부산물로 생성되며, 씨 부위는 전체 오미자의 약 10-40%를 차지하고 있음에도 활용되지 못하고 있다(Jang 등, 2018; Lee 등, 2016). 또한, 종전의 연구 결과에 의하면 생리활성 성분인 리그난 화합물들은 과육보다는 씨에 월등하게 많이 함유된 것으로 보고되어 있으나 성분조성에 대한 정보는 여전히 부족한 편이다.
따라서 본 연구에서는 가공과정에서 부산물로 생산되는 오미자 씨의 활용성 증대를 위해 과육과 씨의 정유 성분조성 및 주요 리그난 성분들의 함량을 비교코자 하였다.
2. 재료 및 방법
2.1. 실험재료
본 실험에 사용한 오미자는 전북 장수지역에서 완숙한 단계에서 수확한 생오미자를 재배 농가에서 직접 구매하여 사용하였다. 시료는 물로 씻은 다음 이물질을 제거하고 색상과 크기가 균일한 것을 골라 동결건조하였고, 선별된 일부의 시료는 수작업으로 과육(mesocarp + exocarp)과 씨(seed) 부위를 분리하여 동결건조하였다. 건조한 각 시료는 가정용 분쇄기(Hanil SFM-700SS, Hanil Electric Co., Ltd., Seoul, Korea)로 분쇄한 다음 밀폐된 용기에 넣어 −20°C 이하의 냉동실에 보관하면서 실험에 사용하였다.
2.2. 시약
분석용 표준품으로서 리그난 성분인 schizandrin, schizandrol B, schizandrin A, γ-schisandrin, nootkatone, n-nonadecane 및 n-paraffin standard mixture(C7-C30)는 Sigma-Aldrich사(St. Louis, MO, USA) 제품을 구입하여 사용하였다. HPLC용 acetonitrile과 methanol은 Avantor Korea(Suwon, Korea) 제품을 사용하였고 기타 시약은 Daihan Scientific Co., LTD(Wonju, Korea)의 특급 제품을 사용하였다.
2.3. 성분 분석
2.3.1. 일반성분
수분, 조단백질, 조지방 및 조회분은 AOAC법(AOAC, 1995)에 따라 수분함량은 105°C에서 상업가열건조법, 조지방은 Soxhlet법, 조단백질은 micro-Kjeldahl법, 조회분은 직접 회화법으로 분석하였다.
2.3.2. 정유성분 분리
오미자 중의 정유는 Likens & Nickerson type simultaneous steam distillation and extraction(SDE) 장치를 사용하여 상압 수증기법으로 분리하였다(Schultz 등, 1977). 즉, 동결건조하여 분쇄한 오미자의 부위별 시료 30 g에 증류수 1.5 L와 내부표준물질로서 n-nonadecane(500 μg/mL)을 함유한 용액 2 mL를 3 L 용량의 둥근바닥 플라스크에 넣고 SDE 장치의 head를 연결한 다음 수증기가 발생하면서부터 2시간 동안 증류하였으며, 이때 휘발성 정유 추출용 용매는 n-pentane:diethyl ether(1:1) 혼합액 50 mL를 사용하였다. 증류 완료 후 정유가 함유된 용매 분획은 무수황산 나트륨으로 12시간 동안 탈수 후 40°C에서 약 5 mL로 감압농축하고 40°C 이하에서 Aldrich Micro Vigreux column(leogth 190 mm, Sigma Aldrich)을 사용하여 약 1 mL로 농축한 다음 gas chromatography(GC) 및 gas chromatography-mass spectrometry(GC-MS)에 의한 분석용 시료로 사용하였다.
2.3.3. 정유성분 분석
GC 분석용 기기는 검출기로서 flame ionization detector(FID)가 부착된 Agilent제 모델 6890의 GC(Agilent Technologies, Santa Clara, CA, USA)를 사용하였다. GC 컬럼은 비극성의 DB-5MS(30 m×0.25 mm, 0.25 μm)를 사용하였고 컬럼 온도는 40°C에서 230°C까지 분당 2°C로 승온시킨 다음 230°C에서 20분간 유지하였다. Injector와 detector 온도는 각각 250°C로 설정하였으며, carrier gas는 질소(flow rate: 1.0 mL/분)를 사용하여 split mode(split ratio=20:1)로 주입하였다. GC-MS에 의한 분석에는 Shimadzu제 QP2010 plus GC-MS system(Kyoto, Japan)을 사용하였다. GC-MS 분석용 컬럼은 DB-5MS(30 m ×0.25 mm, 0.25 μm)를 사용하였고, 컬럼 온도는 위에서의 GC 조건과 동일한 조건으로 하였다. Injector와 interface 온도는 각각 250°C로 하였고, carrier gas는 헬륨(flow rate: 1.0 mL/min), electron ionization voltage(EI)는 70 eV로 하였다. 검출된 각 peak의 동정은 GC-MS 분석에 의해 mass spectrum을 얻은 후 GC-MS system에 내장된 mass spectral data library의 검색과 시료와 동일 조건에서 n-paraffin standard mixture(C7-C30)를 GC로 분석한 다음 Van Den Dool과 Kratz(1963)의 방법에 따라 각 peak의 retention index(RI)를 계산한 후 문헌상의 RI값의 비교(Adams, 1995, NIST chemistry webbook, 2023) 및 일부 성분은 GC에서 표준품과 머무름시간(RT, retention time을 비교하여 동정하였다. 각 성분의 정량은 내부 표준물질(n-nonadecane)과 검출된 각 성분의 FID의 relative response factor(RRF=1.00)가 동일한 것으로 간주하여 계산하였다(Cicchett 등, 2008; Tedone 등, 2011).
2.4. 리그난 성분 조성
2.4.1. 추출
부위별 시료 0.5 g에 methanol 20 mL를 가한 다음 상온에서 20분간 초음파 처리 후 원심분리(2,291 ×g, 10 min)하였다. 이 조작을 1회 더 반복한 다음 얻어진 두 개의 상등액을 합하여 50 mL의 메스플라스크에 넣고 methanol로 50 mL로 정용한 후 0.45 μm microsyringe filter(Nylon, Sartorius AG, Gottingen, Germany)로 여과한 다음 high performance liquid chromatography (HPLC)법으로 분석하였다.
2.4.2. 분석
HPLC 기기는 Waters제 626 pump, 717 plus autosampler 및 photodiode array detector(PDA)로 구성된 HPLC system (Waters Corp. Milford, MA, USA)을 사용하였다. 칼럼은 YMC-Pack pro C18 RS(250×4.6 mm, 5 μm) (YMC Co., Ltd., Kyoto, Japan)를 사용하였고, 성분 분리는 gradient mode로 하였으며, 이동상 A는 0.1% formic acid를 함유하는 20% acetonitrile 수용액, 이동상 B는 90% acetonitrile을 사용하여 gradient mode로 분석하였다. 이동상의 gradient 조건은 머무름 시간 1-4분(55% A), 4-9분(85% B), 9-11분(100% B), 11-35분 (55% A) 이었고 유량은 1.0 mL/min, 주입량은 20 μL, UV 검출기 파장은 254 nm로 하여 분석하였다. 각 성분의 정량은 표준품을 사용하여 작성한 검량선을 활용하여 정량하였다.
2.5. 통계 분석
일반성분은 및 리그난 성분은 3회씩 반복 분석하였으며, 결과는 SPSS 통계프로그램(version 19.0, SPSS Institute Inc., Chicago, IL, USA)을 이용하여 통계 분석하였다. 결과는 분산분석을 실시하였으며, Duncan’s multiple range test로 p<0.05 시료 간 유의성을 검정하였다.
3. 결과 및 고찰
3.1. 일반성분
본 실험에 사용한 오미자의 부위별 일반성분을 분석한 결과는 Table 1과 같다. 수분함량은 열매 전체가 12.22±0.07%, 과육 10.68±0.22%, 씨가 8.08±0.07% 순으로 나타났으며, 조지방 함량은 과육에서는 21.84±1.28%인데 비하여 씨에서는 38.16± 1.45%로서 과육보다 씨에서 1.7배 이상 높았다. 열매 전체의 조단백질 함량은 6.85±0.26%이었고, 과육에서는 3.53±0.03%이었으나 씨에서는 18.09±0.18%로서 과육보다는 씨에서 약 5.1배 높았으며, 조회분 함량은 씨(2.21±0.05%)보다 과육(3.09±0.01%)에서 약 1.4배 높았다. Lee 등(2016)은 국내산 오미자를 과육과 씨 및 외피(skin) 부위로 구분하여 분석하였을 때 조지방 함량은 각각 1.65±0.16%, 19.04±3.01% 및 5.23±0.73%이었고 조단백질 함량은 과육과 씨 및 외피에서 각각 0.66±0.07%, 12.57± 1.76% 및 1.81±0.18%이었다고 보고하였다. 본 실험 결과를 Lee 등(2016)의 결과와 비교하였을 때 과육과 씨에서 조지방과 조단백질의 함량이 본 실험 결과에서 높았고, 조회분 함량도 역시 본 실험 결과에서 높은 편이었다. 이러한 차이는 시료인 오미자의 유전적 요인, 생육 환경조건, 생산 연도나 수확시기 등의 차이에 기인하는 것으로 추정된다.
Table 1.
Proximate composition of S. chinensis berry
|
|
Whole |
Pulp |
Seed |
| Moisture (%) |
12.22±0.071)c,2) |
10.68±0.22b |
8.08±0.07a |
| Crude protein (%) |
6.85±0.26b |
3.53±0.03a |
18.09±0.18c |
| Crude lipid (%) |
27.97±1.93b |
21.84±1.28a |
38.16±1.45c |
| Crude ash (%) |
3.07±0.04b |
3.09±0.01b |
2.21±0.05a |
Download Excel Table
3.2. 정유성분 조성
수증기 증류법에 의해 얻어진 정유의 함량을 측정한 결과는 Table 2와 같다. 부위별로 구분하지 않고 동결건조한 오미자(whole berry) 정유 함량은 1.33±0.10%로서 시중에서 유통되는 건조 오미자를 본 실험에서와 같은 SDE법으로 분리하였을 때 정유의 함량은 0.88%이었다고 보고한 종전의 결과(Kim과 Jang, 1994)보다 다소 높았다. 이러한 결과는 정유의 구성성분들은 비교적 휘발성이 강한 성분들로서 시중에서 유통되는 건조 오미자는 대부분 건조기(40-70°C, 48-72시간)에서 건조한 것이기 때문에 건조과정 또는 유통과정에서 휘발성 성분들의 일부가 소실되었기 때문으로 판단된다(Kim 등, 2000). 또한, 동결 건조품을 과육과 씨를 구분하여 부위별로 비교했을 때 씨에서 정유 함량은 2.65±0.25%로서 과육(0.91±0.05%)보다 약 2.9배 정도 높았다.
Table 2.
Content of essential oil in different parts of S. chinensis berry
|
|
Whole |
Pulp |
Seed |
| Oil content (%) |
1.33±0.101)b,2) |
0.91±0.05a |
2.65±0.25c |
Download Excel Table
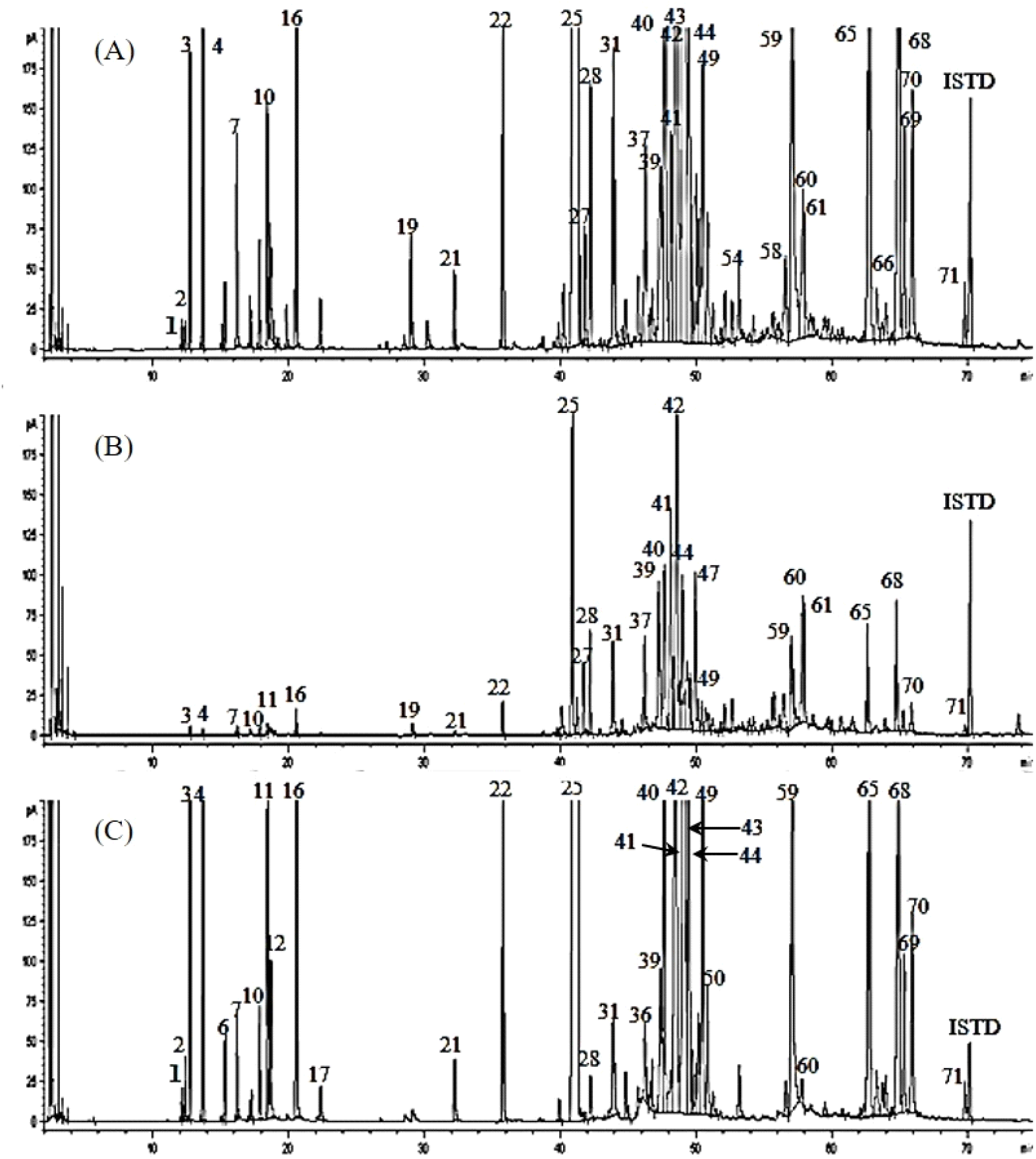
한편 각각의 정유성분의 휘발성 성분의 조성을 분석하기 위하여 GC로 분석한 chromatogram을 비교한 결과는 Fig. 1과 같다. 과육과 씨를 구분하지 않은 오미자 전체에서 얻어진 정유의 chromatogram에서 다수의 peak들이 검출되어, 오미자의 정유는 많은 휘발성 성분들로 구성되어 있음을 알 수 있다. 씨에서 분리한 정유에서도 역시 다수의 peak들이 검출되었으나, 과육에서 분리한 정유의 경우 검출된 peak들의 수도 적었을 뿐만 아니라 특히 머무름시간 30분대 이전에서는 peak들이 거의 검출되지 않아 씨에서 분리한 정유와는 많은 차이를 보였다. 또한 Table 3에서 구성성분들의 동정 결과를 보면 오미자 정유는 주로 monoterpene과 sesquiterpene계 화합물들로 구성되어 있음을 알 수 있다. 우선 과육과 씨를 분리하지 않고 증류하여 얻어진 오미자의 정유에서 동정된 62종의 성분 중에서는 α-ylangene (1,804.76 μg/g)이 양적으로 가장 많이 검출되어, α-ylangene이 오미자 정유에서 가장 많이 함유된 성분이라고 보고한 종전의 결과들과 일치하였다(Kim과 Jang, 1994; Liu 등, 2012; Teng과 Lee, 2014). 다음으로 많이 함유된 성분은 cuparene(533.79 μg/g), alloaromadendrene(352.58 μg/g), nootkatone(347.32 μg/g), cis-lanceol(335.28 μg/g), α-Cedr-8(15)-en-9-ol(311.12 μg/g), β-himachalene(295.97 μg/g) 등이었다. α-ylangene 이외에도 Kim과 Jang(1994)은 monoterpene류인 α-pinene, camphene, limonene, γ-terpenene, p-cymene 및 sesquitepene인 β-elemene 성분이, Li 등(2003)은 cis,cis-α-farnesene, β-himachalene, β-caryophyllene, α-fencyl acetate 성분이, Chen등(2011)은 α-bergamotene, α-himachalene, β-chamigrane 성분이 오미자 정유의 주요 구성성분이라고 보고하여 본 연구 결과와 다소 차이가 있었다. 이러한 차이는 시료로 사용한 오미자의 생육조건, 유전적 요인, 건조조건, 오미자를 건조한 후 보관 및 유통기간에 따른 차이에 기인한다고 할 수 있다.
Fig. 1.
Gas chromatograms of essential oil in different parts of S. chinensis berry.
(A) whole fruit, (B) pulp (mexocarp + exocarp), (C) seed, ISTD, internal standard (n-nonadecane).
Download Original Figure
Table 3.
Comparison of essential oil composition in different parts of S. chinensis berry
| Peak No. |
RT1)(min) |
RI2) |
Components |
Content (μg/g) |
| Whole |
Pulp |
Seed |
| Monoterpene hydrocarbons (23) |
| 1 |
12.101 |
918 |
Tricyclene |
5.71 |
-3) |
25.22 |
| 2 |
12.339 |
924 |
α-Thujene |
5.78 |
- |
52.74 |
| 3 |
12.737 |
930 |
α-Pinene |
60.79 |
2.37 |
275.25 |
| 4 |
13.684 |
944 |
Camphene |
82.85 |
2.31 |
363.31 |
| 5 |
15.064 |
970 |
Sabinene |
5.91 |
- |
5.44 |
| 6 |
15.312 |
972 |
β-Pinene |
14.63 |
- |
71.62 |
| 7 |
16.176 |
994 |
β-Myrcene |
51.13 |
3.46 |
94.91 |
| 8 |
17.143 |
1,005 |
α-Phellandrene |
12.55 |
- |
17.75 |
| 9 |
17.260 |
1,008 |
δ-3-Carene |
6.03 |
- |
27.90 |
| 10 |
17.833 |
1,014 |
α-Terpinene |
26.40 |
3.37 |
105.06 |
| 11 |
18.415 |
1,025 |
p-Cymene |
64.53 |
4.68 |
338.46 |
| 12 |
18.642 |
1,028 |
Limonene |
39.80 |
- |
164.43 |
| 13 |
18.915 |
1,029 |
1,8-Cineole |
7.97 |
- |
- |
| 15 |
19.879 |
1,049 |
trans-β-Ocimene |
13.24 |
- |
- |
| 16 |
20.628 |
1,058 |
γ-Terpinene |
129.10 |
9.74 |
587.72 |
| 17 |
22.364 |
1,087 |
Terpinolene |
14.60 |
- |
43.14 |
| 18 |
28.536 |
1,166 |
Borneol |
5.12 |
- |
- |
| 19 |
29.048 |
1,178 |
4-Terpineol |
39.94 |
7.07 |
- |
| 20 |
30.229 |
1,193 |
α-Terpineol |
13.00 |
- |
- |
| 21 |
32.235 |
1,239 |
Thymyl ethyl ether |
23.94 |
- |
82.07 |
| 22 |
35.842 |
1,289 |
Bornyl acetate |
134.25 |
13.67 |
470.16 |
| 23 |
39.915 |
1,337 |
4-Terpinyl acetate |
9.77 |
2.67 |
28.45 |
| 24 |
40.287 |
1,353 |
α-Terpinyl acetate |
22.93 |
15.35 |
28.45 |
| Sesquiterpene hydrocarbons (39) |
| 25 |
41.376 |
1,380 |
α-Ylangene |
1,804.76 |
195.08 |
6,687.76 |
| 26 |
41.479 |
1,376 |
α-Copaene |
18.05 |
14.66 |
25.70 |
| 27 |
41.867 |
1,386 |
Isolongifolene |
36.19 |
28.02 |
12.26 |
| 28 |
42.291 |
1,392 |
β-Elemene |
82.17 |
40.69 |
63.47 |
| 29 |
42.988 |
1,397 |
β-Longipinene |
3.87 |
- |
8.98 |
| 30 |
43.314 |
1,403 |
Longifolene |
3.45 |
- |
- |
| 31 |
43.953 |
1,416 |
β-Caryophyllene |
143.86 |
52.07 |
219.08 |
| 32 |
44.297 |
1,418 |
α-Gujurnene |
4.61 |
- |
- |
| 34 |
44.876 |
1,435 |
α-Bergamotene |
13.54 |
- |
55.55 |
| 35 |
45.767 |
1,443 |
Aromandendrene |
26.16 |
- |
32.37 |
| 36 |
46.124 |
1,448 |
α-Humulene |
15.95 |
12.46 |
96.18 |
| 37 |
46.316 |
1,457 |
trans-β-Farnesene |
85.09 |
41.60 |
39.22 |
| 40 |
47.759 |
1,463 |
Alloaromadendrene |
352.58 |
106.20 |
708.96 |
| 41 |
48.210 |
1,481 |
γ-Gurjunene |
97.67 |
121.33 |
98.25 |
| 42 |
48.551 |
1,499 |
β-Himachalene |
295.97 |
308.89 |
1,459.80 |
| 43 |
48.741 |
1,507 |
trans,trans-α-Farnesene |
288.33 |
21.15 |
- |
| 44 |
49.254 |
1,505 |
Cuparene |
533.79 |
77.46 |
2,098.72 |
| 45 |
49.536 |
1,510 |
β-Bisabolene |
267.01 |
64.38 |
829.10 |
| 47 |
50.044 |
1,514 |
γ-Cadinene |
62.35 |
72.21 |
133.91 |
| 48 |
50.275 |
1,516 |
Cubenol |
51.66 |
12.68 |
182.52 |
| 49 |
50.557 |
1,526 |
δ-Cadinene |
100.88 |
12.90 |
459.63 |
| 50 |
50.900 |
1,534 |
Cadina-1,4-diene |
57.03 |
7.48 |
182.52 |
| 51 |
52.697 |
1,566 |
trans-Nerolidol |
14.47 |
14.48 |
42.01 |
| 52 |
53.199 |
1,579 |
β-Caryophyllene oxide |
25.86 |
7.05 |
79.91 |
| 53 |
53.944 |
1,578 |
Spathulenol |
4.30 |
7.41 |
- |
| 54 |
54.260 |
1,590 |
Viridifolrol |
8.63 |
8.72 |
- |
| 55 |
55.641 |
1,610 |
β-Himachalene oxide |
7.68 |
12.35 |
- |
| 56 |
55.790 |
1,614 |
Di-epi-β-cedrol |
8.50 |
15.95 |
- |
| 58 |
56.621 |
1,634 |
δ-Cadinol |
50.03 |
26.23 |
64.75 |
| 59 |
57.151 |
1,655 |
α-Cedr-8(15)-en-9-ol |
311.12 |
52.08 |
759.14 |
| 60 |
57.910 |
1,662 |
α-Cadinol |
79.09 |
65.61 |
40.37 |
| 62 |
59.773 |
1,689 |
epi-α-Bisabolol |
8.10 |
6.65 |
23.01 |
| 63 |
60.802 |
1,708 |
Aromandendrene oxide |
5.47 |
10.22 |
9.82 |
| 64 |
62.410 |
1,743 |
trans,cis-Farnesol |
3.24 |
- |
33.84 |
| 65 |
62.846 |
1,765 |
cis-Lanceol |
335.28 |
49.86 |
1,035.66 |
| 66 |
63.326 |
1,768 |
14-Oxy-α-muurolene |
28.61 |
- |
93.20 |
| 67 |
64.022 |
1,779 |
γ-Eudesmol acetate |
9.31 |
6.20 |
69.15 |
| 68 |
65.035 |
1,794 |
Nootkatone |
347.32 |
60.83 |
1,645.66 |
| 69 |
65.398 |
1,801 |
epi-α-Bisabolol acetate |
82.81 |
9.79 |
229.67 |
| Others (9) |
| 14 |
19.231 |
1,034 |
Unidentified |
5.09 |
- |
11.07 |
| 33 |
44.606 |
1,423 |
Unidentified |
7.18 |
5.17 |
- |
| 38 |
46.825 |
1,459 |
Unidentified |
26.14 |
- |
66.02 |
| 39 |
47.449 |
1,460 |
Unidentified |
127.34 |
92.95 |
263.42 |
| 46 |
49.716 |
1,512 |
Unidentified |
46.98 |
26.93 |
116.73 |
| 57 |
56.194 |
1,623 |
Unidentified |
5.91 |
4.73 |
- |
| 61 |
58.025 |
1,668 |
Unidentified |
47.09 |
48.60 |
- |
| 70 |
65.988 |
1,810 |
Unidentified |
116.45 |
15.81 |
328.52 |
| 71 |
69.827 |
1,826 |
Unidentified |
22.36 |
5.62 |
61.34 |
Download Excel Table
과육과 씨를 구분하여 분리한 정유의 성분조성을 분석한 결과 대부분의 성분들이 과육보다는 씨에 많이 함유되어 있었으며, 특히 본 실험조건에 의한 GC 분석에서 머무름시간 20분 이내에서 검출되는 monoterpene류들의 경우 과육에서는 거의 검출되지 않거나 미량으로 검출되었다. 또한, 양적으로 가장 많이 검출된 α-ylangene의 경우 과육에서는 195.08 μg/g인 반면, 씨에서는 6,687.76 μg/g으로서 과육보다 씨에서 약 34배 정도 많이 검출되었으며, cuparene의 경우 과육에서는 77.46 μg/g인데 비하여 씨에서는 2,098.72 μg/g, β-himachalene은 과육에서 308.89 μg/g인데 비하여 씨에서는 1,459.80 μg/g, alloaromandendrene은 과육에서 106.20 μg/g, 그리고 씨에서는 708.96 μg/g이 검출되어 과육보다 씨에서 각각 27배, 5.7배 및 8.7배 정도 많이 검출되었다. 또한, sesquiterpene류에 속하는 nootoktone은 운향과의 과일인 grapefruit(Citrus sinensis × maxima)와 생약재로 사용되는 익지인(Alpinia oxyphylla Miq)에서 분리된 정유의 주요 구성성분으로서 항균, 항염증, 간, 신경 및 심혈관 보호 및 항암 활성과 같은 약리효과를 지니고 있는 것으로 보고되어 있다(Jha 등, 2022; Kun 등, 2020). 본 실험에서는 mass spectral data 및 nootkatone 표준품을 시료와 동일한 조건에서 GC로 분석한 후 머무름시간을 비교하여 nootkatone을 동정하였으며 과육에서는 60.83 μg/g이 검출된 데 비하여 씨에서는 1,645.66 μg/g이 검출되었다. Sowndhararajan 등(2016)은 우리나라의 2개 지역에서 생산된 오미자의 초임계 이산화탄소 추출법으로 얻어진 추출물을 분석한 결과 문경지역에서 생산된 오미자 추출물에서는 nootkatone이 검출되었으나 인제 지역에서 생산된 오미자에서는 nootkatone이 검출되지 않았다고 보고하였는데, 이러한 차이는 재배지역의 생육환경이나 유전적 요인 또는 추출 방법의 차이에 기인한다고 할 수 있다. 위에서 언급한 성분들 이외에도 오미자 정유에서 검출된 대부분의 휘발성 성분들도 과육보다는 씨에서 많이 검출되어, 씨는 오미자의 정유를 제조하는 데 중요한 원료로 사용할 수 있음을 시사해 주는 결과이다.
3.3. 리그난 성분 조성
오미자의 과육과 씨에서 리그난 성분들의 조성을 HPLC로 분석한 결과 양적으로 많이 함유된 것으로 알려진 schizandrin, schizandrol B, schizandrin A 및 γ-Schizandrin(Hancke 등, 1999; Panossian과 Wikman, 2008; Szopa 등, 2019)과 머무름시간이 일치하는 peak 이외에도 크기는 작지만 리그난 성분들로 예상되는 다수의 peak들이 검출되었다. 주요 구성성분 4종의 표준품을 구입하여 절대검량선법으로 함량을 분석한 결과를 Table 4에 나타내었다. 부위별 4개 성분의 합계량은 과육이 1.90 mg/g, 씨가 26.54 mg/g으로 씨에서 과육에 비해 14배 높게 나타났다. 구성성분의 분포에서는 과육과 씨 모두 schizandrin이 양적으로 많이 검출되었다. 과육에서는 schizandrin의 양이 0.67 mg/g으로 합계량의 35.3%를 차지하였고 씨에서도 9.41 mg/g으로 35.5%를 차지하였다. 다음 양적으로 많은 성분은 과육에서는 합계량의 27.9%를 차지하는 schizandrin B이었고 씨에서는 γ-schizandrin이 31.8%로 다음을 이었다. 이의 영향으로 씨를 포함한 오미자에서는 schizandrin의 함량이 2.80 mg/g로 가장 많았고 schizandrin B와 γ-schizandrin이 동일하게 1.78 mg/g으로 다음으로 높게 나타났다. Table 1의 부위별 수분함량을 반영하여 각 일반성분을 건물량(dry base)으로 환산하고 과육과 씨앗량의 합산이 전체 오미자의 함량과 동일하다고 한다면, 과육과 씨앗의 비율은 8:2로 계산된다. 이를 Table 4의 결과에 대입하면 리그란 성분의 합계는 계산치가 6.83 mg/g로 실측치 6.23 mg/g과 유사하다. Schizamdrin, schizandrol B, schizamdrin B, γ-schizandrin의 계산치 역시 각각 2.42, 0.74, 1.61, 2.06 mg/g으로 분석치와 크게 벗어나지 않았으며 과육보다 씨에서 5-18배 높게 나타났다. 정유성분 외에 리그난 성분들도 과육보다는 주로 씨에 함유되어 있어 좋은 자원으로서 잠재력을 지니고 있다고 판단된다. 그러나, 현재까지는 오미자 씨의 회수, 안전한 보관 및 운반, 새로운 가공 방법의 개발 등이 뒤따라야 산업에서 이용될 수 있는 한계도 가지고 있다.
Table 4.
Content (mg/g) of major lignans in different parts of S. chinensis berry
|
|
Whole |
Pulp |
Seed |
| Schizamdrin |
2.80±0.291),b2) |
0.67±0.10a |
9.41±0.41c |
| Schizandrol B |
0.87±0.09b |
0.23±0.07a |
2.76±0.24c |
| Schizamdrin B |
1.78±0.09b |
0.53±0.10a |
5.93±0.09c |
| γ-Schizandrin |
1.78±0.10b |
0.47±0.05a |
8.44±0.44c |
| Total |
6.23±0.57b |
1.90±0.32a |
26.54±1.18c |
Download Excel Table
4. 요약
오미자 (Schisandra chinensis Baillon)는 다양한 생리활성을 지니고 있어 오래전부터 약용 및 식용으로 이용되어왔다. 식품 분야 측면에서 오미자는 가공과정에서 씨(seed)가 부산물로 얻어지고 있으나 이에 대한 활용도는 낮은 편이다. 따라서 본 연구에서는 오미자 씨의 활용성 증대하기 위해 오미자를 부위별(과육과 씨 부위)로 구분하여 일반성분, 정유성분 및 주요 리그난 성분들의 함량을 비교 조사하였다. 일반성분으로서 건조 오미자(whole berry)의 조지방 함량은 27.97%이었고, 과육(21.84%)보다 씨(38.16%)에서 함량이 높았고, 조단백질 함량도 씨 부위(18.09%)가 과육(3.53%)에 비해 약 5.1배 높았다. 건조한 오미자 열매 전체의 정유함량은 1.33%이었고 과육(0.91%)보다 씨 (2.65%)에서 약 2.9배 정도 높았다. 오미자의 정유에서 동정된 62종의 성분들 중에서 부위에 관계없이 가장 많이 검출된 성분은 α-ylangene이었고, 과육에서 α-ylangene의 함량은 195.08 μg/g이었으나 씨에서는 6,687.76 μg/g이었다. 그 다음으로 cuparene이 과육에서 77.46 μg/g, 씨에서 2,098.72 μg/g, alloaromadendrene은 과육에서 106.20 μg/g, 씨에서 708.96 μg/g이 검출되어 씨에서 각각 27.1배 및 6.7배 많이 함유되어 있었다. 특히 여러 가지 약리활성을 지니고 있는 것으로 밝혀진 nootkatone의 경우 과육에서는 60.83 μg/g이 검출된 반면 씨에서는 과육보다 약 27배 많은 1,645.66 μg/g이 검출되었다. 리그난 성분인 schizandrin, schizandrol B, schizandrin A 및 γ-schizandrin도 과육보다는 씨에 5-18배 많이 함유되어 있어 식품 원료로서 활용잠재력을 가지고 있었다.
Acknowledgements
This study is based on the first author’s (Kim MS) MS dissertation, 19-46 (2017).
References
Adams RP. Identification of Essential Oil Components by Gas Chromatography/Mass Spectrography.Allured Publishing Corporation. Carol Stream, IL, USA: 1995

AOAC Official Methods of Analysis.Vol416thed Association of Official Analytical Chemists. Arlington, VA, USA. p p. 1-45 1995;

Chen X, Zhang Y, Zu Y, Fu Y, Wang W. Composition and biological activities of the essential oil from
Schisandra chinensis obtained by solvent-free microwave extraction. LWT-Food Sci Technol. 44:2047-2052 2011;


Chun JN, Cho MS, So IS, Jeon JH. The protective effects of
Schisandra chinensis fruit extract and its lignans against cardiovascular disease: A review of the molecular mechanisms. Fitoterapia. 97:224-233 2014;



Halstead CW, Lee S, Khoo CS, Hennell JR, Bensoussan A. Validation of a method for the simultaneous determination of four schisandra lignans in the raw herb and commercial dried aqueous extracts of
Schisandra chinensis (Wu Wei Zi) by RP-LC with DAD. J Pham Biomed Anal. 45:30-37 2007;



Hancke JL, Burgos RA, Ahumada F.
Schsandra chinensis (Turcz) Baill. Fitoterapia. 70:451-471 1999;


Jang JG, Park CG, Kim YG, Kim JY, Kim HJ, Kim CS, Kim GC, An BG, Jeong SS, Kim JM, Choi SR. Five-Flavor Magnolia Vine. Rural Development Administration. 11-1390000-004561-14 2018

Jha AK, Gairola S, Kundu S, Doye P, Syed AM, Ram C, Kulhari U, Kumar N, Murty US, Sahu BD. Biological activities, pharmacokinetics and toxicity of nootkatone: A review. Mini Rev Med Chem. 22:2244-2259 2022;



Kang KC, Park JH, Baek SB, Jhin HS, Rhee KS. Optimization of beverage preparation from
Schizandra chinensis Baillon by response surface methodology. Korean J Food Sci Technol. 24:74-81 1992;

Kim KS, Kang SS, Ryuj SN. Quantitative analysis of lignan from fruits of
Schizandra chinensis. Kor J Pharmacogn. 33:272-276 2002;

Kim KS, Park CG, Bang JK. Varietal and yearly differences of lignan contents in fruits of collected lines of
Schizandra chinensis Baillon. Korean J Medicinal Crop Sci. 11:71-75 2003;

Kim KS, Song JS, Bang JK. Changes in volatile compounds of
Schizandra chinensis fruits according to drying and extracting methods. Korean J Medicinal Crop Sci. 8:49-57 2000;

Kim MJ, Park EJ. Antioxidative and antigenotoxic effect of
Schzandra chinensis B. extracted with water at various temperatures. Cancer Prev Res. 17:128-140 2012;

Kim OC, Jang HJ. Volatile components of
Schizandra chinensis Bullion. Agric Chem Biotechnol. 37:30-36 1994;

Lee HJ, Kim CY. Simultaneous determination of nine lignans using pressurized liquid extraction and HPLC-DAD in the fruits of
Schisandra chinensis. Food Chem. 120:1224-1228 2010;


Lee JS, Lee SW. A study on the compositions of the total amino acids and free amino acids in parts of Omija (
Schizandra chinensis Baillon). Korean J Dietary Culture. 4:181-184 1989;

Lee JY, Min YK, Kim HY. Isolation of antimicrobial substanse from
Schizandra chinensis Baillon and antimicrobial effect. Korean J Food Sci Technol. 33:389-394 2001;

Lee KS, Lee BH, Seong BJ, Kim SI, Han SH, Kim GH, Park SB, Kim HH, Choi TY. Chemical components composition on different parts of fruit in
Schizandra chinensis Baillon. J Korean Soc Food Sci Nutr. 45:851-858 2016;


Lee YJ, Lee HJ, Kim YS, Ahn CB, Shim SY, Chun SS. Quality characteristics of sponge cake with Omija powder. J Korean Soc Food Sci Nutr. 41:233-238 2012;


Li XN, Cui H, Song YQ, Liang YZ, Chau FT. Analysis of volatile fractions of
Schisandra chinensis (Turcz) Baill. using GC-MS and chemometric resolution. Phytochem Anal. 14:23-33 2003;



Liu CJ, Zhang SQ, Zhang JS, Liang Q, Li DS. Chemical composition and antioxidant activity of essential oil from berries of
Schisandra chinensis (Turcz.) Baill. Na Prod Res. 26:2199-2203 2012;



Mocan A, Schafberg M, Crisan G, Rohn S. Determination of lignans and phenolic components of
Schisandra chinensis (Turcz.) Baill. using HPLC-ESI-ToF-MS and HPLC-online TEAC: Contribution of individual components to overall antioxidant activity and comparison with traditional antioxidant assays. J Funct Foods. 24:579-594 2016;


National Institute of Standards and Technology (NIST). NIST Chemistry WebBook: Standard reference database no 69. Available from
https://webbook.nist.govAccessed Jul. 1, 2023

Oh JK, Kim BJ, Shin YO, Jung HJ. The efficacy of sports drink by using
Schizandra chinensis. Korean J Phys Educ. 41:617-633 2002;

Panossian A, Wikman G. Pharmacology of
Schisandra chinensis Bail.: An overview of Russian research and uses in medicine. J Ethnopharmacol. 118:183-212 2008;



Ryu IH, Kwon TO. The antioxidative effect and ingredients of oil extracted from
Schizandra chinensis seed. Korean J Medicinal Crop Sci. 20:63-71 2012;


Schultz TH, Flath RA, Mon TR, Eggling SB, Teranishi R. Isolation of volatile components from a model system. J Agric Food Chem. 25:446-449 1977;


Sohn HJ, Bock JY, Baik SO, Kim YH. Determination of lignan compounds in fruits of
Schizandra chinensis Baillon by capillary-GC (FID). J Korean Agric Chem Soc. 32:350-356 1989;

Sowndhararajan K, Kim TH, Kim HY, Kim SM. Evaluation of proximate composition, bioactive lignans and volatile composition of
Schisandra chinensis fruits from Inje and Mungyeong, Republic of Korea. J Appl Pharm Sci. 6:001-008 2016;


Szopa A, Barnaś M, Ekiert H. Phytochemical studies and biological activity of three Chinese Schisandra species (
Schisandra sphenanthera, S
chisandra henryi and
Schisandra rubriflora): Current findings and future applications. Phytochem Rev. 18:109-128 2019;


Teng H, Lee WY. Antibacterial and antioxidant activities and chemical compositions of volatile oils extracted from
Schizandra chinensis Baill. seed using simultaneous distillation extraction method, and comparision with soxhlet and microwave extraction. Biosci Biotechnol Biochem. 78:79-85 2014;



Wei H, Sun L, Tai Z, Gao S, Xu W, Chen W. A simple and sensitive HPLC method for the simultaneous determination of eight bioactive components and fingerprint analysis of
Schisandra sphenanthera. Anal Chim Acta. 662:97-104 2010;



Zhang F, Zhai J, Weng N, Gao J, Yin J, Chen W. Comprehensive review of the main lignan components of
Schisandra chinensis (North Wu Wei Zi) and
Schisandra sphenanthera (South Wu Wei Zi) and the lignan-induced drug-drug interactions based on the inhibition of cytochrome P450 and P-glycoprotein activities. Front Pharmacol. 13:816036 2022;