1. 서론
황을 함유한 수용성 비타민인 biotin은 ureido 고리와 valeric acid 측쇄를 포함한 thiophene 고리가 결합한 형태로 존재하며 vitamin H 또는 vitamin B7으로도 불린다(Gropper 등, 2018). 자연에서 biotin은 자유형이나 lysine과 결합한 형태인 biocytin 형태로 존재하며, 단백질과 결합한 형태는 체내에 흡수되기 위해 biotinidase에 의한 분해가 필요한 것으로 알려져 있다(Eitenmiller 등, 2007). 또한, biotin은 4개의 carboxylase에 대해 보조인자로 작용한다고 알려져 있다(Said, 2012). 뿐만 아니라, biotin은 조효소로서 포도당 및 지질 합성에 주요한 역할을 하며, 카복실화 및 탈카복실화 반응을 통한 CO2 운반 및 체내의 다양한 생화학 반응을 조절하는 것으로 보고되어 있다(Wolf 등, 1997). 한국인의 1일 biotin 충분 섭취량은 성인 기준으로 30 μg으로 설정되어 있으며, 다양한 식품과 건강 기능식품을 통해 이 섭취량을 충족할 수 있다(KNS, 2015). 비오틴의 주요 급원 식품으로 동물의 간, 난황, 곡류, 대두, 견과류 등이 있으며, 식품 내에서 biotin은 유리형 또는 lysine 잔기에 ε-amino기가 결합된 상태로 존재한다(Gropper 등, 2018). Biotin의 결핍은 선천성 질환이 있는 유아에게 발생할 수 있으며, 우울증, 탈모, 거식증 등의 증상을 나타낼 수 있다(Eitenmiller 등, 2007). 그러나 체내 비오틴 회로에 의해 필요량이 합성되며 대부분의 식품에 미량 존재하므로 결핍 증상이 거의 나타나지 않는 것으로 알려져 있다(Pacheco-Alvarez 등, 2002).
식품은 비타민, 당분, 단백질, 지질, 기타 미네랄 화합물 등의 복잡한 혼합물로써, 분석하고자 하는 성분을 추출하는 방법에는 증류, 냉압착, 초음파 및 초임계 추출 등이 있다. 이 중 초음파 추출은 식품에 함유된 물질의 손실과 추출 시간 등을 줄이는데 용이한 방법으로 알려져 있다(Chemat 등, 2008). 식품에서 비오틴은 유리형뿐만 아니라, 단백질과 공유결합을 하고 있으며, 유리형을 추출하기 위해서는 열 가수분해를 실시하기도 한다(Lahely 등, 1999). 그 외에도 수용성 비타민의 추출을 위해서 효소처리를 하기도 한다. 이전 연구에서 비타민 B1의 추출을 위해 takadiastase 및 papain을 처리(Blake, 2007)하기도 했으며, Pakin 등(2004)은 비타민 B5 추출에 pepsin, pantetheinase 및 alkaline phophatase를 사용하였다.
여러 연구에서 비오틴은 열을 가하거나 냉동 상태에서도 안정성을 유지하는 것으로 보고되고 있다. Teaguel 등(2004)에 의하면 20°C에서 2개월 보관된 냉동식품의 biotin 함량은 매우 안정적이라고 하였다. 또한 biotin은 두류의 presoaking 및 조리에 의한 침출이 발생하지 않은 것으로 보고하였다(Hoppner와 Lampi, 1993). 식품 내에 존재하는 biotin은 조리에 의한 손실은 적지만 단백질과 결합한 형태로 존재하기 때문에 유리형의 biotin만을 추출하는 것은 어려운 실정이다. 1970년대에 개발된 avidin-binding assay는 avidin과 biotin의 특이적 결합을 이용한 biotin의 분석법으로, 초기에는 동위원소 희석법을 통해 체액 및 조직 등의 임상 연구에 주로 사용되었으나, 식품 연구에는 적용이 어려운 것으로 알려져 있다(Eitenmiller 등, 2007). 본 연구는 동물성 식품 내 biotin의 효율적인 추출 방법을 개발하고, 기존 추출법을 개선하기 위하여 수행되었다. 이를 위해 육류(beef, foreshank), 어패류(mackerel) 및 난류(yolk, raw)를 대상으로 초음파기와 고압멸균기를 사용한 추출방법 및 효소 처리 유무에 따른 다양한 추출 조건을 통해 biotin의 함량을 비교하였다.
2. 재료 및 방법
본 연구에 사용된 시료 중 육류와 난류는 농촌진흥청에서 제공받았으며, 어패류는 부산광역시 대형마트에서 구입하여 분석에 사용하였다. 농촌진흥청에서 제공받은 육류와 난류의 시료는 다소비 및 다빈도 식품을 대상으로 수집된 시료로, 세척 후 세절하여 액체질소로 급속냉동한 뒤 마쇄하여 배송되었다. 대형마트에서 구입한 어패류 시료 또한 세척 후 균질화를 위해 세절하였으며, 모든 시료는 -20°C에서 보관하여 분석에 사용하였다. Biotin의 분석법 검증을 위해서는 미국 국립표준기술소(National Institute of Standards and Technology, NIST, Gaithersburg, MD, USA)의 표준물질(standard reference material, SRM)인 SRM 1849a(Infant/adult nutritional formula)를 구입하여 사용하였다. 또한, 내부분석품질관리를 위한 시료는 시중에 판매되는 분유(infant formula, Imperial dream XO, Namyang, Seoul, Korea)를 구매하여 사용하였다. 분석의 정밀도를 확인하기 위해 사용한 biotin의 표준품은 Sigma-Aldrich사(St. Louis, Mo, USA)에서 구매하였으며, 시료 전처리에 사용한 sodium phosphate monobasic monohydrate, sodium phosphate dibasic dihydrate, sodium hydroxide는 Sigma-Aldrich사, methanol(Cat. No. 34860)은 Honeywell Burdick & Jackson사(Muskegon, MI, USA)에서 구매하였다. 또한, 이동상으로 사용된 o-phosphoric acid 85%(Cat. No. 1.00552)와 acetonitrile (Cat. No. 1.00030)은 Merck사(Darmstadt, Germany)에서 구매하여 실험에 사용하였다.
효소처리를 하지 않은 추출 용액은 sodium phosphate monobasic monohydrate 8.07 g과 sodium phosphate dibasic heptahydrate 18.36 g을 3차 증류수에 용해시키고 2 M sodium hydroxide를 이용해 pH 7.0으로 조정 후 1 L로 정용하여 제조하였다. Pepsin 효소처리에 사용된 추출용액은 0.15 M sodium phosphate buffer 1 M HCl를 이용해 pH 4.0으로 조정하여 1 L로 정용한 후 실험에 사용하였다. 이동상으로 사용되는 0.1% phosphoric acid는 volumetric flask에 o-phosphoric acid 1.176 mL를 넣어 3차 증류수로 용해한 후 1 L로 정용하여 제조하였다. 0.1% phosphoric acid와 이동상인 acetonitrile과 3차 증류수는 감압 여과 후 high performance liquid chromatogram(HPLC)/ultraviolet detection(UVD)의 분석에 사용하였다.
본 연구에서 사용한 고압멸균기를 이용한 biotin 추출법은 Joseph 등(2016)의 연구를 응용하여 실험하였다. 먼저 균질화된 시료 0.5-5 g을 50 mL conical tube에 칭량하여 추출용매 25 mL를 가한 후 5분간 sonication을 진행하였다. 이후 고압멸균기(autoclave)를 이용하여 121°C에서 25분간 추출하고 방랭시킨 다음 추출용매 25 mL를 넣어 1,610 ×g에서 10분간 원심분리하였다. 원심분리된 시료는 상등액만 여과지(Whatman No.2, GE Healthcare, Amersham Place, UK)로 여과하여 맑은 추출액을 얻어 실험에 사용하였다.
초음파기를 이용한 biotin 추출법은 Shin 등(2016)의 연구를 변형하여 실험하였다. 균질화된 시료의 동일한 양을 50 mL conical tube에 칭량하여 추출용매 50 mL를 가하여 60 Hz 조건의 초음파기를 이용하여 80°C에서 30분간 추출하였다. 추출물을 방랭시킨 후 1,610 ×g에서 10분간 원심분리하여 상등액을 여과지로 여과한 다음 맑은 추출액을 실험에 사용하였다.
식품 내에 여러 화합물과 결합한 biotin을 유리시키기 위해서 pepsin 수용액을 처리하여 추출을 진행하였다. Pepsin 수용액은 pepsin을 0.15 M sodium phosphate buffer(pH 4.0)에 녹인 후 40,000 U 농도로 제조하여 실험에 사용하였다. 균질화된 시료 0.5 g-5 g을 50 mL conical tube에 칭량하고 pepsin을 처리할 시료는 pH 4.0의 추출용매 24 mL를 가한 후 고압멸균 추출법 또는 초음파 추출법을 이용하여 추출을 진행하였다. 추출 후에는 실온에서 방냉시키고 각 효소 수용액을 1 mL씩 가하여 37°C의 항온수조에서 3시간 반응시킨 후 5분간 추출액을 초음파 처리하였다. 반응시간 종료 후에는 pH 7.0의 추출용매를 25 mL 가하고 1,610 ×g에서 10분간 원심분리하였다. 원심분리된 시료의 상등액은 여과지로 여과하여 실험에 사용하였다.
맑은 추출액 중 biotin을 농축 및 정제를 위해 biotin immunoaffinity column(Easi-Extract Biotin, r-Biopharm, Glasgow, UK)을 이용하였으며 제공된 사용법을 응용하여 진행하였다. Immunoaffinity column을 사용하기 전 실내 온도에서 30분간 방치 후 column 내의 충진액을 완전히 제거하였다. Phosphate buffer saline(PBS) 5 mL를 흘려준 후 고압멸균기 및 초음파기 추출법에 따라 얻은 맑은 추출액 10 mL를 2.5 mL씩 네 번에 걸쳐 흘려 추출물 중의 biotin을 column에 흡착시켰다. 불순물 제거를 위해 PBS 5 mL와 3차 증류수 5 mL를 흘려주었다. Column에 흡착된 biotin 용출은 methanol 4 mL를 주입하여 시험관을 이용하여 수집하였다. 수집된 용액은 질소농축기(MG-2200, EYELA, Tokyo Rikakikai Co., Tokyo, Japan)로 휘발시키고 3차 증류수 0.5 mL로 재용해하여 분석에 사용하였다.
Biotin 표준품을 3차 증류수에 용해하여 96 μg/mL의 농도로 제조하여 이를 표준원액으로 사용하였다. 검량선 작성을 위해 biotin의 표준 원액은 3차 증류수로 희석하여 0.015-0.960 μg/mL의 농도로 제조하여 분석에 사용하였다.
Biotin 분석에는 HPLC/UVD(Chromaster 5000 series, Hitachi, Tokyo, Japan)를 사용하였다. HPLC/UVD 분석 시 사용한 column은 Kinetex Phenyl-Hexyl(150×4.6 mm, 2.6 μm, Phenomenex, Torrance, CA, USA)이었으며 column oven 온도는 40°C로 설정하였다. Detector는 ultra violet detector를 사용하여 200 nm에서 검출하였으며 injection volume은 100 μL로 진행하였다. 이동상의 gradient 조건은 Table 1과 같다.
| Time (min) | Flow rate (mL/min) | 0.1% phosphoric acid (%) | 100% acetonitrile (%) | 80% acetonitrile (%) |
|---|---|---|---|---|
| 0 | 0.6 | 90 | 10 | 0 |
| 18 | 0.6 | 90 | 10 | 0 |
| 21 | 0.6 | 0 | 0 | 100 |
| 26 | 0.6 | 0 | 0 | 100 |
| 29 | 0.6 | 90 | 10 | 0 |
| 32 | 0.6 | 90 | 10 | 0 |
본 연구에서 사용된 biotin 분석법에 대한 정확성 및 정밀성 검증은 AOAC(2002)에 준하여 실시하였다. 정확성 검증은 미국국립표준기술소(National Institute of Standards and Technology, NIST)의 표준인증물질인 SRM 1849a(infant/adult nutritional formula)를 이용하여 제시된 인증값과 분석한 값을 비교한 후 회수율(%)로 산출하여 확인하였다. 정밀성 검증을 위한 내부분석품질관리물질은 시판 분유를 사용하였으며, 상대표준 편차(relative standard deviation, RSD)를 산출하여 반복성(repeatability) 및 재현성(reproducibility)을 평가하였다. 검출한계(LOD)는 시료 중 존재하는 분석대상물질의 검출 가능한 최소량을 말하며, 정량한계(LOQ)는 정량이 가능한 최저 농도를 말한다. 검출한계와 정량한계는 signal to noise(S/N)의 평균값에 표준편차를 각각 3.3과 10으로 곱한 값을 더하여 산출하였다.
또한, 본 연구에서는 소량 첨가 회수율을 알아보았으며, AOAC (2002)에서 제시한 방법에 따라 검증하였다. 내부분석품질관리 물질인 시판 분유에 biotin 표준 용액을 0.1 μg/g의 농도로 첨가하여 추출한 후 회수율(%)을 산출하였으며, AOAC(2002)에서 제시하는 수용 가능한 범위에 충족하는지 확인하여 검증하였다.
3. 결과 및 고찰
동물성 식품 내 biotin의 효율적인 추출법을 확인하고자 육류, 어패류 및 난류 중 각각 1종류의 시료를 선정하여 4가지 추출법에 대한 biotin의 함량을 분석하였다. 분석에 사용된 시료는 biotin 함량이 높은 것으로 알려진 식품으로(MEXT, 2015), 육류는 소고기의 앞다리살(foreshank), 난류는 달걀의 난황(yolk), 어패류는 고등어(mackerel)로 선정하였다. 선정된 시료의 추출방법에 따른 biotin 함량은 Table 2에 나타내었다. Pepsin 효소 처리한 고압멸균 추출법의 biotin 함량은 소고기의 앞다리살은 1.523 μg/100 g, 고등어는 2.130 μg/100 g, 난황은 124.435 μg/100 g으로 유의적으로 높은 biotin 함량을 보였다. Pepsin은 대부분의 peptide 결합을 분해할 수 있는 것으로 알려져 있으며, 동물성 식품에서 단백질과 결합된 비타민 B12 분석에 사용된 연구가 보고되어 있다(Blanco와 Blanco, 2017; Mun 등, 2018). Lahely 등(1999)의 연구에서는 소고기의 간에서 유리형 biotin을 분석하기 위해 고압멸균 처리가 필요하다고 보고하였다. 따라서 본 연구에서 동물성 식품에 pepsin 처리 시 biotin 함량이 높게 나타난 것은 고압멸균 과정에서 유리형 biotin이 용출되었기 때문인 것으로 판단된다. 따라서 추후 실험에서는 육류, 어패류 및 난류의 다양한 시료에 고압멸균 추출법을 적용하여 효소 유무에 따른 biotin 함량 차이를 비교하였다.
육류 7종에 대한 biotin 함량 분석 결과는 효소 처리 전후에 따른 고압멸균 추출을 실시하여 Table 3에 나타내었다. 소고기의 앞다리(foreshank), 목심(chuck), 사태(shank)와 닭고기 다리(leg)의 biotin 함량은 pepsin 효소 처리를 한 경우에 각각 1.523 μg/100 g, 1.038 μg/100 g, 1.101 μg/100 g, 1.979 μg/100 g으로, 부위별로 효소 처리 전후의 biotin 함량에 유의적인 차이를 나타내었다. 돼지고기의 뒷다리(ham), 안심(tenderloin)과 닭고기의 가슴(breast)은 효소처리 전후에 따른 차이를 나타내지 않았으며, Kwon 등(2020)의 biotin 함량 연구에 따르면 소고기의 앞다리는 0.225 μg/100 g이었으며, 사태는 0.223 μg/100 g으로 보고하여 본 연구에서 분석한 biotin 함량이 기존 연구에 비해 높게 나타났다. 단백질 함량이 높은 동물성 식품 중 비타민 B12는 단백질과 결합한 형태로 존재하기 때문에 단백질 분해효소인 pepsin을 이용하여 분석하는 것으로 알려져 있다(Mun 등, 2018). 본 연구 결과 중 일부 시료에서는 pepsin 처리로 인하여 biotin 함량이 높게 나타났다. Pepsin은 대표적인 단백질 가수 분해 효소로서 방향족 아미노산을 포함하는 결합을 선택적으로 분해하는 경향이 있으나, 대부분의 경우 모든 peptide 결합을 분해하는 것으로 알려져 있다(Blanco와 Blanco, 2017). 따라서 본 연구에서 육류에 포함된 단백질과 biotin의 결합이 pepsin 효소에 의해 유리형 biotin으로 분해된 것으로 생각되며, pepsin 처리를 이용하여 추출하는 방법이 정확한 biotin 함량을 분석하는 데 도움이 될 것으로 사료된다.
어패류 6종에 대해 효소처리 여부에 따라 고압멸균 추출법으로 biotin 함량을 분석한 결과는 Table 4에 나타내었다. 분석 결과, 고등어(mackerel), 갈치(hair tail), 문어(giant octopus), 꼬막(cockle)의 biotin 함량이 pepsin 효소 처리 시 유의적으로 높게 나타났다. MEXT(2015)에 따르면 고등어의 biotin 함량은 4.9 μg/100 g으로 보고되었으며, 갈치, 문어 및 꼬막의 함량은 나타나지 않았다. 본 연구에서 분석한 고등어의 함량은 2.130 μg/100 g으로 MEXT(2015)에서 보고한 함량과 차이가 있으나, 이는 생산지 및 계절에 따른 차이로 인해 발생한 것으로 판단된다. 또한, 고등어과는 51종의 다양한 어류가 있기 때문에 어종에 따른 함량 차이가 있을 것으로 보인다. 어패류는 육류와 마찬가지로 단백질 함량이 높은 식품으로 알려져 있으며, MEXT (2015)에 따르면 고등어는 20.6 g/100 g, 갈치는 16.5 g/100 g, 문어는 16.4 g/100 g의 단백질을 함유하고 있는 것으로 보고되어 있다. 이와 같이 단백질 함량이 높은 어패류에서 pepsin은 peptide 결합을 분해하여 일부 어패류의 biotin 추출이 용이해져 함량이 증가한 것으로 사료된다. 따라서 어패류의 biotin 함량을 분석하기 위해서는 pepsin과 같은 단백질 분해효소의 처리가 필요할 것으로 판단된다.
난류는 닭의 난황(raw, boiled), 전란(raw, boiled) 및 메추리의 전란(raw, boiled)을 고압멸균 추출하여 biotin 함량을 분석하여 Table 5에 나타내었다. 닭의 난황(yolk)은 생것과 삶은 것 모두 pepsin 효소를 처리하였을 때 각 124.435 μg/100 g, 127.722 μg/100 g으로 나타나 유의적으로 높은 biotin 함량을 보였다. Kwon 등(2019)이 분석한 난황 생것의 함량은 72.938 μg/100 g이었으며, MEXT(2015)는 65.0 μg/100 g, RDA(2016)는 42.74 μg/100 g으로 보고하였다. 그러나 난백이 섞여 있는 닭의 전란(raw, boiled)과 메추리의 전란(raw, boiled)은 pepsin 처리를 하지 않았을 때 높은 함량을 나타내었다(Machado 등, 2007). 전란의 약 58%를 차지하는 난백은 약 11%의 단백질을 포함하고 있으며, 이러한 난백 단백질은 pH 8.0-9.0의 높은 알칼리 pH에서 더 높은 용해도를 나타내는 것으로 보고되어 있다(Sponton 등, 2017). 본 연구에서 사용한 pepsin의 최적 활성 pH는 pH 2.0-4.0인 것으로 알려져 있다. 그러나 실험에 사용된 난백이 포함된 전란에서는 pH 4.0의 추출 용매가 사용되며, 이로 인해 시료의 pH가 상승하여 pepsin 효소의 활성이 저하된 것으로 생각된다. 또한, 날달걀 중 biotin은 난백의 avidin과 비가역적인 결합을 하는 것으로 보고되어 있어, 달걀에서 biotin의 추출을 방해할 수 있을 것으로 판단된다(White와 Whitehead, 1987). 이러한 pepsin의 활성 저하 및 avidin과의 복합체 형성은 전란에서 biotin의 추출을 방해할 것으로 생각되며 이를 위한 추가 연구가 필요할 것으로 생각된다. Dhakal 등(2020)의 연구에 따르면 난백을 고압 하에 열처리를 하면 avidin과 biotin의 결합 에너지를 감소시켜 avidin-biotin 결합을 감소시킨다고 한다. 이러한 연구는 조리되지 않은 계란의 비오틴 추출에 적용할 수 있을 것으로 사료된다.
또한, 본 연구에서는 실제 소비자들이 계란을 섭취하는 형태를 반영하여 삶은 계란의 비오틴 함량도 함께 측정하였다. 본 연구에서 삶은 계란의 비오틴 함량은 pepsin 처리 시 유의적으로 증가하는 것으로 나타났으나, 메추리알을 익힌 경우에는 비오틴 함량이 소폭 감소하였다. 농촌진흥청에서 발간한 국가표준식품성분표(RDA, 2021)에 따르면, 메추리알은 생것에 비해 익혔을 때 비오틴의 함량이 감소하였으며, 이는 본 연구 결과와 유사한 것으로 나타났다. 본 연구 결과에 따르면, 계란은 메추리알에 비해 비오틴 함량이 높고, 익힐 경우 비오틴 함량이 증가하므로 일상 식이에서 비오틴 섭취에 유용할 것으로 생각된다.
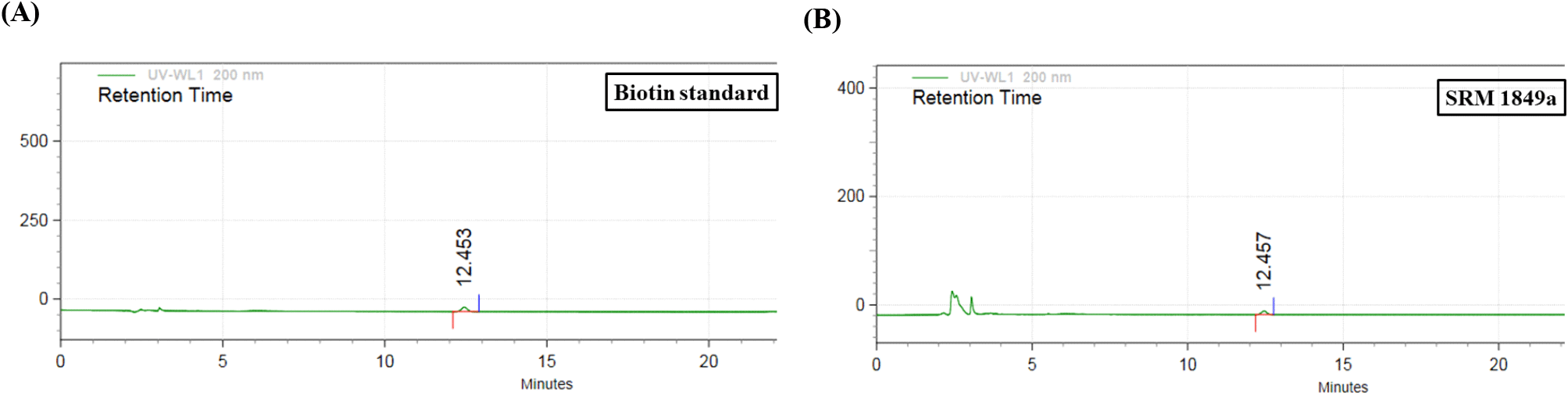
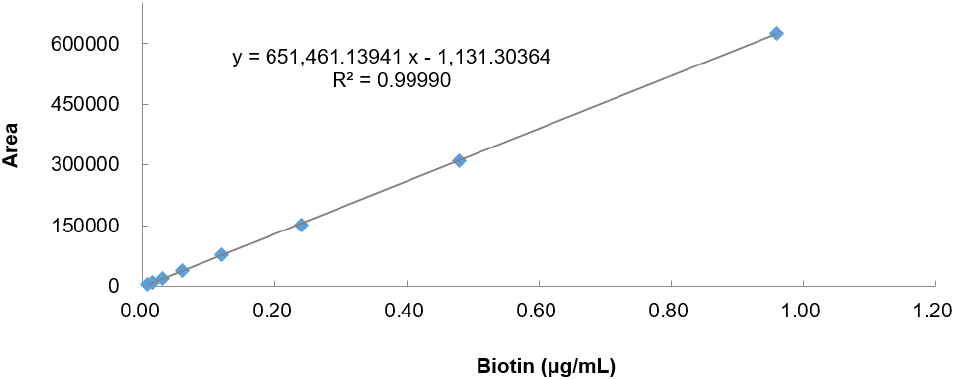
본 연구에서 특이성을 검증하기 위하여 biotin 표준품과 SRM 1849a peak의 retention time을 비교하여 Fig. 1에 나타내었다. Biotin 표준품 peak의 retention time은 12.453분으로 나타났으며 SRM 1849a peak는 12.457분에 검출되어 0.004분 차이로 동일 물질임을 확인할 수 있었다. Biotin 표준물질을 3차 증류수에 9.600 μg/mL 농도로 제조하여 0.960, 0.480, 0.240, 0.120, 0.060, 0.030, 0.015 μg/mL의 7개 농도로 희석한 후 측정하여 검량선으로 나타내었다(Fig. 2). Biotin 표준물질의 농도와 area 간의 검량선 수식은 y = 651461.13941x - 1131.30364이며, 상관계수(R2)는 0.999 이상으로 직선성이 우수한 것을 확인하였다. 또한 본 실험에서는 정확성을 평가하기 위해 표준참고물질(SRM 1849a)의 biotin 함량을 분석하였으며, 효소 처리 전의 회수율은 100.369%, 효소 처리 후의 회수율은 98.752%를 나타내었다(Table 6). AOAC(2002)에 따르면 분석대상물질의 농도가 10 μg/g 수준일 경우 유효한 회수율 범위는 85-110%라고 제시되어 있으며, 본 연구에서 사용된 SRM 1849a의 biotin 함량 인증값이 1.99±0.13 μg/g인 것을 고려할 때, 본 실험의 회수율은 AOAC(2002)의 기준을 충족하며, 수용 가능한 회수율 범위 내에 속하는 것으로 나타났다.
본 실험에서 사용한 시험법의 정밀성 검증을 위하여 시판 분유를 이용하여 하루에 독립적으로 5회 3반복씩 분석하여 반복성(repeatability)을 구하였으며, 5일간 하루에 1회씩 3반복으로 실험하여 재현성(reproducibility)을 계산하여 Table 7에 나타냈다. AOAC(2002)에서 제시한 1 μg/g 농도에서 반복성 및 재현성의 수용 가능한 상대표준편차(relative standard deviation, RSD) 수준은 각각 8%, 16%로, 본 연구의 정밀성은 우수한 것으로 판단된다. 또한, 본 연구의 검출한계(limit of detection, LOD) 및 정량한계(limit of quantification, LOQ)는 Table 8에 나타냈으며, 각 0.009 μg/100 g과 0.024 μg/100 g이었다. 검출한계와 정량한계는 baseline noise와 분석물질의 peak 상대비로 산출하는 signal to noise 비를 이용하여 구하였다. 면역 친화성 컬럼을 사용하여 biotin을 분석한 Kwon 등(2020)은 검출한계 및 정량한계를 0.007 μg/100 g과 0.023 μg/100 g으로 보고하였으며, 이는 본 연구의 검출한계 및 정량한계와 유사하였다. 또한, Wolf 등(1997)의 연구에서 검출한계 및 정량한계는 각각 0.08 μg/100 g, 0.5 μg/100 g이었다, 이전 연구들과 비교하였을 때 본 연구에서 이용한 분석법은 미량 성분인 biotin을 우수하게 검출할 수 있을 것으로 사료된다.
| LOD (limit of detection)1) | LOQ (limit of quantification)2) |
|---|---|
| 0.009 μg/100 g | 0.024 μg/100 g |
비오틴 분석의 소량 첨가 회수율(spike test)은 조제분유를 이용하여 진행하였다(Table 9). Spike test는 농도를 알고 있는 물질에 표준품을 첨가하여 회수율을 계산하여 정확도를 판단하는 것으로, 본 실험에서는 pepsin 처리 전후에 따른 조제분유에 0.1 μg/g 농도의 표준품을 첨가하여 고압멸균 추출을 진행한 후 회수율을 확인하였다. 그 결과 회수율은 pepsin 처리 전과 후에서 각각 95.322%, 96.212%로 나타났다. HPLC를 이용하여 biotin을 분석한 Kwon 등(2020)의 연구에서는 spike test 농도에 따라 회수율이 95-105% 범위로 나타났으며, LC-MS/MS를 이용한 Shin 등(2016)은 99-104%의 회수율을 보였다. 또한, Holler 등(2006)의 연구에 따르면 HPLC-MS/MS를 이용하여 spike test를 진행하였을 때 92-101%의 회수율을 나타내었다. 따라서 본 연구에서 진행한 spike test의 결과는 기존에 보고된 연구와 유사하였으며, 본 연구에서 진행한 추출법은 biotin 추출에 적합한 것으로 생각된다.
4. 요약
HPLC를 이용하여 효소처리 및 추출방법을 달리하여 여러 가지 식품군의 biotin 함량을 분석하였다. 동물성 식품의 육류(beef, foreshank), 어패류(mackerel), 난류(yolk, raw) 중 각 1종을 선정하여 분석을 진행하였으며 모두 pepsin 처리를 진행한 고압멸균 추출법에서 유의적으로 높은 biotin 함량을 보였다. 추후 실험에서는 육류, 어패류, 난류에 대해 pepsin 처리 및 고압멸균기를 이용한 biotin 추출법을 이용하였다. 실험에 사용한 육류 시료 중 소고기의 앞다리(foreshank), 목심(chuck), 사태(shank), 닭고기의 다리(leg)는 pepsin 처리에 따라 biotin이 유의적으로 증가하였으나, 나머지 시료에서는 유의적인 차이가 나타나지 않았다. 어패류의 고등어(mackerel), 갈치(hair tail), 문어(giant octopus), 꼬막(cockle)은 pepsin 처리로 인하여 biotin의 함량이 높게 나타났다. 난류의 경우, 닭의 난황에서는 효소처리에 따른 biotin 함량이 유의적으로 증가하였으나, 닭의 전란과 메추리의 전란에서는 효소처리에 따라 biotin 함량이 증가하지 않았다. 본 연구에서 사용된 biotin 추출법 및 분석법 검증을 진행하였다. Biotin 표준품과 SRM 1849a의 retention time이 일치하는 것을 알 수 있었으며, biotin 표준품의 7개 농도를 분석하여 상관계수(R2)가 0.999 이상으로 나타났다. 또한 정확성 및 정밀성 검증은 AOAC(2002)에서 제시한 범위에 충족하는 것을 확인하였다. 검출한계 및 정량한계는 0.009 μg/100 g과 0.024 μg/100 g으로 나타나 미량으로 존재하는 biotin을 우수하게 검출할 것으로 사료된다. 분석법 검증을 통해 본 연구에서 이용된 biotin 추출 및 분석방법의 신뢰성을 확보할 수 있었으며, 식품 중 미량 존재하는 biotin을 추출하는데 적용 가능할 것으로 판단된다. 따라서 다양한 식품에서 biotin을 효과적으로 추출하기 위해서는 각 식품의 matrix에 따른 효소처리가 필요하며, 이는 식품 중 함유된 biotin의 영양정보를 구축하는 데 활용될 수 있을 것으로 기대된다.