1. 서론
소화 불량이란 상부위장관과 관련하여 주로 발생하는데 음식을 섭취한 후 일어나는 소화 장애 증상으로 이와 같은 위장질환은 전 세계 인구 중 한 번 이상 경험한 경우가 4-5% 정도이다(Bae와 Seo, 2019). 불쾌한 식후 포만감, 불쾌한 조기 만복감 등은 기능성 소화 불량의 한 증상이기도 하다(Lee, 2021).
소화란 섭취한 음식물을 체내 흡수 가능한 단위로 분해하여 흡수하기 쉬운 형태로 변화하는 과정을 말한다. 소화 작용 중 화학적 소화 과정은 고분자의 음식물이 소화효소에 의해 저분자 영양소로 분해하는 것이다. 따라서 소화 기능을 개선하기 위해 소화효소의 활성을 촉진하는 것이 한 방법이다(Ministry of Food and Drug Safety, 2020a). 탄수화물, 단백질 그리고 지방은 3대 영양소이고, 이들의 소화기능 개선을 알아보기 위한 바이오마커는 전분분해효소(α-amylase) 활성, 단백질분해효소(protease) 활성 그리고 지질분해효소(lipase) 활성이고, 이들 소화효소 활성을 알아보는 연구들이진행되고 있다(Lee, 2021; Ministry of Food and Drug Safety, 2020a). 또한 위염(gastritis)과 위장염(gastroenteritis) 등 소화기계통의 질환에 의해 위점막과 장점막이 손상되면 소화불량 및 흡수 불량이 유발될 수 있으므로 위점막과 장점막 염증을 개선하는 것도 소화기능 개선에 도움이 될 것이다(Han 등, 2024; Ministry of Food and Drug Safety, 2020a).
염증반응은 자유라디칼에 의하여 생체 내의 조직이 손상되어 유발되거나 그 외 감염에 의해 발생하는데, 염증반응이 유발되면 대식세포 등이 tumor necrosis factor-α(TNF-α), interleukin(IL)-1β 그리고 IL-6와 같은 염증성 사이토카인을 다량 생성한다(Kang, 2012). Lipopolysaccharide(LPS)는 그람 음성 세균의 세포 표면을 구성하는 물질로 장점막 세포에 염증을 유발시키기 위해 사용되기도 한다(Han 등, 2024; Kim 등, 2024). LPS는 장점막 세포 내 신호전달경로 활성을 통해 nitric oxide(NO) 및 염증성 사이토카인 TNF-α, IL-1β, IL-6 등을 과량 분비하여 염증을 악화시킨다(Han 등, 2024; Kim 등, 2024). 염증반응 촉진 인자들은 여러 질병 유발 및 노화의 원인이 되어 이와 같은 염증반응 억제 물질에 대한 관심은 높아지고 있지만, 단일 성분의 화합물로 된 의약품으로 인한 부작용의 우려도 커지고 있고(Park 등, 2020), 일부 항염증제의 복용은 위장, 신장 등에 부작용을 일으킬 수 있다는 보고가 있다(Kim 등, 2023). 이와 달리 천연물은 많은 성분이 존재하여 부작용이 적다고 알려져 있어, 부작용이 적고 항염증 효과가 우수한 천연물을 발굴하고자 하는 연구들이 진행되어지고 있다(Choi 등, 2020; Han 등, 2024; Lee와 Rhee, 2015; Lee 등, 2023).
기능성 소화불량에 사용하고 있는 소화제도 다빈도 사용으로 무월경증, 여성유방형성, 유즙 분비 증상 등의 이상 반응의 위험성이 보고되어 있다(Kuchay와 Mithal, 2017). 따라서 부작용을 최소화할 수 있으면서, 소화효소들을 활성화하고 장점막에 발생한 염증을 개선할 수 있는 소화에 도움을 주는 천연물 유래 기능성 소재 탐색이 요구되고 있다.
인간의 결장(colon)에서 유래한 Caco-2 세포는 표피와 유사한 형태로 바닥에 부착하여 자라고 이 세포가 분화되면서 형태적, 기능적으로 사람의 소장 상피세포의 특징을 나타내는 것으로 알려져 있다(Park 등, 2021; Pinto 등, 1983). Caco-2 세포는 식품의약품안전처 식품의약품안전평가원에서 발간한 건강기능식품 기능성 평가 가이드에서 장 건강 관련 기능성 확인을 위한 장 상피세포 모델로 제시하고 있고(Ministry of Food and Drug Safety, 2020b), 항염증 소재 발굴 및 염증성 장 질환 개선 소재 발굴을 위한 연구의 세포모델로 사용하고 있다(Chu 등, 2024; Han 등, 2024; Kim 등, 2024; Tu 등, 2016; Yang 등, 2016; Yang 등, 2019).
항염증 및 소화와 관련된 선행 연구와 문헌조사를 통해 무, 배, 맥아, 사과, 대추, 익모초, 황금, 도라지, 더덕, 잔대 그리고 참취를 소화에 도움을 주는 소재 발굴을 위해 선택하였다. 본 연구의 연구진들의 선행 연구에서 도라지, 더덕, 잔대 그리고 참취는 항염증 효과가 있다는 연구 결과들을 제시하였고(Kim 등, 2018; Kim 등, 2021), 익모초와 사과 추출물도 항염증 활성이 있다(Choi 등, 2020; Kim 등, 2021). 맥아, 황금 그리고 대추는 기능성 소화불량 환자에게 한의복합치료로 사용하는 소재이다(Rho 등, 2022). 무는 Helicobacter pylori에 의한 위세포독성 및 IL-8 생성 억제 효과가 있고 더하여 항염증 효과가 알려져 있다(Son 등 2005; Son 등 2006). 배의 효능으로는 예로부터 한방에서 기침, 가래, 천식, 해열, 이뇨, 변비 치료에 상용되어져 왔고(Lee 등, 1975), 우수한 항산화 효과를 가지고 있다(Jiang 등, 2016). 따라서 소화에 도움을 주는 소재를 발굴하기 위해 무, 배, 맥아, 사과, 대추, 익모초, 황금, 도라지, 더덕, 잔대 그리고 참취 추출물을 사용하였다. 이들 11종류의 추출물을 LPS로 자극한 RAW 264.7 대식세포에 처리한 후 과분비 된 NO 생성 억제 효과 및 트립신 활성을 알아보았고, 결과 대추(Ziziphus jujuba Mill.), 익모초(Leonurus japonicus Houtt.), 황금(Scutellaria baicalensis)의 추출물이 과분비 되는 NO와 TNF-α 함량을 감소시켜 뛰어난 항염증 효과가 있었다(Lee 등, 2023). 무, 배, 맥아, 사과, 도라지, 더덕 그리고 잔대는 과분비 된 NO 생성을 억제하였지만, 대추, 익모초 및 황금보다는 과분비 된 NO 생성을 억제하지 못하였다(Lee 등, 2023). LPS로 자극한 RAW 264.7 대식세포에 처리한 후 과분비 된 NO 생성 억제 효과가 가장 뛰어난 것은 11종류의 추출물 중에서 참취 추출물이었고, 과분비 된 TNF-α 생성 억제 효과가 가장 뛰어난 것은 대추, 익모초 및 황금 추출물이었다(Lee 등, 2023). Caco-2 세포에서 과분비된 NO와 염증성 사이토카인 억제는 염증성 장 질환을 개선하여 소화에 도움을 줄 수 있다(Han 등, 2024; Kim 등, 2024). 따라서 Caco-2 세포를 이용한 항염증 효과를 알아보는 소재를 발굴하기 위해 먼저 RAW 264.7 대식세포에서 항염증 효과를 알아볼 수 있다(Kim 등, 2024). 무, 배, 맥아, 사과, 대추, 익모초, 황금, 도라지, 더덕, 잔대 그리고 참취 추출물 중에서 사과 추출물을 제외하고 모두 트립신 활성을 증가시켰지만 배(Pyrus pyrifolia Nakai) 그리고 맥아(malt)가 트립신 활성이 가장 높았다(Lee 등, 2023). 참취 추출물을 선정하지 않은 이유는 항염 효과가 가장 뛰어났고, 트립신 활성도 증가하였지만(Lee 등, 2023), 관능검사에서 적절한 배합비를 찾지 못해 제외하였다. 따라서 배, 맥아, 대추, 익모초 및 황금으로 혼합물을 개발하였고, 이들 혼합물 추출물은 DPPH 라디칼 소거작용이 뛰어나고 LPS로 자극한 RAW 264.7 대식세포에서 과분비 되는 NO 생성을 억제하여 항염증 소재 발굴 가능성을 시사한 보고가 있다(Lee 등, 2023). 그러나 배, 맥아, 대추, 익모초, 황금 그리고 이들 혼합물 추출물의 인간 장 상피세포에서 항염증 효과 및 소화효소 활성에 관한 연구는 거의 없다.
본 연구의 목적은 소화에 도움을 주는 천연소재를 발굴하기 위해서 황금을 포함한 식물 혼합물의 소화효소 활성, 장점막에 대한 염증 개선 효과 및 항산화 효과를 알아보는 것으로 배, 맥아, 대추, 익모초, 황금 그리고 이들 혼합물 추출물이 인체 장 상피세포주(Caco-2) 모델에서 항염증 효과 및 소화효소(트립신, 라이페이스, α-아밀레이즈) 활성에 미치는 영향을 알아보았고, 더하여 항산화 효과도 알아보았다.
2. 재료 및 방법
광주광역시 대형마트에서 배(Pyrus pyrifolia Nakai)와 대추(Ziziphus jujuba Mill.)를 구입하였고, 경상북도 군위(Gunwi, Korea)에서 구입한 맥아(malt), 익모초(Leonurus japonicus Houtt.) 및 황금(Scutellaria baicalensis)은 건조한 제품이었다. 황금의 뿌리와 익모초의 지상부를 사용하였다. 배와 대추는 씻은 후 배의 과심과 대추의 씨를 제거하였고, 껍질 제거 없이 50°C에서 건조한 후 분쇄하여 물 추출물 제조를 위해 시료의 20배인 증류수를 가한 후 shaking incubator(JSSI-100C, JSR, Seoul, Korea)를 40°C로 맞춘 후 24시간 추출하였다. 추출물은 여과한 후 감압농축 하였고, 농축액은 동결건조하여 −20°C에 보관하면서 사용하였다. 배, 맥아, 대추, 익모초 그리고 황금 물 추출물의 동결건조 분말은 각각 PPW, MAW, ZJW, LJW 그리고 SBW라고 하였다. 에탄올 추출물은 분말 시료의 중량의 10배의 에탄올을 가한 후 물 추출물과 동일한 방법으로 추출, 농축 및 동결건조하였고, 동결건조 분말은 각각 PPE, MAE, ZJE, LJE 그리고 SBE라고 하였다. 추출 용매에 따른 생리활성 효과가 다르고, 에탄올과 물은 메탄올, 아세톤, 헥산, 아세톤 등 유기용매에 비해 취급이 안전하여 추출 용매로 주로 사용되고 있어(Chung, 2012; Kim과 Kim, 2020), 본 연구에서도 사용하였다. 배, 맥아, 대추, 익모초 및 황금 건조 분말(PPP, MAP, ZJP, LJP 그리고 SBP)을 Table 1과 같은 비율(w/w)로 혼합한 후(Mixture 1-5) 상기 방법과 동일하게 추출, 여과, 농축 및 동결건조한 동결건조 분말을 Mix1, Mix2, Mix3, Mix4 그리고 Mix5라고 하였다. 혼합물의 에탄올 추출물의 동결건조 분말은 Mix1-E, Mix2-E, Mix3-E, Mix4-E 그리고 Mix5-E라고 하였다.
PPW, MAW, ZJW, LJW, SBW, Mix1, Mix2, Mix3, Mix4, Mix5, PPE, MAE, ZJE, LJE, SBE, Mix1-E, Mix2-E, Mix3-E, Mix4-E, 그리고 Mix5-E(100, 250, 500, 1,000 μg/mL)의 항산화능을 알아보기 위해 2,2-diphenyl-β-picrylhydrazyl(DPPH; Sigma-Aldrich Co., St. Louis, Mo, USA) 라디칼 소거 활성을 측정하였다(Lee 등, 2024). 다양한 농도의 시료와 DPPH(1.5×10−4 M) 용액을 1.5:1 비율로 혼합하여 30분간 반응시킨 후 UV/Visible spectrophotometer(Ultrospec 3000, Pharmacia Biotech, Cambridge, UK)를 사용하여 517 nm에서 흡광도를 측정하였다. 양성대조군으로 1, 2.5, 5, 10, 25, 50, 100 그리고 250 μg/mL ascorbic acid를 같은 방법으로 실험하였다. DPPH 라디칼소거활성은 대조구에 대한 시료 첨가구의 흡광도를 비교하여 [1 - (시료의 흡광도 / 대조구의 흡광도)] × 100에 의하여 %로 나타내었다(Chung 등, 2016).
PPW, MAW, ZJW, LJW, SBW, Mix1, Mix2, Mix3, Mix4, Mix5, PPE, MAE, ZJE, LJE, SBE, Mix1-E, Mix2-E, Mix3-E, Mix4-E, 그리고 Mix5-E 각각 1 mg에 증류수 1 mL 또는 에탄올 1 mL를 첨가하여 시료로 사용하였다. 총폴리페놀 함량은 Folin-Ciocalteau 방법(Singleton 등, 1999)을 변형하여 측정하였다. 희석한 시료 1 mL에 Folin-Ciocalteau 시약(Sigma-Aldrich Co.) 및 10% 탄산나트륨(Na2CO3, Sigma-Aldrich Co.) 용액을 각각 0.5 mL씩 차례로 가하여 실온의 암실에서 1시간 반응시킨 후 흡광도는 UV/Visible spectrophotometer(Ultrospec 3000, Pharmacia Biotech)를 사용하여 760 nm 파장에서 측정하였다. 시료 무첨가구를 대조군으로 하였고, 표준물질로 gallic acid (Sigma-Aldrich Co.)를 0-0.025 mg/mL의 농도로 제조하여 시료의 총폴리페놀 함량을 측정한 것과 같은 방법으로 흡광도를 측정하여 검량선을 작성하였다. 총폴리페놀 함량은 추출물 동결건조 시료 1 g에 대한 mg gallic acid equivalent(GAE)로 나타내었다.
시료 속에 함유된 총플라보노이드 함량은 Lee 등(2012)의 방법에서 일부 변경한 방법으로 측정하였으며 시료는 총폴리페놀 함량 측정을 위해 사용한 것과 동일하다. 희석한 시료 1 mL에 5% NaNO2(Sigma-Aldrich Co.)를 30 μL 첨가한 다음 5분간 실온에서 반응시킨 후, 10% AlCl2(Sigma-Aldrich Co.) 30 μL와 1 M NaOH(Sigma-Aldrich Co.) 200 μL를 혼합한 반응액을 510 nm에서 흡광도(Ultrospec 3000, Pharmacia Biotech)를 측정하였다. 표준물질로 qercetin(Sigma-Aldrich Co.)를 0-2 mg/mL의 농도로 제조하여 시료와 동일한 방법으로 흡광도를 측정하여 검량선을 작성하였으며, 총플라보노이드 함량은 추출물 동결건조 시료 1 g에 대한 mg quercetin equivalent(QE)로 나타내었다(Lee 등, 2012).
인간의 결장(colon)에서 유래한 Caco-2 세포는 한국세포주은행(Seoul, Korea)에서 구입하여 사용하였다. Minimum Essential Medium(MEM; WelGene Co. Daegu, Korea) 배지에 10% 비활성화 우태아혈청(fetal bovine serum, FBS; WelGene Co.) 용액 및 1% penicillin과 streptomycin(PEST; WelGene Co.)을 더한 배지를 Caco-2 세포에 첨가한 후 배양기(BB 15, ThermoFisher Scientific, Waltham, MA, USA)에서 배양하였다(Kim 등, 2024). 배양기의 조건은 37°C이고 5% CO2가 공급되었다.
세포독성을 알아보기 위해 Caco-2 세포(1×104 cells/well)를 96-well plate에 분주하여 3일 동안 배양한 후, FBS가 함유되지 않은 MEM 배지(SFM배지)로 교체하여 2시간 더 배양하였다. 시료를 다양한 농도로 24시간 동안 처리하였다. 5 mg/mL 3-(4,5-dimethylthiazol-2-yl)-2,5-dipheylterazolium bromide(MTT; Sigma-Aldrich Co.) 용액과 SFM 배지를 1:10의 비율로 섞은 배지를 well당 100 μL를 첨가하여 4시간 동안 반응시켰다(Lee 등, 2023). MTT를 환원시켜 생성된 formazan을 남기고 배지는 완전히 제거한 다음 dimethyl sulfoxide(DMSO; Sigma-Aldrich Co.)를 100 μL씩 첨가하고, 30분 후 용해한 시료를 microplate reader(AMR-100, Allsheng Co., Ltd., Hangzhou, China)기를 사용하여 570 nm에서 흡광도를 측정하였고, DMSO를 blank로 사용하였다(Lee 등, 2023). 시료 처리군의 흡광도값을 대조군의 흡광도값으로 나눈 후 100을 곱한 %을 세포 생존율로 나타내었다.
Caco-2 세포(5×105 cells/well)를 24-well plate에 분주하여 7일 동안 배양하였다. NO 및 TNF-α 생성량 측정을 위해 SFM 배지로 교체하여 2시간 동안 더 배양한 후 시료 처리하였다. 시료 PPW, MAW, ZJW, LJW, SBW와 시료 Mix1, Mix2, Mix3, Mix4, Mix5를 각각 3시간 처리한 후 1 μg/mL LPS를 18시간 처리하였다.
시료 처리한 세포 배지를 0.5 mL 분리하여 1.5 mL 마이크로튜브(Axygen Biotechnology, Hangzhou, China)에 넣고 같은 양의 Griess시약(1% sulfanilamide in 5% phosphoric acid와 1% α-naphtylamide in H2O)을 넣고 잘 섞은 후 어두운 곳에서 10분간 방치 후 540 nm에서 흡광도를 측정하였다. Sodium nitrite(NaNO2, Sigma-Aldrich Co.)로 농도별 표준 곡선을 작성하여 배지에 함유된 NO 함량을 측정하였다.
NO를 측정한 것과 같은 세포배양액에 함유된 TNF-α 함량은 enzyme-linked immunosorbent assay(ELISA) kit(eBiosience, Inc., San Diego, CA, USA)에서 제시한 방법을 이용하여 측정하였다.
트립신 활성 및 라이페이스 활성 측정은 식품의약품안전처 식품의약품안전평가원에서 발간한 건강기능식품 기능성 평가 가이드(위 건강 관련)의 실험 방법을 사용하여 측정하였다(Ministry of Food and Drug Safety, 2020a).
트립신(trypsin) 활성 측정을 위해 트립신을 10 mM sodium acetate buffer(pH 7.5; Sigma-Aldrich Co.)에 녹여 0.01% 트립신을 만들었다. 2 mg/mL의 시료를 0.185 mL와 0.01% 트립신 0.015 mL를 혼합하여 37°C에서 10분간 전처리하였다. Phosphate buffer(pH 7.5; Sigma-Aldrich Co.)에 azocasein(기질; Sigma-Aldrich Co.)을 녹여 3% azocasein의 0.8 mL를 전처리 용액에 첨가하여 37°C에서 30분간 방치하였다. 110 mM trichloroacetic acid reagent(TCA; Sigma-Aldrich Co.) 1.0 mL을 첨가하여 반응을 정지한 후 상온에서 15분간 반응액을 정치하여 단백질을 침전시킨 후 원심분리(10,000 ×g, 20 min, 20°C) 하였다(Lee 등, 2023). 원심분리 후 상층액(1.2 mL)과 1 N NaOH(1.4 mL)를 혼합하여 UV-vis spectrophotometer(Ultrospec 3000, Pharmacia Biotech)로 440 nm에서 흡광도를 측정하였다.
라이페이스(lipase) 활성 측정은 농도별 시료를 0.25 mL, 지질분해효소(lipase, Sigma-Aldrich Co.) 800 unit/mL 0.5 mL과 0.05 M PBS(pH 6.5) 0.5 mL을 혼합하여 37°C에서 15분간 전 처리한 후 10% isooctane(Sigma-Aldrich Co.)에 용해시킨 올리브 오일(Chungjungone, Seoul, Korea) 1.25 mL을 첨가하여 37°C에서 20분간 진탕배양 하였다. 5 mL의 아세톤(acetone, Sigma-Aldrich Co.)을 더하여 반응을 정지시킨 후 5% cupric acetate 1 mL을 첨가하여 혼합하여 상온에서 정치하였고, 상층액(1 mL)을 720 nm에서 흡광도를 측정하였다.
α-아밀레이즈(α-amylase) 활성 측정은 Wu 등(2022)의 방법을 일부 변경하여 측정하였다. 즉, starch azure(Sigma-Aldrich Co.) 20 mg을 10 mL의 0.5 M Tris-HCl 완충액(pH 6.9)에 혼합하여 5분 동안 가열 후 냉각하였다. 1.5 mL 튜브에 농도별 시료를 200 μL를 넣었다. 그 다음 0.5 M α-아밀레이즈(Sigma-Aldrich Co.) 용액 200 μL를 혼합하였고, starch azure 300 μL를 첨가하여 혼합하였다. 37°C에서 10분간 반응시킨 시료는 50% acetic acid(Sigma-Aldrich Co.) 100 μL를 첨가한 후 원심분리(1,000 ×g, 10 min, 4°C)하였다. 원심분리 후 상층액은 595 nm에서 흡광도를 측정하였다.
트립신 활성, 라이페이스 활성 그리고 α-아밀레이즈 활성은 대조구(효소와 기질)에 대한 시료 첨가구(효소, 기질 그리고 시료)의 흡광도를 비교하여(시료의 흡광도/대조구의 흡광도)로 하여 대조구 흡광도의 배수로 나타내었다.
모든 실험은 3회 이상 반복하여 실시하였고 자료의 통계처리는 SPSS(statistical package for the social science) version 18.0 프로그램(SPSS Inc., Chicago, IL, USA)을 이용하여 평균(mean)±표준편차(standard deviation, SD)로 표시하였다. 실험군간 평균값은 일원배치 분산분석(one-way ANOVA)을 하였고, 유의적 결과가 나온 변수는 사후검정(Duncan’s multiple range test)을 실시하였으며, 모든 실험 결과의 유의성은 p<0.05 수준으로 검정하였다.
3. 결과 및 고찰
DPPH는 산화된 형태에서 유리기(free radical)가 항산화 효과를 가진 추출물 등에 의해 전자를 얻고 환원되면 짙은 자색의 DPPH가 diphenylpicrylhydrazine으로 탈색되는데 이것은 다양한 천연소재로부터 항산화 물질 탐색에 널리 사용되고 있다(Jung 등, 2012).
PPW, MAW, ZJW, LJW, SBW, Mix1, Mix2, Mix3, Mix4 그리고 Mix5를 농도(100, 250, 500, 1,000 μg/mL)를 달리하여 DPPH 라디칼 소거작용 효과를 알아보았다(Table 2). 물 추출물은 100 μg/mL와 250 μg/mL에서 SBW는 69.6%와 70.1%로 가장 강하게 DPPH 라디칼 소거능이 있었으나 500 μg/mL에서는 Mix1(78.7%)이 그리고 1,000 μg/mL에서는 Mix3(86.2%)가 다른 시료들보다 높은 DPPH 라디칼 소거작용이 있었다. 에탄올 추출물은 100-500 μg/mL까지는 SBE가 다른 9종류 시료보다 DPPH 라디칼 소작작용이 더 뛰어났고, 1,000 μg/mL에서는 SBE(90.1%)과 Mix3-E(89.8%)가 다른 시료들보다 DPPH 라디칼 소거작용이 높았다. 물 추출물의 DPPH 라디칼 소거작용은 46.8-86.2%인데 에탄올 추출물의 DPPH 라디칼 소거작용은 55.3-90.1%로 에탄올 추출물이 물 추출물보다 DPPH 라디칼 소거작용이 높은 경향이 있었다. 홍삼의 경우 열수 추출물과 에탄올 추출물에서 함유된 성분에 차이가 있고, ginsenoides 함량이 열수 추출물보다 에탄올 추출물이 더 많이 함유되어 있다고 하였는데(Lee, 2023) 본 연구에서는 물 추출물보다 에탄올 추출물에 DPPH 라디칼 소거작용을 나타내는 물질들이 더 많이 함유되어 있을 것으로 추측되고 어떤 물질이 함유되어 있는지 알아보는 연구가 계속 진행 되어야 할 것이다.
All values are mean±SD (n=3). In each column different superscript letters mean significant differences between results (p<0.05) but means with different letters on ascorbic acid in row are significantly different (p<0.05). The explanation of mixtures (Mixtures 1-5) are provided in Table 1.
황금 물 추출물의 동결건조 분말 2%를 증류수에 녹여 DPPH 라디칼 소거작용을 알아본 결과 45.3%이었다(Min 등, 2023). DPPH 라디칼 익모초의 메탄올 추출물 1,000 μg/mL의 DPPH 라디칼 소거작용은 48.9%(Kim 등, 2014)이었고, 같은 농도에서 물 추출물은 64.4% 그리고 에탄올 추출물은 75.5%이었다. 익모초 물 추출물(LJW)은 본 연구에서 사용한 식물 추출물 중에서 가장 낮은 DPPH 라디칼 소거작용을 나타내었다. 보리싹 70% 에탄올 추출물의 1,000 μg/mL에서 DPPH 라디칼 소거작용은 92.8%이었고(Eun 등, 2016), SB와 Mix3 에탄올 추출물의 1,000 μg/mL에서 DPPH 라디칼 소거율이 90.1%와 89.8%이었다.
폴리페놀계 물질들은 한 분자 내에 2개 이상의 phenolic hydroxyl(OH)기를 가진 benzene 화합물이다(Chio 등, 2013). 이는 색소 화합물인 플라보노이드와 탄닌이 주성분으로 항산화, 항암, 항염증 등 다양한 생리 활성 기능을 가지고 있는 것으로 알려져 있다(Chio 등, 2013).
단일시료 5종과 혼합시료 5종의 물 추출물(PPW, MAW, ZJW, LJW, SBW, Mix1, Mix2, Mix3, Mix4, Mix5) 및 에탄올 추출물(PPE, MAE, ZJE, LJE, SBE, Mix1-E, Mix2-E, Mix3-E, Mix4-E, Mix5-E)의 총폴리페놀 함량과 총플라보노이드 함량을 분석한 결과를 Table 3에 제시하였다. 10종의 시료의 총폴리페놀 함량을 분석한 결과, SBW(77.6 mg GAE/g dried extract)가 가장 높았고, 그 다음으로 Mix3(63.1 mg GAE/g dried extract), Mix1(57.3 mg GAE/g dried extract), Mix2 (54.6 mg GAE/g dried extract) 순으로 높은 값을 나타냈다. 본 연구에서 물 추출물 중 폴리페놀 함량이 가장 낮은 시료는 PPW (25.8 mg GAE/g dried extract)이었다.
Min 등(2023) 연구에서 황금의 총폴리페놀이 32 mg GAE/g 정도이었고, 유산균 발효에 의해 총폴리페놀 함량이 증가하였는데, 본 연구에서 황금 물 추출물의 총폴리페놀 함량은 77.6 mg GAE/g으로 2배 이상 높은 함량이었다. 이와 같은 차이는 총폴리페놀 함량을 측정하는 시료, 실험 방법, 황금의 재배지 등의 영향에 의한 것이라 생각된다. Zhang 등(2003)은 배의 과피, 과육 및 과심 부분의 폴리페놀 함량은 각각 62.38, 3.67 및 20.14 mg/g이라고 하였는데, 본 연구에서는 배의 물 추출물과 에탄올 추출물의 폴리페놀 함량은 25.8 및 29.8 mg GAE/g dried extract이었다. 본 연구에서 사용한 배 시료는 배의 과심은 제거하였고 껍질을 제거하지 않았으나 대부분이 과육이었다. 유색보리의 총 페놀 함량은 593-817 μg/g(Kang 등, 2023), 191.6-403.8 μg/g(Kim 등, 2007), 509.44-570.78 mg/100 g(Jin 등, 2022)으로 다양하게 보고되었으며, 이는 총 페놀 함량이 유색보리의 종류, 분석 방법, 추출용매 등에 따라 차이를 보일 수 있음을(Suriano 등, 2018) 시사하였다. 따라서 본 연구 결과가 다른 연구 결과들과 차이가 나는 것은 시료의 종류, 분석 방법 및 추출용매 등에 따른 것으로 생각된다.
Ko 등(2021)은 대추의 총 페놀화합물 함량이 190°C에서 추출했을 때 가장 높았고 그 함량은 67.79±3.45 mg GAE/g이라 하였는데 본 실험의 대추 물 추출물은 33.7±3.6 mg GAE/g이었고, 에탄올 추출물은 25.6±0.6 mg GAE/g으로 낮았다. 그러나 Park과 Kim(2016)의 연구 결과에 따르면 대추의 총 페놀 함량은 62.5 μg/g인 결과와 비교할 때 본 연구 결과의 대추 물 추출물과 에탄올 추출물의 총 페놀 함량이 높았다.
10종의 총플라보노이드 함량은 물 추출물 중 SBW(37.0 mg QE/g dried extract)가 가장 높았고, Mix1(26.2 mg QE/g dried extract) > LJW(24.4 mg QE/g dried extract) 순이었다. Mix2, Mix3, Mix4 그리고 Mix5는 21.5-22.9 mg QE/g dried extract로 서로 간의 유의적 차이는 없었다. 에탄올 추출물은 Mix3-E (78.8 mg QE/g dried extract) > Mix2-E(73.9 mg QE/g dried extract) > LJE(71.3 mg QE/g dried extract), Mix1-E(70.1 mg QE/g dried extract) > Mix5-E(60.2mg QE/g dried extract), Mix4-E (56.7mg QE/g dried extract) 순이었다.
플라보노이드는 대표적인 폴리페놀 화합물의 일종으로 식물 내에서 당의 이차대사산물로서 외부 환경으로부터 자신을 보호하는 역할을 하며, 인간이 섭취했을 경우 활성산소를 제어하므로 산화적 스트레스로부터 세포를 보호하여 여러 질병의 발생 위험을 낮출 수 있다(Kim 등, 2015; Mutha 등, 2021). Min 등(2023)은 황금 물 추출물의 총플라보노이드 함량은 21.5 mg CE/g하고 하였고, You 등(2024)은 스타아니스 추출물의 플라보노이드 함량은 17.18 mg CE/g이고 생강 추출물은 7.64 mg CE/g이라고 하였다. Lee와 Ji(2023)는 표준물질로 quercetin을 사용하였고, 농도별 quercetin이 가지고 있는 흡광도로 작성한 검량선에 따라 함량을 구하였으며, 익모초, 어성초, 진피 복합물의 물추출물 1 mg/mL 농도에서 존재하는 flavonoid 함량을 측정한 결과, 8.18±0.16 mg/g으로 나타났다고 하였는데, 본 연구에서도 quercetin을 표준물질로 사용하여 작성한 검량선으로 함량을 구했고, 물추출물 1 mg/mL 농도에서 존재하는 flavonoid 함량을 측정한 결과 혼합물의 물 추출물은 22.2-26.2 mg/g으로 익모초, 어성초, 진피 복합물의 물 추출물보다는 플라보노이드 함량이 높았다. 본 연구에서는 물 추출물보다는 에탄올 추출물에서 플라보노이드 함량이 높았는데, Choi 등(2021)은 팽이버섯은 물 추출물보다 70% 에탄올 및 95% 에탄올 추출물에서 플라보노이드 함량이 높다는 결과에 유사하였다. 플라보노이드계 물질이 화학구조에 따라 물과 에탄올에 대한 용해도가 달라진다고 보고가 있는데(Middleton과 Kandaswani, 1992) 본 연구에서 사용한 시료는 물 추출물보다 에탄올 추출물에 더 잘 용해되는 화학구조를 가진 플라보노이드가 포함되어 있을 것으로 추측된다.
DPPH 라디칼 소거작용, 총폴리페놀 함량 그리고 플라보노이드 함량 결과들을 종합하면 황금 추출물이 혼합물과 유사하거나 더 높은 항산화 효과가 있다는 것을 알 수 있었다. 같은 농도에서 혼합물에는 단일 황금 추출물보다 황금의 함량이 낮지만 1,000 μg/mL에서 황금 추출물과 혼합물 3 추출물의 DPPH 라디칼 소거작용에 유의적 차이가 없다는 것은 혼합물에 함유된 성분들이 상승효과는 나타낸다는 것을 알 수 있다.
만성염증은 세포 내 활성산소의 생성을 증가시켜 산화적스트레스를 유발하고, 폴리페놀과 같은 천연 항산화제가 풍부한 과일, 채소 등 섭취는 만성염증 및 산화적스트레스를 감소시켜 만성질환을 예방하는 효과가 있다(Lee 등, 2022). 따라서 SBW와 Mix3의 항산화 효과는 만성염증 질환과 산화적스트레스를 감소시켜 위장관 염증 질환에 도움을 줄 수도 있을 것으로 생각된다.
NO는 활성 질소종(reactive nitrogen species)의 하나이며, 적당량 분비되는 NO는 종양을 제거하는 등 면역반응에 관여하지만, 다량의 NO가 지속적으로 생성되면 염증반응을 조절하여 다양한 병리적인 반응을 일으킨다(Laroux 등, 2001). 외부 자극에 의해 염증이 발생하면 염증 세포에서 염증성 사이토카인(TNF-α, IL-1β와 IL-6)이 분비된다(Jeong 등, 2014). Lee 등(2023)의 연구에서 LPS로 염증반응이 유도된 RAW 264.7 대식세포에서 배, 맥아, 대추, 익모초, 황금 및 이들 혼합물이 과분비 되는 NO와 염증성 사이토카인 생성을 억제한다고 보고하였다. 본 연구에서는 LPS로 염증반응이 유도된 인간 장 상피세포 Caco-2에서도 배, 맥아, 대추, 익모초, 황금 및 이들 혼합물이 과분비되는 NO와 TNF-α 생성을 억제할 수 있는지 알아보았다.
배, 맥아, 대추, 익모초, 황금 및 이것들의 혼합물의 물 추출물(PPW, MAW, ZJW, LJW, SBW, Mix1, Mix2, Mix3, Mix4, Mix5)들을 Caco-2 세포에 500 μg/mL 농도까지 24시간 처리했을 때 세포 독성이 없었다(Fig. 1A). 따라서 NO와 TNF-α 생성에 미치는 영향을 알아보기 위한 시료 처리 농도는 500 μg/mL까지로 하였다.
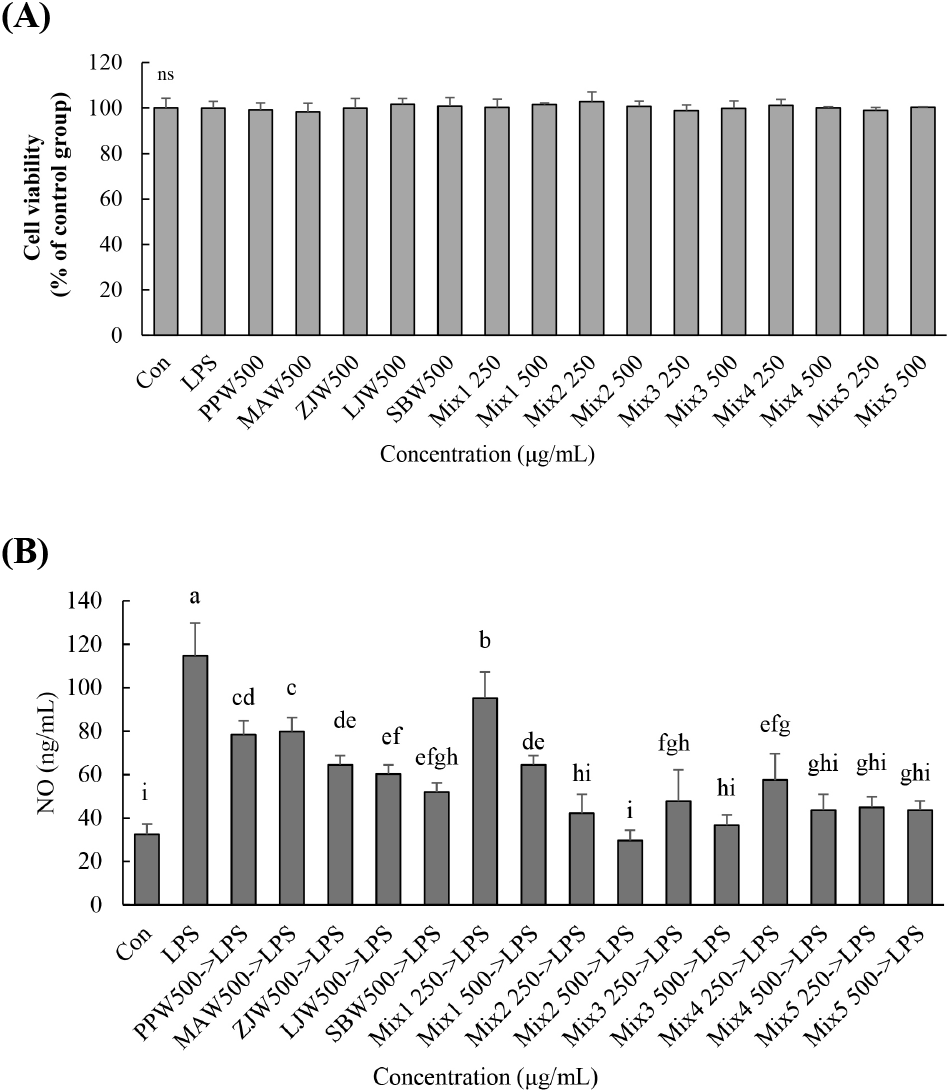
Caco-2 세포에서 LPS 처리로 NO가 무처리군인 대조군과 비교하여 유의적으로 증가하였다(p<0.05). 모든 시료들(PPW, MAW, ZJW, LJW, SBW, Mix1, Mix2, Mix3, Mix4, Mix5)은 LPS 단독 처리군과 비교하여 NO 수준을 유의적으로 감소시켰고(p<0.05), 가장 감소가 뛰어난 처리군은 Mix2와 Mix3를 500 μg/mL 처리한 군이었다(Fig. 1B). 같은 농도에서 Mix5는 SBW와 비교하여 유의적 차이가 없었으나 PPW와 MAW보다는 유의적으로 NO 함량이 감소하였다(p<0.05). 같은 농도에서 Mix1는 PPW, ZJW, LJW 그리고 SBW와 비교하여 유의적 차이가 없었으나 MAW보다는 유의적으로 NO 함량이 감소하였다(p<0.05).
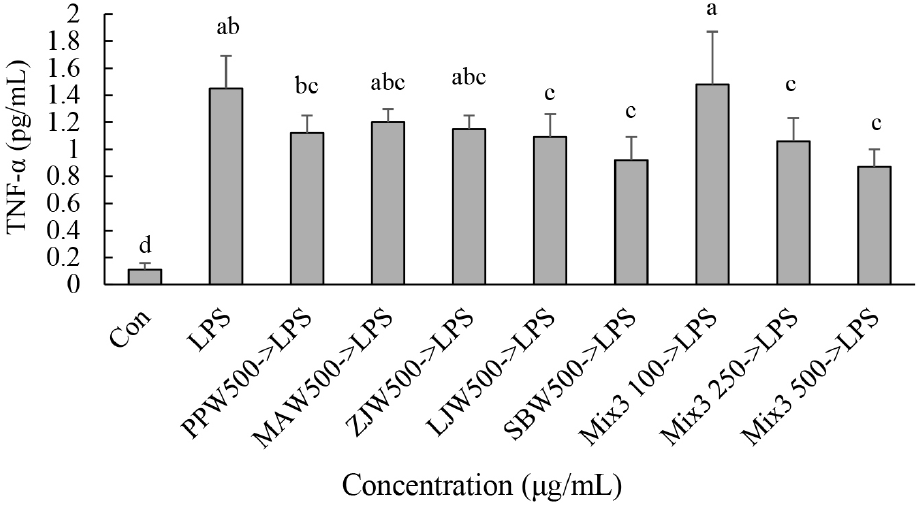
Caco-2 세포에서 LPS 처리에 의해 TNF-α가 무처리군인 대조군과 비교하여 유의적으로 증가하였다(p<0.05). 500 μg/mL의 PPW, MAW 그리고 ZJW 처리는 LPS 단독 처리군과 비교하여 TNF-α 함량을 유의적으로 감소시키지 못하였으나 LJW와 SBW 처리에 의해서는 유의적으로 감소시켰다(Fig. 2; p<0.05). Mix3를 100, 250 그리고 500 μg/mL 처리 후 LPS를 처리한 결과 100 μg/mL의 Mix3 처리군은 LPS 단독 처리군과 비교하여 유의적 차이가 없었고, 250과 500 μg/mL의 농도에서는 LPS 단독 처리군과 비교하여 유의적으로 TNF-α 함량이 감소하였다(Fig. 2; p<0.05).
다량의 NO 생성은 염증의 주요 매개체이고 NO는 iNOS에 의해 합성된다(Jung 등, 2013). LPS 자극에 의해 NO 생산이 증가되었다는 것은 염증반응이 유도되었음을 확인할 수 있고, Mix2와 Mix3는 다른 시료들보다 NO 생성 저해 효과가 더 뛰어난 것이 확인되어 이들 혼합물이 항염증 효과가 있을 것으로 생각된다. LPS로 자극한 RAW 264.7 세포에서 도라지, 더덕 그리고 잔대 물 추출물은 다량 생산되는 NO와 TNF-α 생성을 억제함으로써 항염증 효과를 나타내는 것을 알 수 있었다(Kim 등, 2018). Panaro 등(2012)은 LPS로 자극한 Caco-2 세포에서 resveratrol이 과분비 된 NO 생성이 억제함으로써 항염증 효과가 있다고 하였다. 천연물에 의해 과분비 되는 NO 생성 억제는 인체의 염증성 질환을 억제시킬 수 있는 소재라는 것을 알 수 있는 지표가 될 수 있다(Yi 등, 2017). Han 등(2024)도 LPS로 자극한 Caco-2 세포에서 증가된 NO와 TNF-α를 억제시키는 항염증 천연소재를 발굴하였다. 흰민들레(Taraxacum coreanum Nakai) 추출물 및 다시마(Laminaria japonica) 추출물은 LPS로 자극한 Caco-2 세포에서 염증을 감소시키고 장 장벽 기능 장애를 개선시켜 염증성 장 질환을 위한 소재로 개발 가능성을 시사하였다(Han 등, 2024; Yang 등, 2019). Gallic acid는 LPS로 자극한 Caco-2 세포에서 NF-kB/MAPK signaling pathway 활성 저해 및 염증성 사이토카인 생성 억제 효과가 있었고, LPS에 의해 증가된 ROS(reactive oxygen species) 수준을 억제하였는데 이들 결과들은 gallic acid가 장염증 질환의 치료제로 개발 가능성을 시사하였다(Chu 등, 2024). Chitosan nanoparticles도 Caco-2 세포에서 NF-kB signaling pathway 활성 억제에 기인하여 LPS에 의해 유도된 염증반응을 억제할 수 있다고 하였다(Tu 등, 2016).
Ahn 등(2022) 연구에 의하면, 장 세포(Caco-2 cell)에서 글루텐이 염증을 유발한다는 것을 TNF-α mRNA 수준 증가로 확인하였고, 감태 열수 추출물 처리에 의해 글루텐에 의해 증가된 TNF-α mRNA 수준을 효과적으로 감소시켰다고 하였다. 따라서 감태 열수 추출물은 글루텐으로 야기한 염증반응을 효과적으로 억제시켜 Caco-2 세포를 보호한다는 것을 확인하였다. Lee(2021)는 LPS를 이용하여 RAW 264.7 대식세포에 염증을 유발시킨 후, 초석잠 추출물을 처리한 결과 TNF-α의 생성이 억제된 것으로 초석잠 추출물의 항염증 효과를 알아보았다고 하였다. 따라서 본 연구에서 LPS로 자극한 Caco-2 세포에 Mix3 처리했을 때 과분비 되는 NO와 TNF-α 함량이 감소하였으므 Mix3가 항염증 효과를 가진 소재라는 것을 알 수 있었다. Mix3가 Caco-2 세포에서 NF-kB/MAPK signaling pathway 활성 저해할 수 있을지에 대한 기전 연구는 계속되어져야 할 것이다.
트립신(trypsin), 라이페이스(lipase) 그리고 아밀레이즈(amylase)와 같은 효소는 음식물의 분해와 영양소의 흡수를 촉진하는 데 핵심적인 기능을 수행한다. 주로 침, 위액, 췌장액, 장액 등에서 분비되는 소화 효소가 각기 다른 음식물 성분을 분해한다. 이러한 효소들이 없다면, 우리는 음식물로부터 필요한 영양소를 효과적으로 흡수할 수 없으며, 소화 불량과 같은 여러 문제를 겪게 된다(Hur 등, 2021; Ministry of Food and Drug Safety, 2020a). 따라서 본 연구에서는 소화에 도움을 주는 소재 발굴을 위해 PPW, MAW, ZJW, LJW, SBW, Mix1, Mix2, Mix3, Mix4 그리고 Mix5가 트립신, 라이페이스 그리고 α-아밀레이즈 활성에 미치는 영향을 알아보았다.
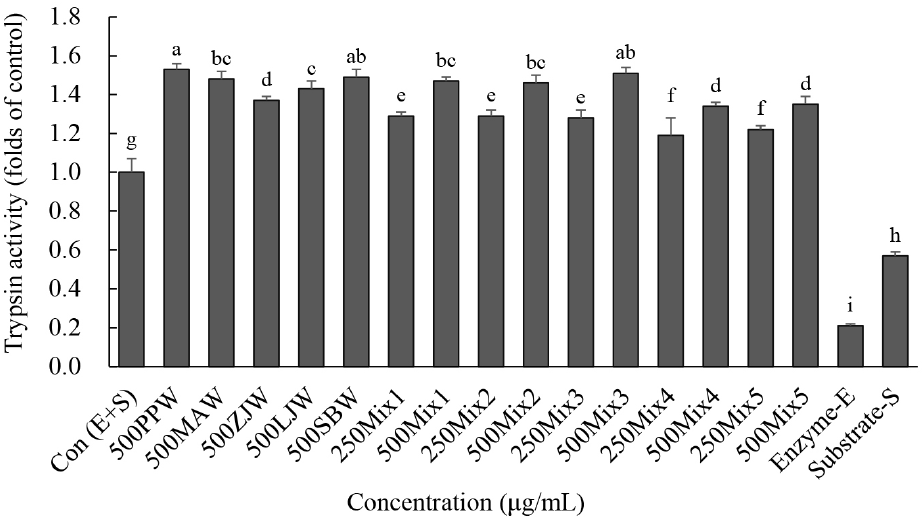
트립신 활성은 500 μg/mL에서 PPW, SBW와 Mix3가 다른 처리군보다 같거나 높았다. Mixs1, 2, 3은 트립신 활성이 유사하였고, Mix4와 Mix5보다 높았다(Fig. 3). 같은 농도에서 Mix3는 PPW, MAW 그리고 SBW와 유사한 트립신 활성을 보였으나 ZJW와 LJW보다는 높았다.
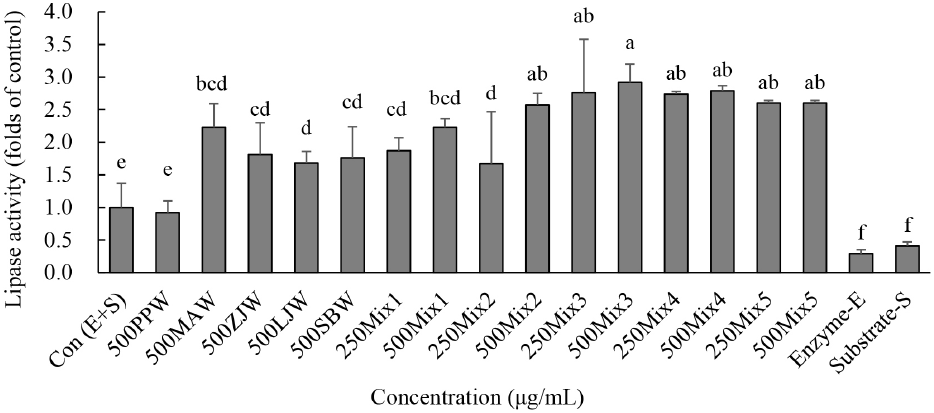
라이페이스 활성은 같은 농도에서 Mix3가 PPW, MAW, ZJW, LJW, SBW, Mix1 그리고 Mix2 보다 유의적으로 높았으나 Mix4 그리고 Mix5의 트립신 활성과는 유의적 차이가 없었다(Fig. 4). PPW는 효소와 기질만 처리한 대조군과 효소 활성에 차이가 없었고 다른 시료들은 유의적으로 증가하였다. MAW, ZJW, LJW 그리고 SBW 처리군은 라이페이스 활성에 유의적 차이가 없었다.
한편, 100 μg/mL 처리군에서 α-아밀레이즈 활성은 Mix3가 다른 혼합물(Mix1, Mix2, Mix4, Mix5)보다 높았다(Fig. 5). 모든 시료에서 농도가 증가할수록 α-아밀레이즈 활성은 감소하였고, 1,000 μg/mL 처리군에서 ZJW와 LJW는 대조군보다 α-아밀레이즈 활성이 유의적으로 감소하였다. 특히 LJW는 250 μg/mL에서부터 대조군과 비교하여 α-아밀레이즈 활성이 유의적으로 감소하였다.
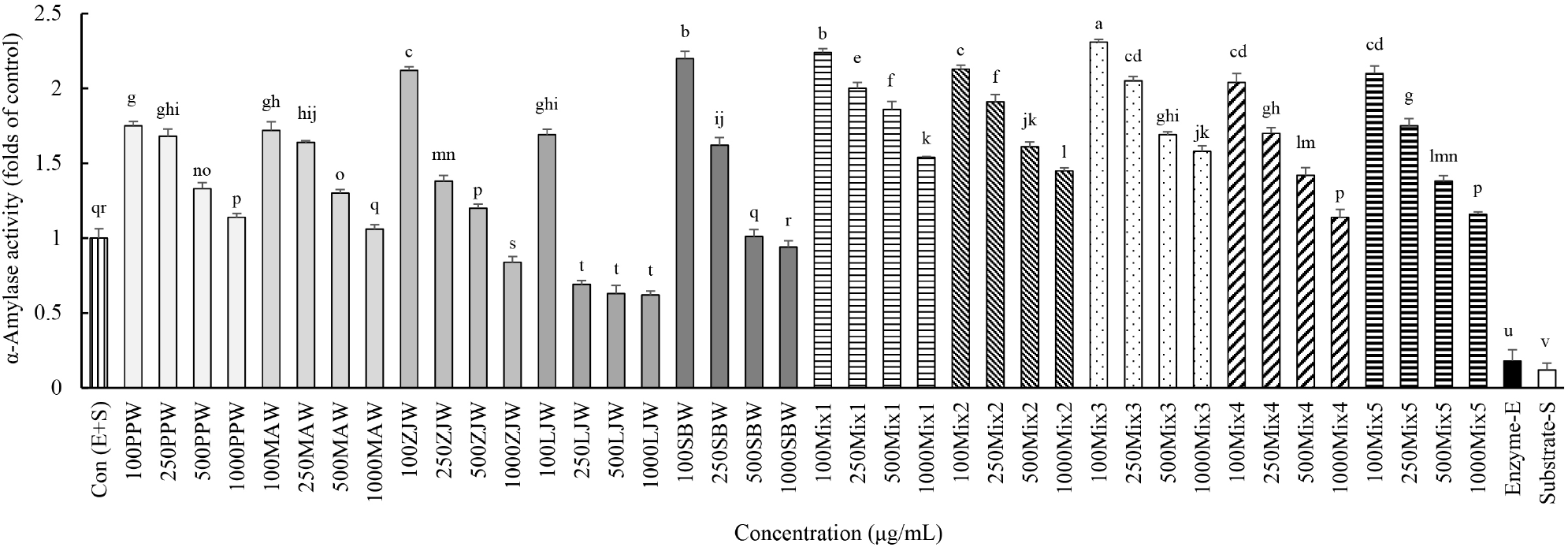
건강기능식품 기능성 평가 가이드(위 건강 관련)에서 소화기능 개선 기능성 확인을 위해 소화효소 활성[단백질분해효소 활성, 지질분해효소 활성, 전분분해효소(α-amylase)]을 바이오마커로 사용하고 있다(Ministry of Food and Drug Safety, 2020a). 따라서 본 연구에서는 소화에 도움을 주는 소재 발굴을 위해 이들 효소 활성을 증가시킬 수 있는 소재를 찾고자 하였다.
소장에서 트립시노겐이 분비되어 엔테로키네이즈에 의해 활성화 된 트립신(trypsin)은 소장에서 단백질을 작은 펩타이드로 분해하는 효소이다. 또한, 트립신은 카이모트립시노겐을 카이모트립신으로 활성화하여 작은 펩타이드와 다이펩타이드로 단백질을 분해하고 프로카르복실펩티데이즈를 카르복실펩티데이즈로 활성화하여 단백질을 다이펩타이드와 아미노산으로 분해하는 역할을 한다(Hur 등, 2021). PPW, SBW 그리고 Mix3는 트립신 활성을 증가시켜 단백질 소화에 도움을 줄 수 있을 것으로 기대된다.
지질의 소화는 라이페이스(lipase)를 이용하여 구강, 위 그리고 소장에서 일어난다. 중성지방(triglyceride)를 glycerol과 fatty acid로 분해하는 주요 지방분해효소가 췌장 라이페이스(pancreatic lipase)이고, 이들 효소에 의해 glycerol과 fatty acid로 분해된 후 흡수되어 신체에서 사용된다(Lunagariya 등, 2014). 췌장 라이페이스의 활성이 과도하면 지방분해 및 흡수가 증가하여 비만이 초래되므로, 해당 효소의 활성을 저해하여 지방의 축적을 막는 천연소재를 발굴하여 비만 치료에 사용되고 있다(Kim과 Kim, 2015; Kim 등, 2006; Lee 등, 2010). 라이페이스 활성을 억제시키는 소재 개발에 대한 연구는 많지만, 이들 효소를 활성화시켜 지방 소화에 도움이 되는 소재를 발굴하는 연구 논문은 미비하다. 본 연구에서는 PPW, MAW, ZJW, LJW, SBW 각각 처리군보다 혼합물들인 Mix3, Mix4 그리고 Mix5이 더 효과적으로 라이페이스 활성을 증가시켰다. Mix3, Mix4 그리고 Mix5는 라이페이스 활성을 증가시켜 지질 소화에 도움을 줄 수 있을 것으로 생각된다.
전분은 D-glucose 단위체가 α-1,4 그리고, α-1,6 글리코사이드 결합(glucoside bond)를 통해 결합되어 있는 순수 다당체로서 아밀로오즈(amylose, 20-30%)와 가지를 많이 친 모양을 가진 아밀로펙틴(amylopectin, 70-80%)으로 구성되어 있으며, 전분 가수분해 효소인 아밀레이즈(amylase)에 의해 α-1,4 결합이 끓어서 이당류인 맥아당까지 분해된다(Kim 등, 2021; Luz 등, 2008; Shofiyah 등, 2020). α-아밀레이즈(α-amylase)는 동식물에 널리 분포되어 있고, α-1,4 결합을 무작위로 가수분해한다. Acarbose는 α-아밀레이즈를 저해하고 소장에서 다당류와 이당류를 단당류로 전화시켜주는 소화효소인 α-글루코시다제(α-glucosidase)에 대한 저해 작용을 지닌 시판되고 있는 당뇨병 치료제이다(Carrascosa 등, 2001). 전분이 잘 소화되어 빨리 흡수되면 혈당이 급격하게 올려 당뇨병 유발 위험성이 있고 당뇨병 환자에게는 합병증을 유발시킬 수 있어 아밀레이즈를 억제하는 소재 발굴 관련 연구들이 주를 이루고 있으나 α-아밀레이즈 활성을 증가시키는 연구들은 미비하다. Mix3가 가장 효과적으로 α-아밀레이즈의 활성을 증가시켰지만 모든 시료에서는 농도 의존적으로 α-아밀레이즈 활성 감소 효과를 나타내었고, 익모초 물 추출물인 LJW는 α-아밀레이즈 저해제로 활용 가능할 것으로 생각된다. Mix3의 소화효소인 트립신, 라이페이스 및 α-아밀레이즈 활성을 증가시키는데 이와 같은 효과는 Mix3에 함유된 물질이 효소의 기질로 작용할 가능성이 높고, in vitro 소화과정을 진행한 12가지 기능성 식물성 식품의 다수가 항산화 효과가 더 증가하였다고 하였는데(Bae 등, 2021), 이는 소화가 진행된 후에도 항산화 효과를 나타내는 물질이 존재한다는 것을 의미하는 것으로 Mix3에 함유된 기질은 인체에서 소화 되는 중에 소화효소의 작용을 돕는 기질로도 작용할 수도 있을 것이라 추측된다. 소화에 도움을 주는 소재 개발을 위해서 더 깊이 있는 연구들이 in vitro digestive system, in vivo 동물실험 및 임상실험을 통해 진행되어야 할 것이다.
본 연구에서는 Mix3가 소화효소인 트립신, 라이페이스 및 α-아밀레이즈 활성을 가장 효과적으로 증가시킬 수 있는 소재라는 것을 확인하였으나 적절한 농도 설정 관련 연구 및 역가수치 관련 연구 등도 진행되어져야 할 것이다.
4. 요약
본 연구의 목적은 소화효소 활성, 항염증 효과 및 항산화 활성을 가진 기능성 소재를 발굴하는 것이다. 이 연구에 배(PP), 맥아(MA), 대추(ZJ), 익모초(LJ), 황금(SB) 그리고 이들의 혼합물을 물로 추출한 추출물을 사용하였다. 이 추출물들을 농축 및 동결건조한 시료들은 PPW, MAW, ZJW, LJW, SBW, Mix1, Mix2, Mix3, Mix4 및 Mix5이다. 시료 중에서 1:1:2:1: 2(w/w)의 비율로 PP, MA, ZJ, LJ 및 SB로 구성된 Mix3가 가장 효과적인 결과를 나타냈다. Mix3은 1,000 μg/mL의 농도에서 시료들 중에 가장 높은 DPPH 라디칼 소거 활성을 나타내었고, 이는 항산화 효과가 높다는 것을 알 수 있었다. Mix3는 다른 혼합물에 비해 가장 높은 총폴리페놀 함량을 보여 주었다. 또한, 본 연구는 LPS로 자극한 Caco-2 세포에서 NO와 TNF-α 수준을 측정함으로써 추출물의 항염증 효과를 평가하였다. Mix3는 NO와 TNF-α의 함량을 현저하게 억제하였고, 이는 염증성 장질환과 같은 염증성 질병에 대한 치료제로 개발 가능성을 시사하였다. 또한, 시료의 소화효소 활성을 평가하였다. Mix3는 100 μg/mL에서는 α-amylase 활성이 250 μg/mL에서는 lipase 활성이 그리고 500 μg/mL에서는 trypsin 활성이 시료들 중에서 가장 높았다. 이와 같은 발견은 Mix가 소화효소 활성을 향상시키고 염증성 장질환을 개선하여 소화도 도움을 주는 잠재적인 기능성 소재라는 것을 시사하였다.











