1. 서론
운향과 귤속(Citrus)에 속하는 감귤은 세계적으로 많이 섭취되고 있는 작물 중 하나로 유엔 식량 농업기구에 따르면 매년 2,560만 톤 이상의 감귤이 생산되고 있다(Unugul와 Nigiz, 2020). 우리나라에서는 주로 제주도에서 감귤을 재배하고 있으며, 연간 약 56만 톤 이상 생산되고 있고 우리나라 전체 과실 생산량의 30% 이상을 차지하고 있다(Jang 등, 2004). 귤 제품가공 시 생성되는 껍질은 유기 폐기물로, 감귤 주스 가공과정 중 매년 15만 톤의 감귤 과피가 발생되고 있다(Hyon 등, 2010; Šafranko 등, 2021). 감귤 과피에는 폴리페놀, 비타민, 미네랄, 식이섬유 및 카로티노이드 등이 함유되어 있으며, 감귤 유래 플라보노이드 배당체 형태인 hesperidin과 naringin이 풍부한 것으로 알려져 있다(Jeong 등, 2004; Lee 등, 2022; Manthey와 Grohmann, 1996). 감귤류의 플라보노이드류는 항산화, 항염증 및 항알레르기 등의 효과가 있는 것으로 보고되어 있다(Kang 등, 2005). 또한, 감귤류 과피에 있는 hesperidin, naringin, nobiletin 및 tangeretin 등과 같은 플라보노이드 화합물이 세포사멸로 인한 지방세포 수의 감소를 통해 항비만 활성을 나타내는 것으로 보고하고 있으며, naringenin, hesperidin 및 hesperetin은 지방전구 세포인 3T3-L1에서 지방구 분화를 억제한다고 한다(Bashandy 등, 2020; Lim 등, 2014).
플라보노이드는 식물 중에서는 대부분 당과 결합된 배당체 (glycoside) 형태로 존재하고 있다(Shin 등, 2013). 이러한 배당체는 산 가수분해에 의해 비배당체인 aglycone으로 분리된다(Zhang 등, 2014). 감귤류의 주요 폴리페놀 배당체 화합물은 naringin과 hesperidin이 있으며, 이는 당과 비배당체인 naringenin과 hesperetin으로 구성되어 있다. Hesperidin과 hesperetin은 항염증, 항암, 항산화제 등의 효과가 있다고 알려져 있다(Kanaze 등, 2007). 체내에서는 배당체보다 비배당체 형태의 플라보노이드 화합물들이 항염, 항산화, 항암 등의 효과가 우수한 것으로 알려져 있다(Park과 Lee, 2021). Shin 등(2013)의 연구에서는 hesperidin의 항산화 활성에 비해 hesperetin의 활성이 높은 것으로 보고하고 있다.
식품 가공에서 열처리는 단순하고 경제적인 방법으로, 식품의 보존뿐만 아니라 생리활성물질의 추출 효율을 높이는 데 널리 활용되고 있다(Rawson 등, 2011). 특히, 열처리는 감귤 껍질에 함유된 플라보노이드 비배당체의 함량을 증가시킬 수 있으며(Sung 등, 2019), 이러한 효과는 사과 껍질, 포도 껍질과 같은 농업 부산물에서도 열처리가 기능성 성분인 폴리페놀 및 플라보노이드의 가용성을 향상시켜, 그 생체 이용률과 항산화 활성을 높이는 것으로 보고되었다(Vodnar 등, 2017). 또한 열처리는 농업 부산물의 기능성 성분의 구조를 변화시켜 추출 용매와의 상호작용을 개선함으로써 기능성 성분의 추출 효율을 증가시키는 방법으로 이용되고 있다(Patra 등, 2022). 식품에 함유된 폴리페놀 화합물은 추출 용매의 종류에 따라 다른 추출 효율을 나타낸다(Renouard 등, 2010). 뿐만 아니라, 배당체는 효소, 산, 또는 염기 처리에 의한 가수분해를 통해 비배당체의 함량을 증가시킬 수 있다. 특히, 산 가수분해는 플라보노이드 배당체를 비배당체로 전환하기 위한 효과적인 방법으로 알려져 있으며, 효소 처리에 비해 간단하고 반응 시간도 짧아 비배당체의 함량을 증가시키는 것으로 알려져 있다(Yang 등, 2019).
반응표면분석법(response surface methodology, RSM)은 최소의 실험을 수행하여 변수에 대한 반응 정보를 얻을 수 있는 효율적인 실험계획 및 결과 정리 기법이다(Myers, 1971). 이는 각 변수에 대한 반응값을 구함으로써 반응변수에 영향을 주는 유의한 요인을 최적화할 수 있다. 이로써 식품에 함유된 유용한 성분의 추출을 반응표면분석을 이용함으로써 시간을 절약할 수 있고, 각 변수별 작용을 확인할 수 있어, 1회 1인자(one factor at a time, OFAT) 실험법으로 구하기 어려운 실제적 최적 조건을 확립하는 데 활용되고 있다(Zhu 등, 2010).
따라서 본 연구에서는 반응표면분석법을 활용하여 감귤 과피에 함유된 플라보노이드 비배당체인 hesperetin의 추출 최적 조건을 알아보고자 한다. 이를 위해 다양한 추출 변수(추출 시간, 산 농도, 에탄올 농도)가 hesperetin의 추출에 미치는 영향을 확인하여 최적의 추출 조건을 설정하고자 한다.
2. 재료 및 방법
본 연구에 사용된 감귤 과피는 2021년 제주산 온주 감귤인 조생 감귤의 과피를 사용하였으며, 부산광역시 대형마트에서 구입하였다. 감귤 과피는 증류수로 수세 후 물기를 건조하여 동결건조를 실시하였다. 표준물질인 hesperidin 및 hesperetin은 Sigma-Aldrich(St. Louis, Mo, USA)에서 구입하였다. Hesperidin 및 hesperetin 분석 시 이동상 조제에 사용한 3차 증류수 및 acetonitrile은 high performance liquid chromatography(HPLC) 등급으로 Honeywell Burdick & Jackson(Muskegon, MI, USA)에서 구입하였으며, 기타 시약은 HPLC 등급 및 ACS 등급의 시약을 사용하였다.
감귤 과피 0.5 g을 취하여 50 mL의 20-100% 에탄올(ethanol)을 첨가한 후 60°C에서 shaking water bath(HB-205SW, Hanbaek Scientific Co., Bucheon, Korea)를 이용하여 6 h 동안 추출하였다. 이후 추출물은 0.45 μm syringe filter(PVDF, Whatman Inc., Maidstone, UK)를 사용하여 여과한 뒤 HPLC 분석에 사용되었다.
감귤 과피 0.5 g을 취하여 50 mL의 60% 에탄올을 첨가한 후 60°C에서 shaking water bath(HB-205SW, Hanbaek Scientific Co.)를 이용하여 1-12 h 동안 추출을 진행하였다. 이후 추출물은 0.45 μm syringe filter(PVDF, Whatman Inc.)를 사용하여 여과한 뒤 HPLC 분석에 사용되었다.
감귤 과피 0.5 g을 취하여 0-1.0 M의 염산(HCl)을 포함한 50 mL의 60% 에탄올을 첨가한 후 60°C에서 shaking water bath(HB-205SW, Hanbaek Scientific Co.)를 이용하여 6 h 동안 추출하였다. 이후 추출물은 0.45 μm syringe filter(PVDF, Whatman Inc.)를 사용하여 여과한 뒤 HPLC 분석에 사용하였다.
감귤 과피의 산처리 전후 및 추출 온도에 따른 hesperidin 및 hesperetin 추출을 위해, 감귤 과피 0.5 g을 취하여 60% 에탄올 및 0.5 M의 염산이 포함된 60% 에탄올을 첨가한 후 40°C와 80°C의 shaking water bath(HB-205SW, Hanbaek Scientific Co.)에서 6 h 동안 추출하였다. 이 후 추출물은 0.45 μm syringe filter(PVDF, Whatman Inc.)를 통해 여과한 뒤 HPLC 분석에 사용되었다.
감귤 과피에 함유된 hesperetin 추출 최적 조건은 RSM 실험을 활용하여 알아보았다. RSM의 독립변수 설정을 위해 동결건조된 감귤 과피 0.5 g을 취하여 HCl이 함유된 에탄올 50 mL를 첨가하여 80°C의 shaking water bath(HB-205SW, Hanbaek Scientific Co.)에서 0-8 h 동안 처리하였다. 그 후 감귤 과피 추출물은 0.45 μm syringe filter(PVDF, Whatman Inc.)를 사용하여 여과한 뒤 HPLC 분석에 사용되었다.
본 연구에서는 감귤 과피에 함유된 hesperetin 추출 최적 조건 확립을 위해 반응표면분석법 중 Box-Behnken design(BBD)을 사용하였다. 감귤 과피에 함유된 hesperetin 함량을 증가시키기 위한 3가지 독립변수[X1: ethanol(%) 농도, X2: HCl(M) 농도, X3: 추출 시간(h)]를 Table 1과 같이 -1, 0, 1 총 3단계로 범위를 설정하여 15구간에 대한 추출 실험을 진행하여 hesperetin의 함량을 분석하였다.
| Independent variables | Coded levels | ||
|---|---|---|---|
| −1 | 0 | 1 | |
| Ethanol concentration (X1) | 60% | 80% | 100% |
| HCl concentration (X2) | 0 M | 0.5 M | 1.0 M |
| Extraction time (X3) | 4 h | 6 h | 8 h |
산 처리에 따른 감귤 과피 추출물의 비배당체 함량을 알아보기 위해 HPLC(Chromaster 5000, Hitachi Ltd., Toyko, Japan)를 이용하여 hesperidin 또는 hesperetin 함량을 분석하였다. 분석에 이용된 HPLC 컬럼은 YMC-Pack ODS AM(250×4.6 mm, 5 μm, YMC Co., Kyoto, Japan)을 이용하였다. 이동상은 acetonitrile(A)과 물(B)을 기울기 용리로 1.0 mL/min 유속으로 흘려주었다. 0, 14, 25, 30분 동안 이동상 B의 비율을 각각 20%, 37%, 37%, 20%로 흘려주었으며, UV 검출기를 사용하여 280 nm에서 hesperidin 및 hesperetin을 검출하였다.
반응표면분석의 유의성과 적합성 검증은 Minitab(14, Minitab Inc., State College, PA, USA)를 사용하였으며, 독립변수와 종속변수에 대한 분산분석 및 회귀분석을 진행하였다. 독립변수 Xi와 Xj에 대한 종속변수 Y(hesperetin 함량)는 다음과 같은 2차 회귀식으로 나타내었으며, β0는 상수이고, βi, βii, βij는 회귀계수이다.
또한, 본 연구의 분석 결과는 평균±표준편차(n=3)로 표기하였다. 에탄올 농도, 추출 시간 및 산 농도에 따른 hesperetin의 함량 변화는 GraphPad Prism(5.0, GraphPad Software Inc., San Diego, CA, USA)을 이용하여 나타내었으며, 산 처리 전후 및 온도별 hesperidin 및 hesperetin의 함량 차이는 SAS(9.4, SAS Institute, Cary, NC, USA) 프로그램을 통해 t-test를 실시하여 평균 간의 유의성을 검정(p<0.05)하였다.
3. 결과 및 고찰
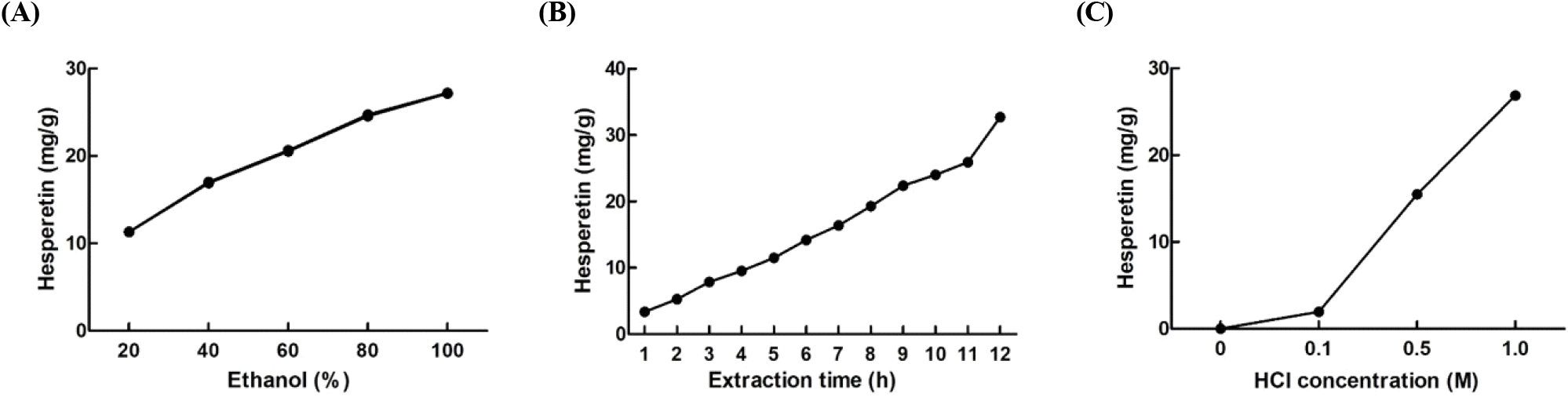
본 연구에서는 에탄올 농도(%), 추출 시간(h), HCl의 농도(M)에 따른 감귤 과피의 hesperetin의 함량 변화를 알아보았다(Fig. 1). 에탄올은 20%에서 100%의 에탄올을 이용하여 hesperetin을 추출하였으며, 농도 의존적인 hesperetin 함량 증가를 나타내었다. 추출 시간을 1 h에서 12 h까지 달리한 경우도 hesperetin의 함량은 지속적인 증가를 보여주었다. 뿐만 아니라, 산 농도를 0 M에서 1.0 M까지 달리 처리한 경우에도 hesperetin의 함량은 큰 변화를 나타내었다. 특히, 산 가수분해를 실시하지 않은(0 M HCl)의 경우 hesperetin은 거의 검출되지 않았으나, 0.5 M의 산 처리부터 hesperetin의 함량이 크게 증가하였다.
또한, 산 처리와 추출 온도를 달리하여 hesperidin과 hesperetin의 함량을 알아본 결과는 Table 2와 같다. Hesperidin의 경우 가열에 의해 함량이 유의적으로 증가하였으나, hesperetin의 경우 모두 검출되지 않았다. 또한, 산 처리를 하지 않은 감귤 과피와 0.5 M HCl을 처리한 감귤 과피에서의 hesperidin과 hesperetin의 함량을 알아보았다. 산 처리한 감귤 과피 추출물을 40°C에서 추출 시 hesperidin의 함량은 29.03 mg/g이었으나, 80°C에서 추출한 경우 16.51 mg/g으로 감소하였다. 반면 산 처리한 감귤 과피 추출물의 hesperetin의 함량은 40°C에서 추출한 경우 9.27 mg/g이었으나, 80°C에서 추출한 경우 21.33 mg/g으로 크게 증가하였다. 산 가수분해에 의해 감귤 과피의 hesperidin 함량은 감소하고 비배당체인 hesperetin 함량은 증가하는 것을 확인할 수 있었다. 따라서, 산 가수분해를 실시한 경우 추출온도를 80°C로 실시한 것이 40°C에서의 추출보다 비배당체의 함량이 약 2.3배 높게 나타났다. 뿐만 아니라, 비배당체 형태인 hesperetin의 경우 산 가수분해를 실시하지 않은 경우 검출이 되지 않았으나, 산 가수분해에 의해 크게 증가하였다. 이전 연구에서 감귤 껍질은 열처리에 의하여 hesperetin의 함량이 크게 증가되는 것으로 보고되어 있다(Sung 등, 2019). 뿐만 아니라, 산 가수분해를 실시하는 것은 알칼리 가수분해를 실시하는 것보다 식물에 함유된 결합형 폴리페놀 화합물을 유리형으로 전환시키는데 효과적이며, 비배당체의 함량을 증가시켜 항산화 활성이 강화되는 것으로 알려져 있다(Su 등, 2014). 본 연구에서는 가열 처리된 감귤 과피에 산 가수분해를 실시하는 것이 비배당체 형태인 hesperetin의 함량을 증가시키는데 효과적임을 확인하였다. 따라서, 본 연구를 통해 감귤 과피의 hesperetin 추출을 최적화하기 위해 에탄올 농도(60-100%), 추출 시간(4-8 h), 산 농도(0-1 M)를 범위로 설정하여 BBD에 따른 hesperetin 추출 최적 조건을 연구하였다.
BBD에 의한 15구간 실험 조건에 종속 변수인 hesperetin 함량 변화는 Table 3에 나타내었다. 15개의 구간에서 분석된 hesperetin의 함량은 0.23-41.06 mg/g으로 나타났다. 추출 조건에 따른 최댓값은 0.5 M의 HCl을 포함한 100% 에탄올을 활용하여 4 h 동안 추출한 경우(41.06 mg/g)에 나타났다. 반면, 산 가수분해를 실시하지 않은(0 M HCl) 60% 에탄올을 활용하여 6 h 동안 추출한 경우 hesperetin의 함량이 0.23 mg/g으로 가장 함량이 낮았다. 세 가지 독립변수인 에탄올 농도, HCl 농도 및 추출 시간과 종속변수인 hesperetin 함량에 대해 예측된 2차 회귀식은 다음과 같다.
2차 회귀식에 대한 상수 및 회귀계수의 분산분석 결과는 Table 4에 나타내었다. Hesperetin 함량에 대한 회귀식의 R2값은 95.32%이며, 적합성 결여 검정(Lack of fit) 결과 p-value는 0.288로 나타나 모델이 적합한 것으로 확인되었다. 또한 3가지의 독립변수 중 HCl의 농도는 일차항 및 이차항에서 유의적인 영향을 미치는 것으로 나타났다(p<0.05). 반면, 에탄올 농도와 추출 시간의 일차항 및 이차항은 hesperetin의 함량 변화에 대한 영향이 적었으며(p>0.05), 상호항은 모든 변수에서 유의미하지 않았다.
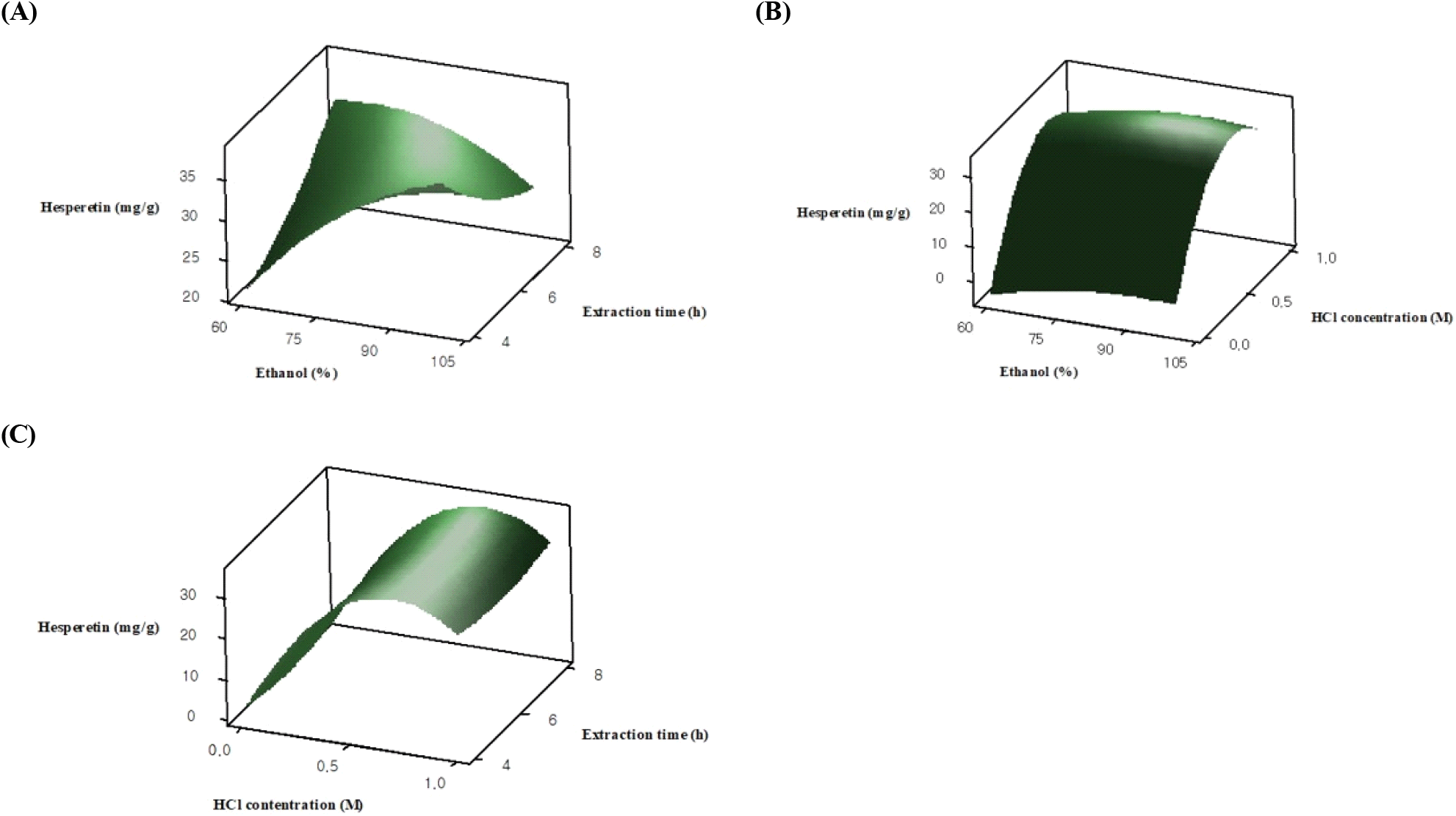
Hesperetin 함량의 반응표면곡선은 Fig. 2에 나타내었다. 추출 시간과 에탄올 농도에 따른 hesperetin 함량 변화는 Fig. 2A와 같으며, 에탄올 농도가 높고 추출 시간이 짧을 때 hesperetin 함량이 높아졌으나, 추출 시간이 길어질수록 hesperetin 함량이 감소하였다. 에탄올은 플라보노이드의 용해도를 증가시켜 추출 효율을 높이는 데 효과적이며, 여러 연구에서 에탄올이 플라보노이드 추출 용매로 이용되고 있다(Giordano 등, 2021; Gong 등, 2020). Nguyen Thu 등(2021)의 연구에서는 반응표면분석법을 통해 셀러리 씨앗의 플라보노이드 추출 최적화 조건을 확인하였고, 에탄올 농도가 증가할수록 플라보노이드 추출 수율이 높아지며, 90% 에탄올로 추출했을 때 가장 높은 플라보노이드 함량이 나타난 것으로 보고하였다. 또한, Jabbari 등(2024)은 반응표면분석법을 통해 사프란 꽃잎의 항산화 활성 및 플라보노이드 추출 최적화를 연구하였으며, 96% 에탄올이 총 플라보노이드의 함량을 최대화시킨 것으로 보고하였다. 이처럼 에탄올은 비극성 용매로서 세포벽을 용해하여 내부의 플라보노이드 화합물을 용출시키는데 효과적이지만(Chaves 등, 2020), 추출 시간이 길어질수록 에탄올과 플라보노이드 간 접촉으로 인해 산화 반응이 촉진되어 구조가 변형되어 분해될 가능성도 있다(Weremfo 등, 2020). Zulkifli 등(2020)의 연구에서는 탈지한 피타야 종자 추출물의 에탄올 농도가 증가함에 따라 추출 시간이 길어질수록 총플라보노이드 함량이 감소한다고 보고하였다. 뿐만 아니라, Su 등(2023)은 원추리속 식물 꽃봉오리 에탄올 추출물의 플라보노이드 함량이 초반에는 증가했으나 시간이 길어질수록 그 함량이 감소하는 경향을 보였으며, 이는 플라보노이드가 유기용매에 장시간 노출되어 쉽게 분해되는 불안정한 구조를 형성하였기 때문인 것으로 보고하였다. 본 연구에서 에탄올 농도와 HCl 농도에 따른 hesperetin 함량은 에탄올 농도와 상관없이 HCl 농도가 낮으면 hesperetin 함량이 낮고, HCl 농도가 높아질수록 hesperetin 함량이 증가하였다(Fig. 2B). 또한, 추출 시간과 HCl 농도에 따른 hesperetin 함량은 0.5 M HCl을 첨가하여 4-6 h 동안 추출했을 때 가장 높았으나 1 M HCl에서 감소하는 것으로 확인되었다(Fig. 2C). 산 가수분해는 글리코사이드형 플라보노이드의 가수분해를 촉진시켜 아글리콘으로의 전환을 높일 수 있으나, 산 농도가 일정 수준을 넘어서면 플라보노이드의 분해가 촉진되어 추출 효율이 감소되는 것으로 알려져 있다(Tolosa 등, 2018; Wang 등, 2011). Bae 등(2012)의 연구에 따르면 고추에 1-6 M HCl을 처리하였을 때 quercetin 함량은 HCl 농도에 따라 증가하다가 4 M HCl에서 감소한 것으로 나타났으며, Tu 등(2017)의 연구에서는 HCl의 농도가 증가함에 따라 플라보노이드 화합물이 분해되어 그 함량이 감소할 수 있는 것으로 보고하였다. 따라서 본 연구에서 에탄올의 농도가 높아질수록 hesperetin의 함량이 증가한 것은 에탄올이 플라보노이드의 용해도를 증가시켰기 때문인 것으로 보인다. 뿐만 아니라 추출 시간이 짧을 때 hesperetin의 함량이 높았으나, 추출 시간이 길어질수록 높은 농도의 에탄올과 장시간 접촉하게 되면서 플라보노이드의 산화와 분해로 인해 hesperetin 함량이 감소한 것으로 판단된다. 또한, HCl의 농도가 높아질수록 플라보노이드의 구조적 안정성이 영향을 받아 hesperetin의 분해가 촉진된 것으로 사료된다.
감귤 과피에 함유된 hesperetin을 최적으로 추출할 수 있는 조건은 100% 에탄올, 0.6 M의 HCl, 4 h 처리로 나타났으며, 최적 추출 조건으로 실험을 수행하여 얻은 실측값을 예측값과 비교하였다(Table 5). 최적 추출 조건에서 예측된 값은 40.53 mg/g이었으며, 실제 실험을 수행하여 얻은 값은 40.69 mg/g으로 나타나 예측값의 신뢰성을 뒷받침하였다. 본 연구를 통해 감귤 과피의 산 가수분해는 유리형의 비배당체인 hesperetin의 추출에 효과적인 방법임을 알 수 있다. 식물의 플라보노이드 화합물은 O-glycoside 또는 C-glycoside 형태의 결합형으로 존재한다(Sun 등, 2002). 산 가수분해는 이러한 결합을 분해할 수 있으며, 이전 연구에서도 산 가수분해에 의해 폴리페놀 및 플라보노이드 화합물의 함량이 증가된다고 보고하였다(Su 등, 2014). 또한, 비배당체 형태는 배당체에 비하여 항암, 항비만, 항산화 등의 효과가 더욱 우수한 것으로 알려져 있다. 예를 들면, Yang 등(2019)의 연구에서 산 처리를 한 rutin은 quercetin으로 전환되어 항산화 및 항염증 활성을 증가시킨다고 보고하였다. 본 연구를 통해 감귤 과피에 산 처리를 함으로써 비배당체 형태인 hesperetin의 함량 증대 최적 조건을 도출할 수 있었다.
| Responses | X1 1) | X2 2) | X3 3) | Maximum values (mg/g dry mass) | |
|---|---|---|---|---|---|
| Predicted | Experimental | ||||
| Hesperetin content | 100% | 0.6 M | 4 h | 40.53 | 40.69±0.00 |
4. 요약
본 연구에서는 산 처리에 따른 감귤 과피의 hesperidin의 비배당체 형태인 hesperetin의 추출 최적 조건을 알아보았다. 감귤 과피의 hesperetin의 추출을 위해 에탄올 농도, 시간, 산 농도를 달리하여 hesperetin의 함량을 알아보았으며, 에탄올 농도와 시간 증가에 따라 hesperetin의 함량은 증가하였고, 0.5 M HCl을 처리한 경우 hesperetin의 함량이 급격히 증가하였다. 반응표면분석을 위한 독립변수로는 에탄올(20%, 60%, 100%) 농도, HCl 농도(0 M, 0.5 M, 1 M), 추출 시간(4 h, 6 h, 8 h)이 도출되어, BBD에 따른 15구간의 실험을 수행하였다. 반응표면분석법의 검증을 위해 R2값과 적합성 결여를 확인하였으며, R2값은 95.32%, 적합성 결여는 유의하지 않은 것으로 나타나(p>0.05), 모델이 hesperetin 함량 변화를 설명하기에 적합한 것으로 확인되었다. 3가지의 독립변수 중 HCl의 농도가 hesperetin 함량에 유의적인 영향을 주었다. 반응표면분석 결과, 100% 에탄올, 0.6 M HCl, 4 h 추출 시 hesperetin 함량은 40.53 mg/g으로 예측되었으며, 실측값은 40.69 mg/g으로 유사한 함량을 나타내었다. 따라서 본 연구에서는 산 처리에 따른 감귤 과피의 hesperetin 함량을 증가시키는 최적화 조건을 도출하였으며, 이는 농산부산물인 감귤 과피의 활용과 부가가치 창출을 위한 기초자료로 활용될 수 있을 것으로 기대된다.










