1. 서론
염증은 우리 몸의 자연적인 방어 기전 중 하나로, 병원체나 손상된 세포로부터 몸을 보호하기 위한 생리적 반응이며, 크게 급성 염증과 만성 염증으로 나뉜다(Zhao 등, 2023). 급성 염증은 병원체 및 괴사물질의 식세포작용에 관여하여 체내에 유익한 역할을 수행하는 것으로 알려져 있고(Maiorino 등, 2022), 만성 염증은 면역억제 세포와 사이토카인(TNF-α, IL-6 등)을 활성화시켜 종양 유전자의 활성화, DNA 및 단백질 손상, ROS 방출을 촉진하여 류마티스 관절염, 심혈관 질환, 암 등 다양한 만성 질환의 주요 원인이 된다(Nasef와 Mehta, 2020). 체내 면역반응에 관여하는 주요 세포인 대식세포는 감염, 염증 반응 및 체내 항상성 유지에 핵심적인 역할을 담당하며, growth factor를 통해 cell proliferation에 영향을 미치고 염증 매개물질 생성에도 깊이 관여하는 것으로 보고되고 있다(Jang과 Lee, 2023). LPS 유도 염증 모델인 대식세포는 신규 항염증 후보 물질의 효능 평가에 사용되며 (Kim 등, 2017), LPS(lipopolysaccharide)에 처리로 활성화된 대식세포는 IL-1β, TNF-α, IL-6을 비롯한 다양한 염증성 사이토카인 유전자의 발현을 유도하는 것으로 알려져 있다(Page 등, 2022).
마늘(Allium sativum L.)은 다량의 유기화합물에 의해 특유의 강한 냄새가 있으며 건강기능식품 및 의약품 소재로 활용되고(El-Saber Batiha 등, 2020), 면역강화, 염증감소, 심혈관건강, 항산화 작용, 소화촉진, 항암효과 등 다양한 생리학적 기능을 갖는 소재로 보고되어 있다(Hameed 등, 2017). 그 중 마늘의 항염증 활성에 관한 연구로 pro-inflammatory cytokine과 염증 관련 효소들의 발현을 억제하고(Liu 등, 2009), 비정상적 혈장 지질과 혈소판 응집을 감소시켜 혈관계 위험을 감소시킨다(Ginter와 Simko, 2010).
마늘은 숙성과 발효 과정을 통해 황화합물의 구성이 변화되며, 슬라이스한 마늘을 20% 에탄올에 수 개월간 침지하여 제조한 숙성마늘추출물(aged garlic extract)은 diallyl disulfide (DADS), diallyl trisulfide(DATS), S-allyl cysteine(SAC), S-allyl-mercaptocysteine(SAMC)와 같은 유효물질이 존재하며(Kodera 등, 2020), 이때 마늘에 미량 존재하던 SAC가 크게 증가하는데, 이 SAC는 숙성마늘 추출물의 지표물질로 알려져 있다(Woo 등, 2022). 또한, 아시아를 중심으로 마늘을 60-90°C의 온도에서 숙성 과정을 거쳐 제조된 흑마늘은 마늘에 함유된 당과 아미노산 성분이 결합하여 maillard reaction으로 갈변물질이 증가하고 매운맛이 감소하고 당도가 증가하는데 특히 마늘에 함유된 화합물 중 SAC가 증가하며 흑마늘 품질의 지표로 활용되고 있다(Ahmed 등, 2021; Corzo-Martínez 등, 2007). 마늘은 생마늘과 숙성과정을 거친 마늘의 유효물질이 상이한데, 숙성마늘추출물에는 SAC 이외에 항산화 화합물로 Nα-(1-deoxyD-fructose-1-yl)-L-arginine이 있다고 하였으며, 이 물질은 ascorbic acid와 유사한 강력한 항산화 활성이 있다고 하였다(Kodera 등, 2020). 그 외 활성물질로는 스테로이드 사포닌과 tetrahydro-β-carboline derivatives 등 다양한 수용성 성분이 숙성마늘의 약리학적 효과와 관련이 있다고 알려져 있다(Ichikawa 등, 2006).
숙성된 흑마늘은 다양한 염증성 marker와 pathway에 영향을 주어 항염증 효과가 확인되는데(Libero 등, 2024), IL-1β, IL-6 및 TNF-α와 같은 전염증성 사이토카인의 발현을 억제하고(Stępień 등, 2024) 당뇨병 질환에서 염증 반응에 중요한 역할을 하는 nuclear factor-kB(NF-kB)/toll like receptors 경로를 조절하여 염증 반응을 감소시키는 것으로 확인되었다(Ali 등, 2024). 또한, 흑마늘은 iNOS와 COX-2 발현을 억제하여 대식세포의 특정 신호 전달 경로를 조절하여 항염증 효능이 있다고 알려져 있다(Ali 등 2024). 또한, 생마늘과 흑마늘 추출물 비교 연구에서는 두 가지 추출물 모두 대식세포에서 NO와 pro-inflammatory cytokine 생성을 감소시키는 것으로 밝혀졌다(Kim 등, 2014). 이외에도 갈변속도에 의해 제조된 홍마늘 추출물은 대식세포에서 nitric oxide 생성과 acute pulmonary 염증을 감소시킨다는 보고가 있다(Park 등, 2012).
최근 염증 억제제로 사용되는 합성 의약품은 여러가지 부작용이 보고되는데(Jahnavi 등 2019), 합성 비스테로이드 항염증제(nonsteroidal antiinflammatory drugs, NSAIDs)의 경우 위장 문제, 소화성 궤양, 신장염 등 다양한 부작용과 위장, 심혈관 질환 및 신장 합병증 등이 발생한다고 알려져 있다(Bindu, 2020). 특히 NSAID 및 COX-2 선택적 억제제의 경우 심혈관 질환의 위험성을 높인다고 알려져 있다(Minhas 등, 2023). 따라서 항염증제의 개발은 부작용이 적고 인체 안전성 확보된 소재가 요구되며, 최근 합성품보다는 천연물을 활용하여 대체 소재를 찾는 연구가 지속적으로 필요한 실정이다.
마늘은 가공방법에 물성과 화학적 특성이 달라지는데 생마늘에 존재하던 화합물과 장기간 숙성된 흑마늘의 화합물은 서로 상이하다. 그러나 마늘의 산업적 활용과 효능을 향상시키고자 장기간 숙성과정을 거쳐 제조된 흑마늘은 생마늘에 함유된 알린과 sulfide 화합물은 거의 존재하지 않으나, 갈변물질과 유리당이 증가하고 물성이 좋아지며 특히 유효성분으로는 SAC가 증가한다. 이러한 변화로 항산화, 항염증, 항암(Stępień 등, 2024) 등 다양한 활성이 있다고 알려져 있다.
따라서 본 연구에서는 흑마늘 제조 조건을 변형하여 저온에서 숙성한 마늘은 갈변물질은 적게 생성되는데, 색도와 당류의 변화보다는 유효물질의 향상에 초점을 맞추었다. 특히 생마늘과 흑마늘 대비 숙성마늘의 황화합물 함량을 비교 검토하고 숙성마늘을 물과 에탄올 추출물을 제조하여 각 추출물에서의 항염증 활성을 비교 검토하여 최적 추출조건을 탐색하였다. 현재까지 제조된 숙성마늘 추출물의 유효물질에 기반한 염증반응 조절 연구는 미흡한 실정이므로, 본 연구는 이후 염증성 질환 모델(류마티스 관절염, 심혈관 질환, 당뇨병 등) 연구와 다른 천연물질들과의 상호작용 연구를 위한 기초 데이터를 확보하고, 동시에 항염증 기능성 소재로서의 가능성을 탐색하는데 기여하고자 하였다.
2. 재료 및 실험 방법
본 실험에 사용된 마늘은 남해군 새남해농협으로부터 깐마늘을 구매하여 사용하였다. 숙성마늘 제조는 깐마늘을 3 kg씩 지퍼백에 담아 밀봉 후 50°C로 조절한 온습도조절기(JSRH-500CPL, JS Research Co., Gongju, Korea)에서 14일간 온도변화 없이 저장 ․ 숙성하여 제조하였다. 흑마늘은 깐마늘을 3 kg씩 밀봉하여 단계별로 80-90°C에서 60시간, 70-80°C에서 60시간, 60-70°C에서 120시간, 55-65°C에서 120시간 동안 숙성하여 제조하였다. 생마늘과 제조가 완료된 숙성마늘과 흑마늘 모두 동결건조기(Freeze Dryer, IlShinBioBase, Dongducheon, Korea)로 건조하여 분석 시료로 사용하였다.
숙성마늘 추출물 제조는 제조된 숙성마늘 200 g에 물, 50% 및 100% 에탄올을 각각 4 L를 첨가하였다. 물 추출물은 70°C에서 5시간 정치 후 No.2 여과지로 필터한 여액을 동결건조기로 분말화하였고, 50%와 100% 에탄올 추출물들은 20°C에서 24시간 동안 교반 추출한 후 No.2 여과지에 여과하고, 회전증발농축기(N-1200AVW, EYELA, Tokyo, Japan)로 완전건조 후 동결건조하였다. 모든 분말 형태로 -70°C에 보관하면서 필요 시 마다 용매에 희석하여 분석 및 세포 실험에 사용하였다.
Woo 등(2022)의 방법에 따라 GSAC, GS1PC, SAC 및 S1PC 함량을 측정하였으며 생마늘, 숙성마늘, 흑마늘은 동결건조된 시료를 분말화하여 사용하였다. 마늘분말 1 g을 3차 증류수 29 mL에 넣고 30분간 진탕하여 추출한 후, 여과지와 0.22 μm filter로 순차적으로 여과하였다. 여과액은 HPLC-PDA-MS/MS(TSQ Quantum LC-MS/MS, Thermo Scientific, San Jose, CA, USA)로 분석하였다. ESI 검출기는 양이온모드, scan rate는 0.5 spectra/s, collision energy는 10 eV로 설정하였으며, selective reaction monitoring(SAC, S1PC: m/z; 162 > 73,145, GSAC, GS1PC : m/z; 291 > 73, 145, 162)로 분석하였다. 분석컬럼은 Zorbax® C18 column(250 mm×4.6 mm, 5 μm, Agilent Technologies Inc., Santa Clara, CA, USA)을 사용하였으며, 이동상은 포름산이 0.1% 함유된 증류수(A)와 아세토나이트릴(B)를 이용하였다. 이동상의 기울기는 Table 1과 같다. GSAC(VWR, Radnor, PA, USA), SAC(Sigma-Aldrich, St. Louis, MO, USA), GS1PC(MedChemExpress, Monmouth Junction, NJ, USA), 및 S1PC(MedChemExpress)의 정량은 각각의 표준물질을 이용하여 작성한 표준검량선을 기반으로 수행하였다. 시료와 표준물질은 동일한 조건에서 분석되었으며, 머무름 시간을 비교하여 각 성분의 함량을 정량하였다.
| Time (min) | Mobile phase-A (%) | Mobile phase-B (%) | Flow rate (mL/min) |
|---|---|---|---|
| 0.0 | 99.0 | 1.0 | 0.7 |
| 7.0 | 80.0 | 20.0 | 0.7 |
| 14.0 | 0.0 | 100.0 | 0.7 |
| 17.0 | 0.0 | 100.0 | 0.7 |
| 18.1 | 99.0 | 1.0 | 0.7 |
| 21.0 | 99.0 | 1.0 | 0.7 |
| 25.0 | 100.0 | 0.0 | 0.7 |
페놀 화합물은 Folin-Denis(1915)의 방법을 이용하여 정량하였다. 1,000 μg/mL 농도의 숙성마늘 추출물 3종에 Foline-Ciocalteau 시약(Sigma-Aldrich Co) 1 mL를 가하고 3분 후 10% NaCO3 용액(Daejung, Siheung, Korea) 1 mL를 차례로 넣은 다음 실온에서 1시간 반응시킨 후 흡광광도계(Libra S 35, Biochrom, Cambridge, England)로 760 nm에서의 흡광도를 측정하였다. 갈릭산 표준용액(Sigma-Aldrich Co.)을 이용하여 작성한 검량선으로부터 시료의 총페놀 화합물의 함량을 gallic acid equivalent(GAE mg/100 g)로 계산하였다.
실험에 사용된 RAW 264.7 세포는 한국세포주은행(KCLB, Seoul, Korea)에서 분양받았으며, 배양은 10% fetal bovine serum(FBS, Hyclone, Loran, UT, USA)과 1% penicillin-streptomycin이 함유된 dulbecco’s modified eagle’s medium (DMEM, Gibco, Waltham, MA, USA) 배지에서 37°C, 5% CO2 조건으로 배양하였다. 추출물의 세포독성 측정은 MTT assay를 이용하였다. 96-well plate에 well당 5×104개의 세포를 분주하고 24시간 배양 후, 시료들을 처리한 뒤 30분 후 1 μg/mL 농도의 LPS(Sigma-Aldrich Co., St. Louis, MO, USA)를 처리하여 24시간 더 배양하였다. 이후 배지를 제거한 후 무혈청배지와 5 mg/mL 농도의 MTT 용액을 첨가하여 37°C에서 2시간 더 배양한 다음 DMSO를 분주하여 10분간 암실에서 교반한 뒤 570 nm에서 흡광도를 측정하여 세포 생존율을 산출하였다. 세포생존율은 control cell에 대한 백분율로 표시하였다.
RAW 264.7 세포를 24-well plate에 well당 5×105개를 분주하여 24시간 배양한 후, 시료를 처리하고 30분 반응 후 LPS(1 μg/mL)를 처리하여 24시간 추가로 배양하였다. 세포 배양액은 회수하여 원심분리(1,000 rpm, 10 min, 4°C)를 진행 후, 상등액만 회수하였다. 회수된 상등액 중 50 μL를 취해 sulfanilamide solution 50 μL와 혼합하여 5분간 빛을 차단하고 반응시킨 다음 NED solution 50 μL와 혼합하여 상온에서 추가로 10분간 반응시켜, 흡광광도계(Epoch, Bioteck, Winooski, VT, USA)를 이용하여 540 nm에서 흡광도를 측정하고, LPS 단독 처리군 대비 상대적인 NO 생성 억제율을 백분율로 나타내었다.
RAW 264.7 세포를 96-well plate에 5×104 cells/well 밀도로 분주하여 24시간 동안 배양한 후, 시료를 처리하고 24시간 더 배양하였다. 이후, DCFH-DA 형광 염색을 통해 세포 내 ROS 생성량을 측정하였다(Intracellular ROS assay kit, Cell Biolabs, San Diego, CA, USA). 우선 배양액을 제거하고 PBS로 세척 후, DCFH-DA 용액을 처리하여 1시간 동안 반응시킨 후, 다시 PBS로 세척하고 용해 완충액을 첨가하여 microplate reader(VictorTMX3, Perkin-Elmer Inc., Waltham, MA, USA)를 이용하여 excitation 485 nm, emission 535 nm에서 방출되는 형광 강도 변화를 측정하였다. LPS 단독 처리군을 대조군으로 하여 상대적인 ROS 생성 억제율을 백분율로 나타냈다.
RAW 264.7 세포를 12-well plate에 1×105 cells/well 밀도로 분주하여 12시간 배양 후, 시료를 처리하고 1시간 후 LPS(1 μg/mL)를 처리하여 20시간 더 배양하였다. 배양 상등액을 회수하여 ELISA reader(Epoch, Bioteck)를 통해 TNF-α, IL-1β, IL-6의 생성량을 측정하였다. 각 cytokine에 대한 항체가 코팅된 96-well plate에 표준물질과 시료를 분주하여 반응시킨 후, Streptavidin-HRP solution(Invitrogen Corp., Carlsbad, CA, USA)를 처리하고 TMB 기질을 첨가하여 실온 암소에서 반응을 유도하였다. Stop solution으로 반응을 중단시킨 후 450 nm에서 흡광도를 측정하여 LPS 단독 처리군 대비 상대적인 cytokine 생성 억제율을 백분율로 나타냈다.
세포 용해는 RIPA lysis buffer(150 mM NaCl, 1% Triton X-100, 1% sodium deoxycholate, 0.1% SDS, 50 mM Tris-HCl, pH 7.2, 2 mM EDTA)를 얼음에 30분 보관한 후 사용하였다. MAPKs 분석은 용해된 세포를 MAP Kinase Assay Kit (Catalog No. CBEL-ERK-SK, RayBiotech, Peachtree Corners, GA, USA)를 사용하여 제조사에서 정한 실험 방법에 따라 진행하였다.
3. 결과 및 고찰
생마늘은 3가지의 주요 γ-L-glutamyl-S-alkyl-L-cysteine류가 존재하는데 γ-glutamyl-S-1-propenyl-L-cysteine(GS1PC)이 3-9 mg/g(fresh weight), γ-glutamyl-S-allyl-L-cysteine(GSAC)이 2-6 mg/g(fresh weight), γ-glutamyl-S-methyl-L-cycteine이 0.1-0.4 mg/g(fresh weight)이 함유되어 있으나, SAC와 S1PC는 미량이다(Lawson 등, 1991). 그러나 숙성 과정을 거치면 화합물의 구성이 변하게 되는데, 에탄올에 장기간 숙성한 마늘추출물(AGE)은 GS1PC와 GSAC가 분해되어 S1PC와 SAC가 크게 증가한다(Lawson 등, 1991). 이와 제조 방법은 다르나 마늘을 적절한 온도에서 숙성하여 제조한 흑마늘도 S1PC와 SAC가 증가한다. 그러나 숙성 온도와 숙성 기간에 따라 SAC 함량이 상이한데, 생마늘에서는 검출되지 않던 SAC는 흑마늘로 제조된 후에는 52.75 mg/100 g으로 증가했다고 하였고(Kanokwan, 2023), 가공방법에 따라 흑마늘의 SAC는 9.77-19.43 mg/100 g의 범위라고 하였다(Malaphong 등, 2022). 20% 에탄올에 장기간 숙성시켜 마늘의 매운맛을 감소시키고 유효성분의 함량을 높인 숙성마늘추출물(AGE) 함유 제품(Kyolic, Wakunaga of America)의 SAC 함량은 34-70 mg/100 g, S1PC는 12-37 mg/100 g이었다(Woo 등, 2022).
Table 2는 숙성 온도를 달리하여 제조된 생마늘, 50°C에서 숙성한 숙성마늘과 상업적으로 활용되는 흑마늘을 제조하여 황화합물의 변화를 검토하였다. 생마늘의 GSAC 및 GS1PC 함량은 각각 1,047.58±45.34 mg/100 g 및 778.1±31.5 mg/100 g이었고 숙성마늘은 536.96±27.86 mg/100 g 및 195.2±10.7 mg/100 g으로 숙성에 따라 각각 48.74% 및 74.9%가 감소하였다. 반면 흑마늘에서는 GSAC 및 GS1PC 두 화합물이 검출되지 않았다. 숙성마늘의 SAC와 S1PC는 317.2±12.51 mg/100 g 및 72.21±3.24 mg/100 g으로 생마늘에 비해 증가하였고, 흑마늘은 SAC가 11.87 mg/100 g이 정량되었으나 S1PC는 검출되지 않았다. 숙성마늘은 흑마늘보다 SAC 함량이 26배가 높고 흑마늘에서 검출되지 않았던 S1PC도 정량되어 다양한 효능이 있을 것으로 기대된다.
| Sample name | GSAC | GS1PC | SAC | S1PC |
|---|---|---|---|---|
| Fresh garlic | 1,047.58±45.342)a3) | 778.1±31.5a | 65.1±4.37b | 11.48±0.67b |
| Aaged garlic | 536.96±27.86b | 195.2±10.7b | 317.2±12.51a | 72.21±3.24a |
| Black garlic | ND4) | ND | 11.87±0.25c | ND |
1) GSAC, γ-glutamyl-S-allyl-L-cysteine; GS1PC, γ-glutamyl-S-1-propenyl-L-cysteine; SAC, S-allyl cysteine; S1PC, S-1-propenyl-L-cysteine.
SAC는 항암, 항염증, 항산화, 면역활성 등 다양한 생리 활성이 있다고 알려져 있고, 특히 산화적 스트레스로 인한 뇌 손상시 글루타티온 과산화효소, 글루타티온 환원효소, 초과산화물 불균등화효소, 카탈라아제 등 항산화 효소의 활성 회복을 통해 뇌 손상을 완화할 수 있다는 보고가 있다(Ashafaq 등, 2012). 따라서 제조방법을 달리하여 만든 마늘 3종의 SAC와 S1PC 함량 비교 분석에서 SAC 및 S1PC 함량이 가장 높았던 숙성마늘을 활용하여 물과 50% 및 100% 에탄올 추출을 제조하여 마늘 추출물의 성분에 다른 항염증 효능을 검증하였다.
페놀 화합물은 채소류에 존재하며 높은 항산화 및 다양한 생리 활성을 가지고 있다(Vaz 등, 2022). 이러한 화합물은 자유형과 결합형의 형태로 존재하며(Hamid 등, 2023), 이러한 페놀 화합물들의 생리활성 기능으로는 항산화, 항균, 항염증, 항암, 심장보호 효과 등이 있으며, 최근 연구들에서는 페놀 화합물의 생체 이용률의 중요성을 강조하고 있다고 한다(Rashmi와 Negi, 2020).
숙성마늘 추출물 3종의 페놀 화합물 함량은 Table 3과 같다. 총페놀 화합물 함량은 100% 에탄올 추출물에서 2,569.02± 21.30 mg GAE/100 g으로, 물 추출물과 50% 에탄올 추출물의 356.31±1.74 mg GAE/g와 334.41±2.27 mg GAE/100 g보다 유의적으로 높았다. 기존의 연구에 따르면 다양한 식물의 물 추출물에 비해 에탄올 추출물의 페놀 화합물 함량이 더 높다는 여러 연구 결과가 있는데(Plaskova와 Mlcek, 2023), 마늘을 물과 70% 에탄올 추출물로 제조하여 총페놀 화합물과 플라보노이드 화합물을 비교한 결과 물 추출물보다는 70% 에탄올 추출물의 함량이 더 높다고 하였다(Eris 등, 2023). 본 실험에서 100% 에탄올 추출물의 총페놀 화합물이 다른 추출물에 비해 높아 다양한 활성이 있을 것으로 기대된다.
| Sample | Water | 50% EtOH | 100% EtOH |
|---|---|---|---|
| Total phenol | 356.31±1.741)b2) | 334.41±2.27b | 2,569.02±21.30a |
추출 용매를 달리한 3종의 숙성마늘 추출물의 GSAC, GS1PC, SAC 및 S1PC의 함량은 Table 4와 같다. 추출물 3종 중 100% 에탄올 추출물은 SAC와 S1PC 함량이 각각 1,555.6± 66.5 mg/100 g, 419.47±19.58 mg/100 g으로 다른 추출물에 비해 높았고, GSAC와 GS1PC 함량은 85.60±6.20 mg/100 g과 82.76±7.16 mg/100 g으로 가장 낮았다. 특히 각각의 숙성마늘 추출물에서 SAC 함량은 물 추출물과 50% 에탄올 추출물에서는 780.0-808.7 mg/100 g의 범위로 유의차가 없었으나 100% 에탄올 추출물은 1,555.6 mg/100 g으로 다른 추출물보다 2배 이상 더 높았다. 이러한 결과로 미루어 볼 때 에탄올 조성에 따라 유효물질의 함량에 차이가 있을 것으로 판단된다.
선행 연구에서 에탄올 첨가 비율을 달리하여 SAC 함량을 측정한 결과에 따르면 에탄올 함량이 높아질수록 SAC 함량이 증가한다는 보고가 있었다(Kang 등, 2018). 또 다른 식물(갈퀴나물, 콩잎)들도 물 추출물에 비해 에탄올 추출물에서 더 높은 항산화 활성을 나타낸다고 알려져 있다(Wu 등, 2009). 따라서 추출물에 따른 유효물질이 차이에 따라 향후 항염증 활성이 변화를 기대해볼 수 있을 것으로 추측된다.
숙성마늘의 주요 활성 성분으로는 SAC 및 S1PC가 대표적이며 이 물질들은 숙성 과정 동안 GSAC와 GS1PC가 γ-glutamyl transpeptidase(GGT)에 의해 SAC와 S1PC로 전환되어 생성된다(Lancaster와 Shaw, 1989). 흑마늘은 제조 공정 중에 SAC 함량이 증가하며 SAC는 흑마늘의 주요 지표물질로 알려져 있는데, 마늘은 발효나 숙성에 따라 SAC뿐만 아니라 S1PC도 함께 증가하며 S1PC도 항염증, 면역활성 등 다양한 효능이 있다고 알려져 있다(Kodera 등, 2017). 또한 흑마늘 제품에서 SAC 및 S1PC를 함께 표준화하는 것이 제품의 품질 향상을 위해 중요하다고 알려져 있다(Woo 등, 2022).
SAC는 백색 결정성 분말로 흡습성이 없고, 녹는점은 223.3-223.7°C이며(Kodera 등, 2002), 최대 2년 동안 그 함량이 변하지 않는다고 하며(Lawson과 Gardner, 2005), 가공 마늘에서 SAC는 안정적인 물질일 뿐 아니라 항산화, 항염증, 치매 예방, 혈행 개선, 항암 효과 등 다양한 생리학적 효능을 지니는 중요 물질로 알려져 있다(Mu와 Zhou, 2017). 따라서 본 실험에서 사용된 숙성마늘 100% 에탄올 추출물은 물 추출물보다 SAC 함량이 더 높아 다양한 효능이 있을 것으로 기대되며 이후 항염증 활성 검증은 숙성마늘로 진행하였다.
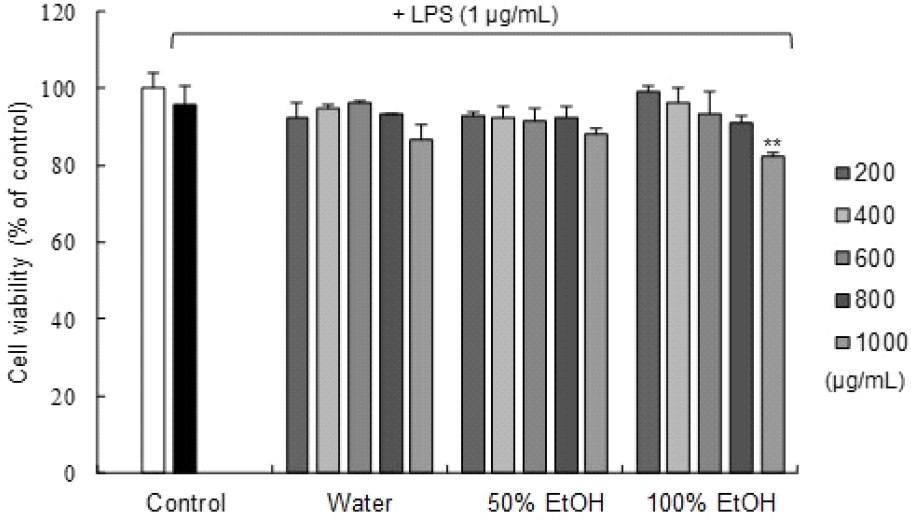
RAW 264.7 대식세포에 숙성마늘의 물, 50%, 100% 에탄올 추출물을 각각 농도별로 처리하고 37°C에서 24시간 동안 배양한 결과(Fig. 1), 물 추출물은 최대 1,000 μg/mL 농도까지 세포독성이 관찰되지 않았다. 반면, 50% 및 100% 에탄올 추출물은 1,000 μg/mL 농도에서 세포독성이 확인되어 이후 실험에서는 최대 농도를 800 μg/mL로 제한하였다.
대식세포에서 염증 매개인자인 NO는 박테리아나 종양을 제거하는 역할을 하지만, 과도하게 생성되면 산화적 스트레스를 유발하여 염증 및 암을 발생시킬 수 있다(Kim 등, 2020; Omata 등, 2001). 이처럼 NO 생성과 염증의 발생 사이에는 밀접한 관련성이 있기 때문에, LPS를 처리한 RAW 264.7 세포에 3종의 숙성마늘 추출물의 NO 생성 억제 활성을 측정하였다. 대조군으로 사용된 LPS 단독 처리군에서는 NO의 생성량 증가가 확인되었다. 물과 50% 에탄올 추출물을 세포에 처리 시 모두 NO 생성의 감소가 있었으나, 800 μg/mL에서의 감소율은 각각 약 8.02%와 11.95%로 낮은 수준이었다. 반면 100% 에탄올 추출물은 약 47.10%의 높은 수준으로 NO 생성을 억제했다(Fig. 2). 세포독성 실험 결과에 따르면, 3종의 추출물 모두 800 μg/mL 이하 농도에서는 독성이 관찰되지 않았다(Fig. 1). 본 연구 결과에서 물 추출물보다 100% 에탄올 추출물이 더 높은 NO 생성 억제 활성을 보였는데 이러한 결과는 물 추출물보다는 100% 에탄올 추출물의 페놀화합물 및 황화합물 함량이 더 높아 이에 기인하는 것으로 추측된다. 특히 100% 에탄올 추출물은 물 추출물보다는 페놀화합물은 약 7배, SAC 함량은 약 2배 더 높았다.
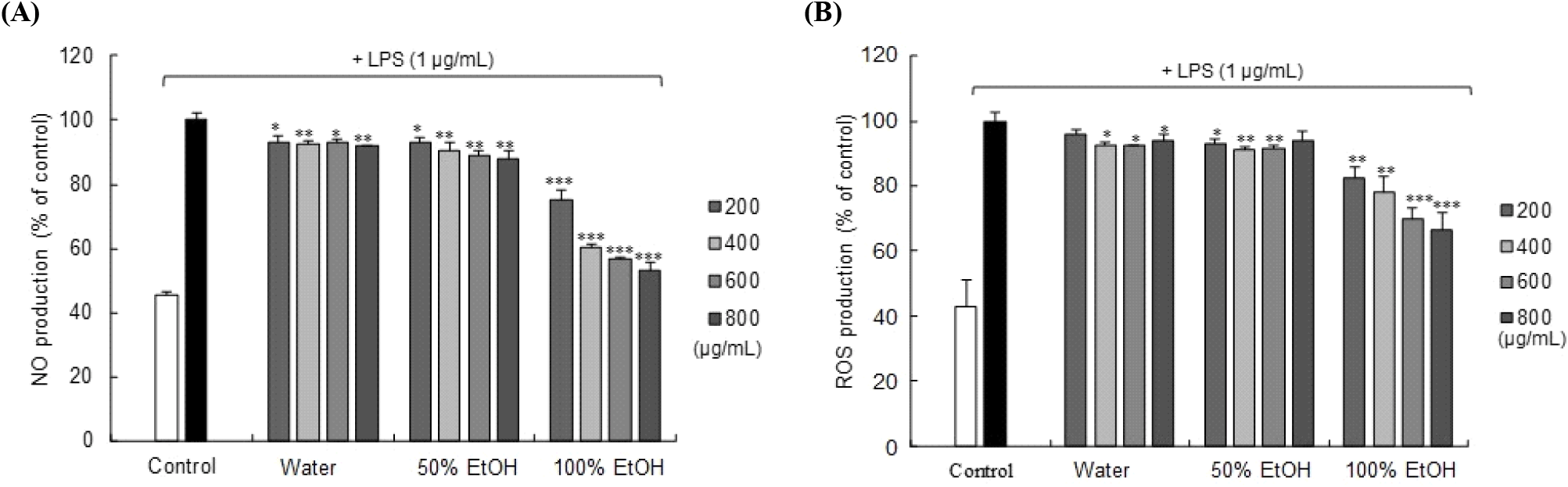
ROS는 식세포에서 과도한 산화 과정을 통해 생성되는 주요 물질이며, 다양한 염증 반응에 관여하며(Kim 등, 2020), ROS 생성 조절 기능은 면역 항상성에서 중요하다(Filippin 등, 2008; Kohchi 등, 2009). 본 연구에서는 LPS 처리에 의해 산화적 스트레스가 유발된 대식세포에서 숙성마늘 추출물들의 ROS 생성 억제 효과를 측정하였다. 그 결과, 물과 50% 에탄올 추출물은 낮은 수준의 ROS 생성 억제 효과가 나타난 반면, 100% 에탄올 추출물은 농도 의존적인 ROS 생성 억제 효과가 확인되었으며, 800 μg/mL 농도에서는 약 33.65%의 비교적 높은 ROS 생성 억제하였다(Fig. 2).
Chmelíková 등(2017)의 연구에 따르면 SAC는 여러 메커니즘을 통해 활성화 산소를 감소시키는데, hydrogen peroxide와 superoxide anion production을 감소시키거나 glutathione levels을 증가시킨다고 보고하였다. 따라서 본 실험에 사용된 100% 에탄올 추출물 역시 추출물 내에 함유된 SAC가 염증반응으로 발생하는 NO와 ROS 생성을 다양한 경로를 통해 유의적으로 감소시켜, 이에 따른 산화적 스트레스 완화에 효과가 있을 것으로 추측된다.
LPS의 처리는 다양한 실험 동물과 세포들에서 pro-inflammatory cytokine에 속하는 TNF-α, IL-1β, IL-6의 생성을 증가시키는 것으로 보고되어 있는데(Ceccarelli 등, 2015; Meng와 Lowell, 1997), 본 연구에서는 3가지 숙성마늘 추출물 중 NO와 ROS 생성 억제활성이 가장 높았던 100% 에탄올 추출물에 대한 pro-inflammatory cytokines 억제 효과를 확인하였다(Fig. 3). 세포에 LPS를 처리한 후, 100% 에탄올 추출물을 100, 200, 400, 600과 800 μg/mL 농도로 처리하고 ELISA kit를 사용하여 pro-inflammatory cytokines의 생성 억제 효과를 확인하였다. 800 μg/mL 농도에서 TNF-α, IL-6, IL-1β의 생성이 각각 47.29%, 43.93%, 63.06% 감소하였으며, 모든 cytokine의 생성이 농도 의존적으로 유의하게 억제되는 것을 확인하였다.
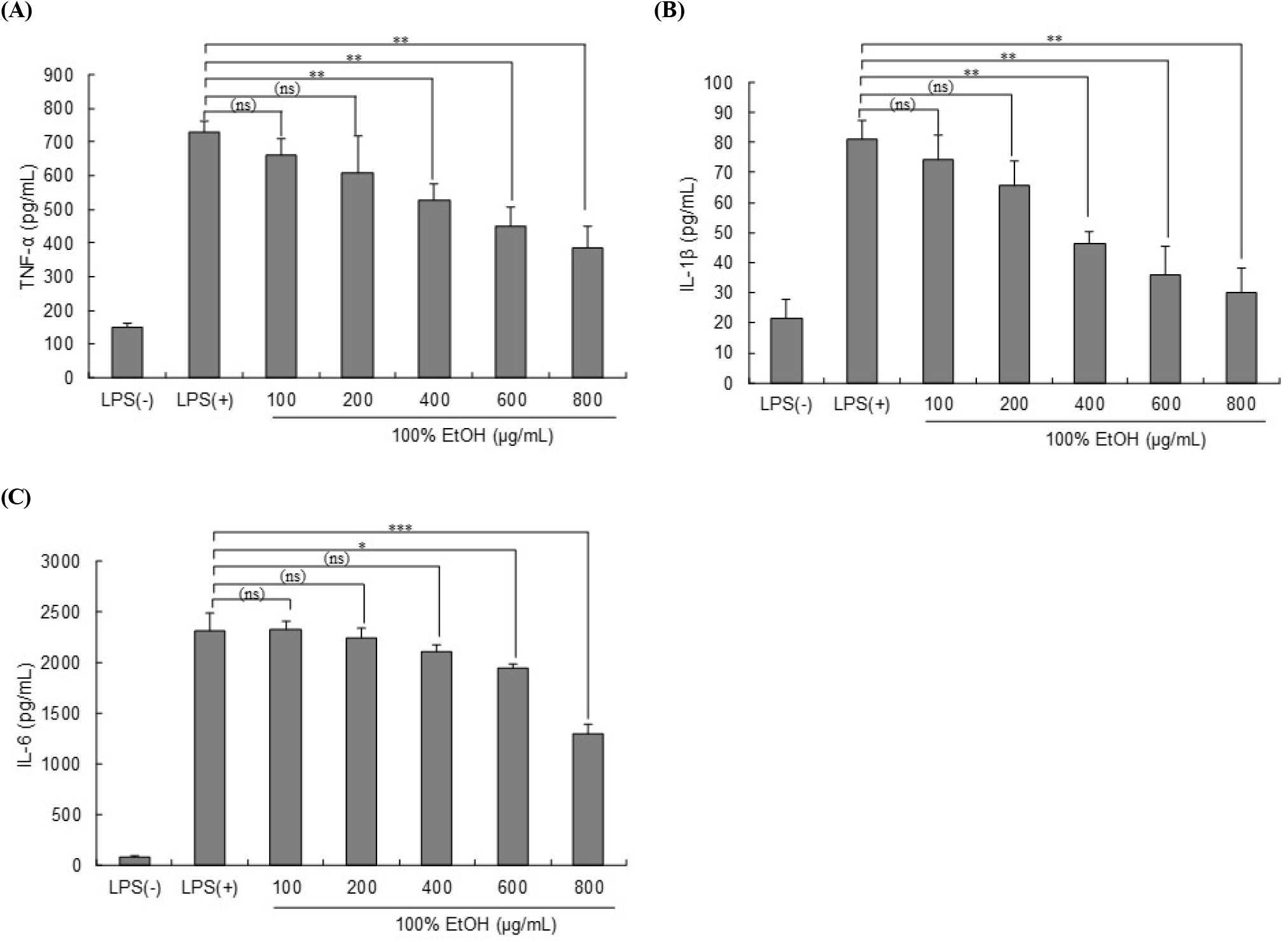
마늘의 SAC, caffeic acid, uracil, 디알릴삼황화합물(diallyl trisulfide), 디알릴이황화합물(diallyl sulfider)과 기타 마늘 유래 화합물은 NF-κB 전사인자를 억제하여 TNF-α, IL-1β, IL-6 및 MCP와 같은 전염증성 반응에 관여하는 여러 사이토카인 유전자의 전사를 억제할 수 있다(Ho 등, 2014; You 등, 2013). 특히 SAC는 과산화수소(H2O2)나 TNF-α에 의해 유도되는 NF-κB 활성화를 억제하는 역할을 하는 것으로 보고되어 있으며(Ide와 Lau, 2001), 또한 당뇨병 모델 쥐의 신장에서 NF-κB 활성과 NF-κB p65 mRNA 발현 및 단백질 수준을 의존적으로 억제한다고 알려져 있다(Mong과 Yin, 2012). 또한, 흑마늘 추출물은 염증을 촉진하고 산화매개체(COX-2와 TNF-α, IL-6, NF-κB)의 활성을 감소(Recinella 등, 2023)하며, NF-κB 신호 전달 경로를 유도하는 TNF-β1 단백질의 발현을 억제하였는데(Lee 등, 2019), 이는 흑마늘 추출물의 다양한 화합물이 기여를 하며 특히 SAC의 효과가 크다고 하였다(Yesim Teni 등, 2024). 따라서 숙성마늘 추출물에서 황화합물은 항염증 효능이 있고 특히 SAC 함량이 높은 추출물이 항염증 활성이 더 있을 것으로 기대되며 특히, 100% 에탄올 추출물은 pro-inflammatory cytokine (TNF-α, IL-1β, IL-6)의 발현을 농도의존적으로 억제하였으며, 이러한 결과는 100% 에탄올 추출물이 산화적 스트레스가 발생한 대식세포에서 염증성 cytokine을 효과적으로 억제하여 염증 억제 효과를 가질 것으로 기대된다.
iNOS와 COX-2는 모두 염증 반응에 중요한 물질로 알려져 있다. iNOS는 염증의 핵심 매개체인 일산화질소(nitric oxide)의 생성을 담당하고(Erfani 등, 2022), COX-2는 염증의 또 다른 중요한 매개체인 프로스타글란딘(prostaglandin)의 생성에 관여하는 효소이다(Lopes 등, 2022). 다양한 연구에서 염증 자극에 대한 반응으로 iNOS와 COX-2의 증가가 밝혀져 있고(Faruk 등, 2022; Oplawski 등, 2020), iNOS와 COX-2를 억제하면 항염증 효과가 있는 것으로 알려져 있다(Zhang 등, 2019).
본 실험에서는 대식세포에 LPS(1 μg/mL)를 처리한 다음 숙성마늘 100% 에탄올 추출물을 농도별로 처리했을 때의 iNOS와 COX-2 발현량 변화를 elisa kit를 통해 확인하였다(Fig. 4). 염증발현인자인 iNOS와 COX-2의 발현량은 농도 의존적으로 억제되었는데, iNOS의 경우 800 μg/mL의 농도에서 LPS가 처리된 대조군과 비교하여 약 39.03%의 억제 효과가 있었다. COX-2의 경우는 800 μg/mL의 농도에서 대조군 대비 약 78.70%의 높은 생성억제 효과가 확인되었다(p<0.05).
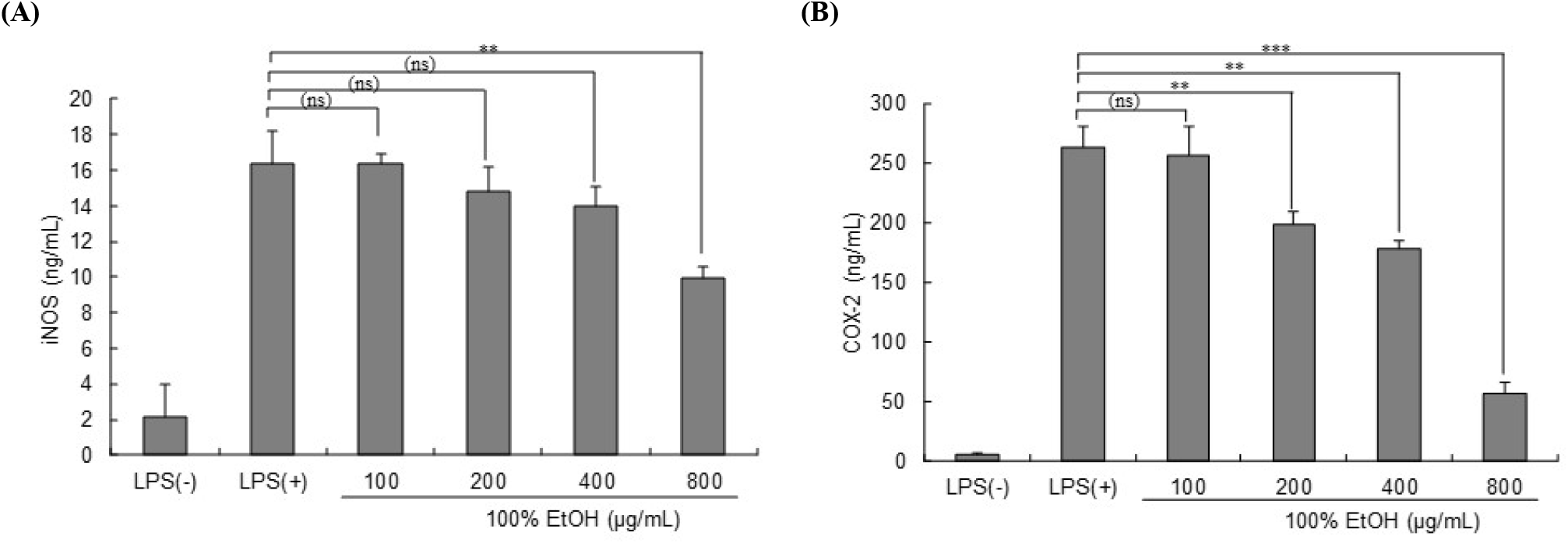
흑마늘 추출물이 LPS로 산화적 스트레스가 유도된 대식세포에서 iNOS와 COX-2 발현을 감소시키는 것으로 보고되어 있고(You 등, 2019), 숙성된 홍마늘 추출물도 LPS 처리된 대식세포와 생쥐에서 iNOS와 COX-2 발현을 감소시키는 것으로 확인되었으며(Park 등, 2012), 생마늘 줄기의 물 및 에탄올 추출물도 산화적 스트레스가 유발된 대식세포에서 iNOS와 COX-2 발현을 억제하였다(Cho 등, 2015). 따라서 본 연구에서 100% 에탄올 추출물이 다른 추출물보다 활성이 높았던 것은 SAC와 S1PC 등 황화합물에 기인하는 것으로 추측된다.
MAPK family인 ERK, JNK, p38은 cytokine, 성장 인자 및 환경적 스트레스와 관련된 신호 조절에서 핵심 역할을 한다(Braicu 등, 2019). 또한, 대식세포에서 MAPK의 인산화 증가는 전사 및 번역 조절에 영향에 관여하여 염증 반응을 증가시킨다고 알려져 있다(Moens 등, 2013). ERK 신호전달 경로에서는 인산화된 ERK는 자극 인자에 의해 활성화가 광범위하게 유도되지만, p38 및 JNK는 스트레스 반응 경로를 형성하여 염증성 cytokine과 같은 인자로 유도된 세포 스트레스에 의해 인산화된다고 보고 되어있다(Sabio와 Davis, 2014).
숙성마늘 추출물의 ERK, JNK, p38의 인산화에 미치는 영향을 확인하기 위해 LPS로 산화적 스트레스를 유발시킨 RAW 264.7 cell에 농도별의 추출물들을 처리하여 ERK, JNK 및 p38의 인산화를 측정하였다(Fig. 5). LPS에 의해 증가된 ERK, p38의 인산화가 숙성마늘 추출물을 800 μg/mL 농도로 처리한 경우 유의성 있는 감소가 확인되었고, JNK의 인산화에서는 감소하는 경향성은 보이지만 유의성 있는 감소가 확인되지 않았다. Kim 등(2021)은 LPS 자극으로 활성화된 MAPK에서 지칭개(Hemistepta lyrata Bunge) 추출물이 JNK의 활성화 정도가 ERK과 p38의 활성화에 비해 상대적으로 낮게 조절한다고 하였고, 배 미숙과를 이용한 MAPKs 신호 전달 조절을 확인한 논문에서도 JNK 인산화가 ERK과 p38의 인산화 대비 낮은 감소를 하는 것으로 확인되었다(Shin 등, 2023). ERK, JNK 및 p38 isoforms은 서로 다른 자극 경로에 의해 활성화된다고 알려져 있는데, ERK1/2는 growth factor, hormones 그리고 염증성 자극으로 활성화되고, JNK1/2/3과 p38는 염증성 자극 외에도 세포 및 환경스트레스에 의해 활성화된다고 알려져 있다(Kyriakis 와 Avruch, 2012). 따라서 실험에 사용된 숙성마늘 추출물은 MAPK 경로 중 ERK와 p38의 인산화를 감소시키는데 좀 더 효과적인 것으로 사료된다.
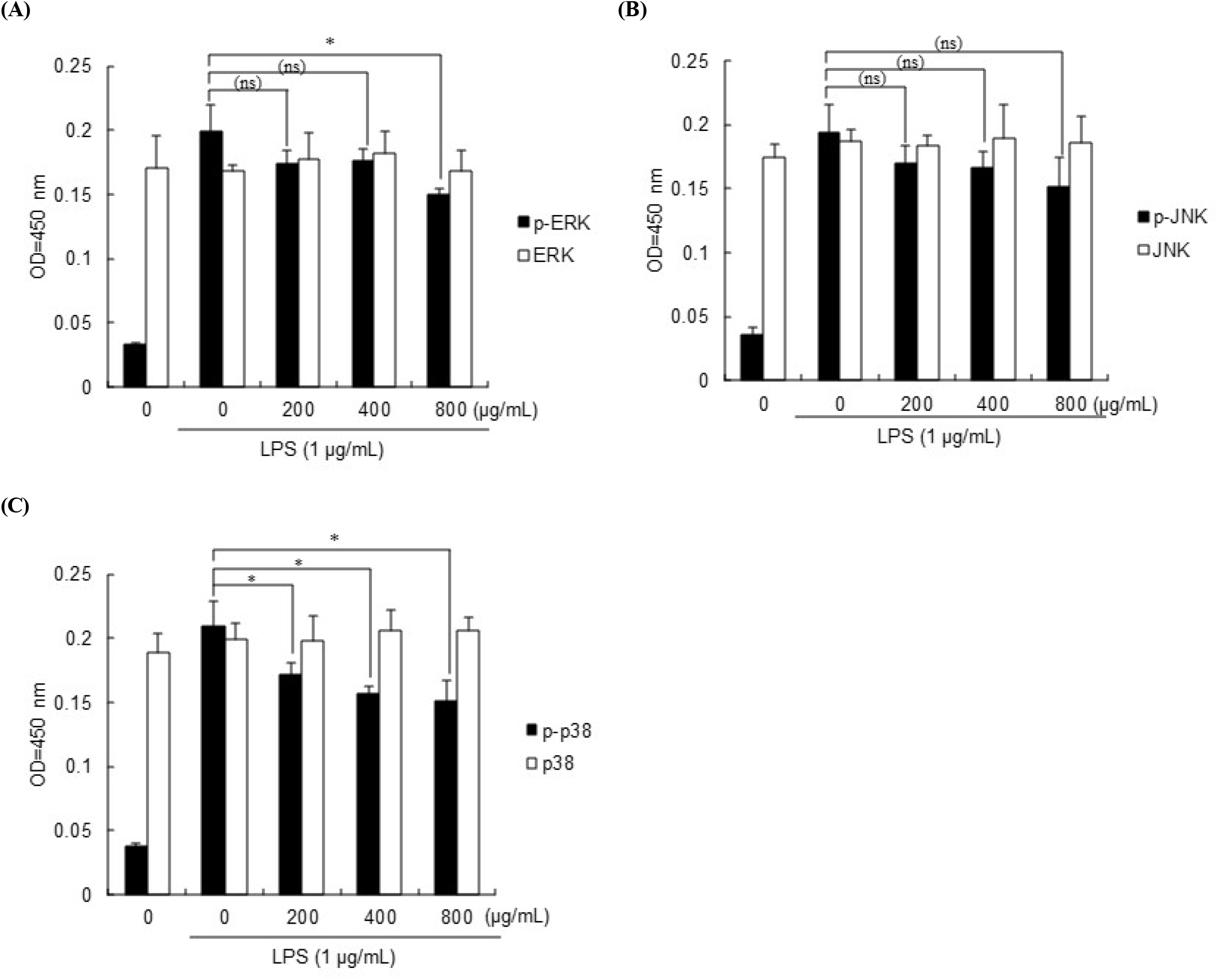
Abe 등(2022)은 흑마늘 추출물의 휘발성 성분이 UV-B 방사선에 의해 유도된 MAPK의 인산화를 억제하여 염증을 줄이는 효과를 가진다고 보고하였고, Colín-González 등(2015)은 SAC가 p38 및 MAPK/ERK pathway를 조절하여 당뇨병성 신장에서 NF-κB의 활성화를 억제한다고 보고하였다. 또한, SAC는 MAPK/ERK 및 PI3K/Akt/mTOR/NF-κB 신호전달경로를 억제하고, E-cadherin의 발현증가와 세포막 내 발현 분포를 회복시켜 상피-간엽 전이(EMT)를 억제할 수 있으며, 또한 암세포의 침투와 전이 억제 작용에서 MAPK/ERK 또는 PI3K/Akt/mTOR/NF-κB 신호전달경로의 활성 차단을 통한 E-cadherin의 발현증가와 관련이 있다는 보고가 있다(Chu 등, 2006; Pai 등, 2012). 본 연구에서 사용된 숙성마늘 추출물에서 가장 함량이 높은 물질도 SAC이기 때문에 이 성분이 항염증에서 중요한 역할을 할 것으로 기대된다.
기존의 마늘을 이용한 염증성 질환 모델 실험에 따르면, 마늘 추출물이 궤양성 대장염 동물 모델에서 COX-2와 TNF-α의 발현을 억제한다는 보고가 있었고(Recinella 등, 2022), 마늘 오일은 아세트산으로 유발된 대장염 동물 모델에서 hydroxyproline과 TNF-α 수치를 감소시킨다는 연구 결과도 있다(Tanrikulu 등, 2020). 또한, 흑마늘 추출물은 제2형 당뇨병 동물 모델에서 AMPK의 활성화를 조절하여 동맥경화성 플라크 형성을 억제하고 고혈당을 개선하는 것으로 확인되었다(Miki 등, 2020). 이처럼 마늘은 다양한 염증성 질환의 치료와 밀접한 관련이 있기 때문에, 추후 본 연구소에서 개발한 숙성마늘 추출물도 이와 같은 다양한 질환들을 대상으로 하는 연구를 진행할 필요가 있다.
4. 요약
마늘의 기능성을 증대시키고자 황화합물의 함량이 높은 숙성마늘을 제조하고 이의 물, 50%, 및 100% 에탄올 추출물들의 항염 효능 검증을 통하여 기능성 소재로의 사용 가능성에 대해 알아보고자 하였다. 생마늘, 숙성마늘 및 흑마늘의 GSAC, GS1PC, SAC 및 S1PC의 함량은 LC-MS/MS로 측정하였으며, 항염증 효능 측정은 in vitro 실험을 통하여 실시하였다. 마늘의 주요 황화합물 함량은 생마늘에서는 GSAC와 GS1PC 함량이 높고 SAC와 S1PC 함량은 낮았다. 반면 숙성마늘은 GSAC와 GS1PC는 감소하고 SAC와 S1PC 함량이 더 높았다. 숙성마늘 추출물 3종을 RAW 264.7 세포에서 LPS를 처리 후 NO, ROS, TNF-α, IL-6, IL-1β 생성 억제량 및 iNOS와 COX-2의 발현량과 관련 메커니즘을 MAPKs(ERK, JNK, p38)의 인산화로 확인하였다. RAW 264.7 세포에 처리한 3종 추출물들은 800 μg/mL의 농도까지 유의성 있는 세포독성은 유발되지 않는 것으로 확인되었다. LPS와 추출물이 처리된 세포에서 생성된 NO와 ROS는 모두 유의성 있는 효과가 있었고, 3가지 추출물 중 NO와 ROS 생성억제 효과가 가장 높았던 100% 에탄올 추출물의 TNF-α, IL-6 및 IL-1β의 발현량을 확인한 결과, 모두 최대 농도에서 유의하게 발현이 감소되었다. 또한 100% 에탄올 추출물은 세포 내 iNOS와 COX-2의 발현량을 유의성 있게 감소시켰다. 추출물에 의한 MAPKs의 인산화 변화량을 측정한 결과 최대 처리 농도에서 ERK와 p38의 인산화 감소는 확인되었다. 따라서 숙성마늘의 100% 에탄올 추출물은 항염증 활성이 있는 천연 소재로 식의약품에 활용 가능성이 있을 것으로 추측된다.











