1. 서론
스피룰리나(Spirulina platensis)는 지구에서 가장 오래된 생물 중 하나로, 남세균(Cyanobacteria)에 속한다. 온천수, 바닷물, 북극해와 같이 서식 환경이 완전히 다른 곳에서도 잘 적응하여 살 수 있음은 물론, 다른 생물체들이 살 수 없는 극한 환경에서도 살고 있다(Usharani 등, 2012; Yang 등, 1997). 깨끗한 물과 엄격하게 관리된 조건에서 재배된 스피룰리나는 인간의 영양 공급원으로 쓰이고, 폐수와 같은 극한 환경에서 자란 스피룰리나는 미세 화학 물질과 연료생산에 이용된다(Usharani, 2012). 스피룰리나는 높은 단백질 함량(60-70%), 낮은 칼로리 및 다양한 필수 영양소를 함유하고 있으며(Herrero 등, 2004; Kay와 Barton, 1991; Usharani, 2012), 기능성 식품 및 제약의 원료로 활용되고 있다(Affan 등, 2015; Kay와 Barton, 1991). 스피룰리나에는 피코시아닌, 클로로필과 같은 색소를 포함하고 있으며, 특히 피코시아닌은 특유의 청록색을 띠고, 항산화 및 항염 효과가 있는 것으로 알려져 있다(Herrero 등, 2004; Jaeschke 등, 2021). 또한, 스피룰리나는 수용성 비타민 B군이 풍부하며, 이는 에너지 대사와 신경계 건강에 중요한 역할을 한다. 그중 엽산과 비타민 B12는 생화학적으로 상호 밀접한 관계가 있는 수용성 비타민으로(Afman 등, 2005; Min과 Kim, 2009), 비필수 아미노산인 호모시스테인을 필수 아미노산인 메티오닌으로 메틸화되는 과정에서 중요한 보조인자 역할을 한다(Ubbink 등, 1993). 코발라민이 부족하면 엽산이 제대로 기능하지 못하며, 이에 따라 거대적아구성 빈혈이 발생한다. 이처럼 스피룰리나는 저칼로리 및 고효율 에너지 공급원으로 식품 및 보충제로 널리 사용되고 있다. 또한, 건강기능식품의 기준 및 규격에 항산화 · 혈중 콜레스테롤 개선에 도움을 줄 수 있는 고시형 건강기능식품으로 등록되어 있으며(MFDS, 2024), 건강기능성 식품첨가물로서 상업화되어 세계적으로 인공 배양되고 있다(Kim 등, 2008).
대량 재배를 위한 스피룰리나 생산공장은 일 년 내내 햇빛이 드는 적절한 기후조건이 있는 지역에서 이루어져야 하는데, 토지비용과 노동력이 비교적 저렴한 개발도상국에서는 열대 환경에서 스피룰리나를 대량 생산하고 있다(Usharani, 2012). 또한, 넓고 균일한 땅과 뜨거운 햇빛 등의 조건이 가능한 하와이나 뉴질랜드 지역에서도 노지 배양 방식으로 스피룰리나를 생산하고 있다. 노지배양 방식의 경우 자연에 노출되어 있어 온도에 영향을 많이 받으며, 태양복사선, 비, 바람 등과 같은 다양한 환경요인으로 인해 이상적인 성장을 이루기 어렵다(Usharani, 2012). 또한, 각종 이물질과 벌레와 같은 오염된 환경에 노출이 쉽다. 한편, 한국에서는 2013년 ㈜카이로스가 세계 최초로 스피룰리나를 인공 시설을 통한 대량 광배양 방식이 성공하면서, 청결 관리가 철저한 관을 통한 배양으로 순도가 높은 스피룰리나를 생산할 수 있게 되었다. 이러한 인공배양의 시작은 기존에 분말 및 정제 형태로만 수입되던 스피룰리나와는 다르게 살아있는 생물 형태의 스피룰리나를 원료로 사용할 수 있다는 장점이 있다. 해외에서도 인공 광배양 스피룰리나가 생산되고 있으나 생물 형태로 수입이 어려운 현실이다. 또한, 수입산 스피룰리나의 영양학적 및 기능적 특성에 대해서는 많이 연구되었으나, 국내산 광배양 생물 형태의 스피룰리나 원료에 대한 특성에 관한 정보는 매우 미비한 실정이다.
본 연구에서는 원료 국산화를 통한 수입대체 효과를 위해 인공 광배양된 스피룰리나(artificial light cultured spirulina, ALS)의 항산화 특성과 생리활성 성분을 분석하고 노지 배양된 수입산 스피룰리나(natural sunlight cultured spirulina, NSS)와 비교 분석하여 산업화를 위한 기초 자료를 구축하고자 수행하였다.
2. 재료 및 방법
2,2-Diphenyl-1-picrylhydrazyl(DPPH), 2,2’-Azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS), Folin and Ciocalteu’s reagent, protease, α-amylase는 Sigma-Aldrich사(St. Louis, MO, USA)에서 구입하였다. 표준품으로 사용된 gallic acid, folic acid, cyanocobalamin, phylloquinone은 Sigma-Aldrich사에서, L-ascorbic acid, quercetin은 Junsei Chemical사(Tokyo, Japan)에서 구입하였다. 3차 증류수는 순수제조기(Aqua MaxTM-Ultra, Young Lin Instrument Co., Anyang, Korea)로 정제된 물을 사용하였으며, 기타 시약 및 용매는 모두 HPLC 및 ACS급을 사용하였다.
노지 배양한 수입산 스피룰리나(NSS)는 분말형태의 제품(spirulina powder, Nutraceuticals International Co., Park City, UT, USA)을 구매하여 사용하였으며, 인공 광배양한 국내산 스피룰리나(ALS)는 전남 순천시 태양스피룰리나(주)에서 재배한 생물을 제공받아 실험에 사용하였다. 인공 광배양 시 스피룰리나 배지는 증류수 500 mL에 NaHCO3 13.61 g, Na2O3 4.03 g, K2PO4 0.5 g을 넣어서 스피르 용액 1배지를 제조하고, 증류수 500 mL에 NaNO3 2.5 g, K2SO4 1 g, NaCl 1 g, MgSO4 · 7H2O 0.2 g, CaCl2 · 2H2O 0.04 g을 넣어서 스피르 용액 2배지를 제조하여 혼합하였다. 혼합한 배지는 멸균 후, 상온에서 24시간 방치하였다. 비타민 B12 용액 1 mL를 멸균된 혼합 배지에 첨가하여 최종적으로 스피룰리나 배지(spirulina medium)를 제작하였다. 배양 조건은 제작된 스피룰리나 배지 800 mL에 Spirulina platensis 생물 1 mL를 접종하고, 25°C, 광량 4,000 Lux, 명암조건 16:8 시간으로 4-6주간 배양하였다. 배양된 시료는 −70°C에서 동결 보관하고, 분석을 위해 동결건조기(FDT-12012, Operon, Kimpo, Korea)에서 건조시켰다. 건조물은 분쇄기(HGBSSSS6, Waring, Torrington, CT, USA)로 분쇄한 다음 80 mesh sieve(Chunggye Co., Seoul, Korea)를 통과한 분말을 소분 및 진공포장 하여 −70°C에서 보관하며 분석 시료로 사용하였다(Fig. 1).

색도는 Minolta 색도계(CR-200, Minolta Co., Osaka, Japan)를 이용하여 측정하였으며, 측정 전 표준백색판의 명도(lightness, L): 97.10, 적색도(redness, a): −0.17 및 황색도(yellowness, b): 1.99 값을 교정값으로 보정하여 사용하였다. 각 샘플은 5회 이상 반복하여 측정하였고, ΔE는 NSS의 색도를 대조군으로 하여 아래의 식으로 계산하였다.
L1, a1, b1: Chromaticity values of experimental group
L2, a2, b2: Chromaticity values of control group
스피룰리나의 항산화능은 ABTS radical 소거능과 DPPH radical 소거능을 측정하였다. 시료 3 g에 70% ethanol 30 mL를 가한 뒤 40°C, 30분 동안 초음파 추출기(8893-DHT, Cole-Parmer, Chicago, IL, USA)로 추출하여 여과지(Whatman no. 1, GE Healthcare, Amersham, UK)로 여과한 추출액을 시험용액으로 사용하였다. ABTS radical 소거능은 Arts 등(2004)의 방법으로 측정하였다. 먼저, 2.45 mM potassium persulfate에 7 mM ABTS를 혼합하고 24시간 동안 냉장 및 암실에서 반응시켜 radical을 형성시켰다. 형성된 ABTS 라디칼의 흡광도가 734 nm에서 0.7±0.02가 되도록 희석하여 사용하였다. ABTS 희석액 285 μL와 시험용액 15 μL를 혼합하여 7분간 암실에서 반응시킨 뒤 microplate reader(Eon, BioTek Instruments, Winooski, VT, USA)로 734 nm에서 흡광도를 측정하였다. 측정값은 검량에 대입하여 ABTS radical 소거능으로 나타내었으며, μg ascorbic acid equivalent(AAE)/g으로 나타내었다. DPPH radical 소거능은 Blois의 방법(1958)으로 측정하였다. microplate의 각 well에 시험용액 60 μL와 0.2 mM DPPH 240 μL를 혼합하여 30분간 암실에서 반응시킨 후 microplate reader로 517 nm에서 측정하였다. 측정값은 검량선에 대입하여 DPPH radical 소거능으로 나타내었으며, mg gallic acid equivalent(GAE)/g으로 나타내었다.
총폴리페놀 함량은 Singleton(1999) 방법으로 측정하였으며, 총플라보노이드 함량은 Zhishen 등(1999)의 방법을 이용하여 측정하였다. 시료 3 g에 70% ethanol을 30 mL 가한 뒤 40°C, 30분 동안 초음파 추출하여 여과지(Whatman no. 1)로 여과한 추출액을 시험용액으로 사용하였다. 총폴리페놀 함량은 시험용액 40 μL에 3차 증류수 200 μL, 50% Folin 시약 20 μL를 차례로 가하여 혼합하고 실온에서 3분간 반응시켰다. 다음으로 5% Na2CO3를 40 μL씩 가한 후 암실에서 1시간 반응시킨 다음 microplate reader로 750 nm에서 흡광도를 측정하였다. 측정값은 검량선에 대입하여 총폴리페놀 함량으로 계산하였으며, mg GAE/g으로 나타냈다. 총플라보노이드 함량은 시험용액 100 μL에 70% ethanol 400 μL, 5% sodium nitrite 30 μL를 차례로 가하여 혼합하고 실온에서 5분간 반응시켰다. 그다음 10% aluminium chloride 30 μL와 1 M sodium hydroxide 200 μL를 가하여 혼합한 후 1분간 정치한 뒤, 증류수 200 μL를 가하고 microplate reader로 420 nm에서 흡광도를 측정하였다. 측정값은 검량선에 대입하여 총플라보노이드 함량으로 계산하였으며, mg of quercetin equivalent(QE)/g로 나타내었다.
피코시아닌 함량은 Bennett과 Bogorad(1973)의 방법으로 측정하였다. 시료 2 g에 증류수 20 mL를 넣고 1분간 균질화한 후, 4°C에서 200분간 반응시켰다. 다음으로 4°C에서 1,650 ×g으로 20분간 원심분리(MF-550, Hanil Science Industrial Co., Gwangju, Korea)하고, 상층액을 여과지(Whatman no. 1)로 여과하여 시험용액으로 사용하였다. 시험용액은 microplate reader를 사용하여 620 nm, 652 nm, 562 nm에서 각각 흡광도를 측정하였다. 측정값은 아래의 계산식을 이용하여 C-phycocyanin (C-PC), allophycocyanin(APC), phycoerythrin(PE)을 각각 계산하였으며, 총 피코시아닌 함량은 세 성분의 값을 더하여 계산하였다.
A: Absorbance
PC: C-phycocyanin
APC: Allophycocyanin
필로퀴논 함량은 Park 등(2023)의 방법으로 추출 및 분석하였다. 시료 1 g에 혼합 추출용매(dichloromethan:methanol= 2:1, v/v) 30 mL를 첨가하고, 1시간 동안 초음파 추출하였다. 추출액을 무수황산나트륨이 담긴 여과지(whatman No. 2)에 통과시켜 50 mL 메스플라스크로 이동시키고, methanol을 이용하여 최종 정용하여 추출액으로 사용하였다. 추출액 2 mL를 취하여 질소 농축한 후 n-hexane 2 mL에 재용해하였다. 혼합 정제용매(methanol:water=9:1, v/v) 8 mL를 첨가하여 1분간 진탕한 후, 5분간 718 ×g으로 원심분리하였다. 상층액 1 mL를 취하여 질소 농축한 다음 methanol 1 mL에 재용해하고, 0.45 μm PTFE membrane filter(Futecs Co., Ltd., Daejeon, Korea)로 여과하여 추출액으로 사용하였다. 여기파장(Exλ)을 243 nm, 방출파장(Emλ)을 430 nm로 설정한 형광 검출기가 장착된 HPLC(Agilent 1200, Agilent, Santa Clara, CA, USA)을 이용하여 필로퀴논 함량을 분석하였다. 컬럼은 ZORBAX Eclipse XDB-C18 column(4.6×150 mm, 5 μm, Agilent)에 아연을 충진한 empty column(2×50 mm, XC0502WT, YMC Co., Ltd., Kyoto, Japan)을 연결하여 사용하였다. 이동상은 methanol: dichloromethane(9:1, v/v) 혼합용액에 3 mM sodium acetate trihydrate, 10 mM zinc chloride, 5 mM acetic acid를 가하여 혼합한 후, 0.22 μm PVDF hydrophobic membrane filter (Merck Millipore Ltd., Cork, Ireland)로 여과하여 사용하였다. 시료 주입량은 20 μL, 컬럼 오븐 온도는 35°C, 유속은 1.0 mL/min으로 측정하였다.
엽산 추출 및 분석은 Chun 등(2006)의 방법으로 분석하였다. 시료 1 g에 20 mL sodium phosphate buffer(pH 7.8)와 30 mL 3차 증류수를 첨가한 후 항온수조(WB-20M, Jeio Tech, Daejeon, Korea)에서 15분간 100°C로 열탕 처리하였다. 실온으로 냉각시킨 후 protease(2 mg/mL) 1 mL와 sodium phosphate buffer(pH 7.8) 10 mL를 가하여 37°C 진탕 배양기(HB-201SF, Han-baek Scientific Co., Bucheon, Korea)에서 3시간 반응시켰다. 항온수조에서 10분간 100°C로 열탕 처리한 후, 실온으로 냉각하여 α-amylase(20 mg/mL) 1 mL와 toluene 0.5 mL를 가한 다음 37°C에서 2시간 진탕 배양하였다. 그다음 folate conjugase 용액(5 mg/mL in sodium phosphate buffer, pH 7.8) 4 mL를 가한 후 37°C 진탕 배양기에서 16시간 반응하고 5분간 열탕 처리하여 효소를 불활성화시켰다. 시료 반응액은 HCl을 이용하여 pH 4.5로 조정한 다음 100 mL로 정용 후, 여과지(Whatman no. 1)로 여과하여 추출액으로 사용하였다. 비타민 B9 결핍배지(folic acid casei medium:Lactobacilli broth= 1:1, v/v)에 L. casei를 접종한 후 37°C에서 약 6시간 배양하여 사용하였다. 분석 배지는 folic acid casei medium 10 mL에 L. casei 50 μL와 ascorbic acid(0.1 g/mL) 100 μL를 혼합하여 제조하였다. 분석 배지 150 μL를 96-well plate에 분주한 후, 첫 열에 추출액 150 μL를 넣고 단계 희석하여 37°C에서 18시간 동안 배양하였다. 추출액의 정량은 L. casei의 생육도를 microplate reader로 흡광도 595 nm에서 측정하였다. 검량선은 microplate reader의 데이터 분석 소프트웨어(Eon, Gen5, Biotek Instruments, Winooski, VT, USA)를 사용하였고, 엽산(비타민 B9) 함량은 μg/100 g으로 계산하여 나타내었다. 효소 공시험과 분석품질관리 시료도 같은 방법으로 시료와 함께 분석하였다.
코발라민류 추출 및 분석은 Jang 등(2014)의 방법으로 분석하였다. 시료 2 g에 0.2 M sodium acetate trihydrate buffer(pH 4.0, 1% sodium cyanide) 50 mL를 가한 뒤 플라스크 입구를 밀봉하여 10분간 초음파 추출하였다. 항온수조(WB-20M)에서 65분 동안 100°C로 추출하면서 코발라민류를 시아노코발라민(cyanocobalamin)으로 전환시켰다. 추출액은 냉각 후 Whatman No.1을 이용하여 여과하였다. 여과된 추출액은 immunoaffinity column(Easi-Extract Vitamin B12, R-Biopharm Rhone Ltd., Glasgow, UK)을 사용하여 3배 농축하였다. 농축된 시료액은 0.45 μm PTFE membrane filter로 여과하여 추출액으로 사용하였다. HPLC(1260 Infinity, Agilent)-photodiode array detector (PDA, Agilent)를 사용하여 분석하였다. Column은 ACE 3 AQ C18(3×150 mm, 3 μm, ACE, Aberdeen, Scotland, UK)를 사용하였으며, 컬럼 오븐 온도는 35°C, 검출파장은 361 nm였다. 이동상은 이동상 A를 water로, B를 acetonitrile로 하여 기울기 용리로 분석하였다. 이동상 기울기 조건은 이동상 A 100%로 시작하여 11분까지 이동상 B 15%가 섞이도록 흘려주었으며, 19분까지 이동상 A:B=75:25(v/v)가 되도록 하였다. 이후, 20분까지 이동상 A:B=90:10(v/v) 조성이 되도록 흘려주었으며, 26분까지 초기 조성과 같이 이동상 A 100%가 되도록 흘리고, 40분까지 이동상 A 100%를 유지하였다. 이때 시료 주입량은 100 μL, 유속은 1.0 mL/min으로 측정하였다. 코발라민류 함량은 시아노코발라민 (μg/100 g)으로 계산하여 나타내었다.
3. 결과 및 고찰
스피룰리나의 색도는 Table 1과 같다. ALS의 색도 L값(명도), a값(적색도), b값(황색도)은 각각 21.04, −5.45, 및 −0.21로 나타났으며, NSS는 각각 21.88, −6.20, 및 −0.27로 나타났으며 두 시료 모두 진한 청녹색을 보였다. 인공 광배양 스피룰리나와 노지 배양 스피룰리나의 명도와 적색도는 유의적인 차이를 나타내었으나(p<0.05), 황색도는 유의적인 차이를 보이지 않았다(p>0.05). Byun 등(1997)은 중국산 스피룰리나 분말의 색도는 각각 L값 20.0, a값 −5.9, b값 4.7이라고 보고하여, 명도와 적색도는 본 연구와 유사한 결과를 나타내었으나 황색도에서 차이를 나타내었다. Corekci 등(2015)은 ΔE의 값이 3.7 이상이어야 육안으로 색의 차이를 구분할 수 있다고 보고하였는데, 본 연구에서는 ΔE가 1.14로 두 시료 간에 육안으로 구별될 만큼 차이를 보이지는 않았으나, 인공 광배양 스피룰리나가 노지 배양에 비해 어두운 적색을 띠는 것으로 보인다.
| Sample1) | Chromaticity | |||
|---|---|---|---|---|
| L2) | a | b | ΔE | |
| NSS | 21.88±0.273) | −6.20±0.13 | −0.27±0.06 | - |
| ALS | 21.04±0.04 | −5.45±0.07 | −0.21±0.05 | 1.14±0.21 |
| t-value3) | −6.719**4) | 11.163*** | 1.676 | |
주로 자유 라디칼 소거 특성을 통해 세포 손상을 지연 또는 억제하는 항산화제는 스피룰리나에 많이 들어있으며(Kumar 등, 2022), 스피룰리나에서 발견되는 항산화 보호 효과는 피코시아닌, α-카로틴 및 기타 비타민과 미네랄에 의해 매개된다(Lu 등, 2010; Upasani와 Balaraman, 2003).
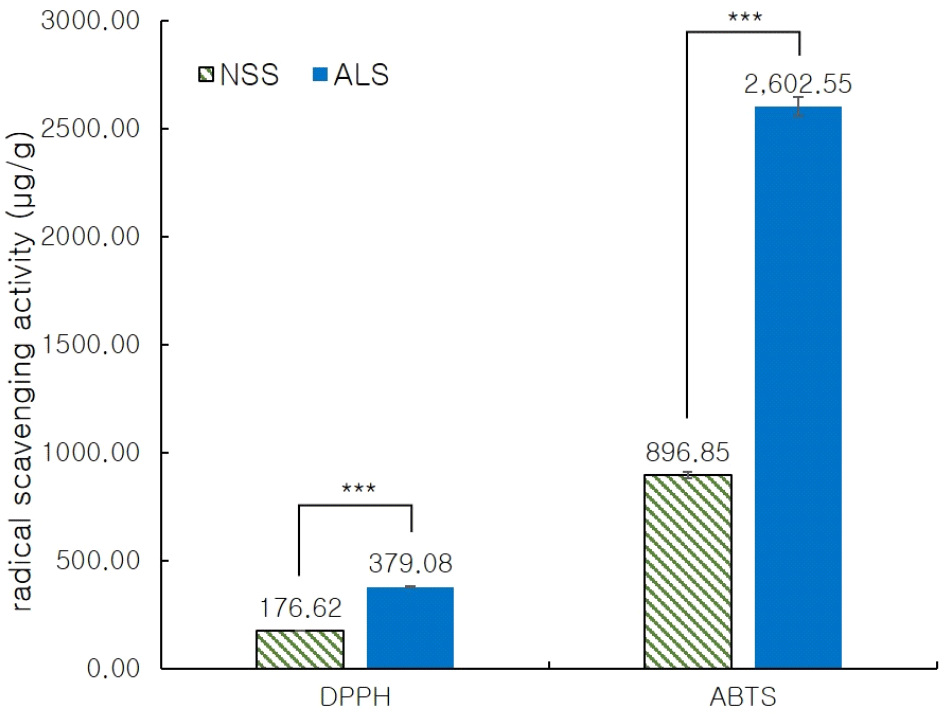
스피룰리나의 항산화능과 총폴리페놀 및 플라보노이드 함량은 Fig. 2와 3과 같다. DPPH 라디칼 소거 활성은 ALS(379.08 μg GAE/g)가 NSS(176.62 μg GAE/g)보다 약 2배 높았으며, ABTS 라디칼 소거 활성은 ALS가 2,602.55 μg AAE/g로 NSS (896.85 μg AAE/g)보다 약 3배 높았다. ALS의 총폴리페놀 함량은 5.21 mg GAE/g로 NSS(0.65 mg GAE/g)보다 약 8배 높았고, ALS의 총플라보노이드 함량은 10.79 mg QE/g로 NSS (7.68 mg QE/g)보다 약 1.4배 높았다. 인공 광배양이 노지배양에 비해 모든 항산화능과 항산화 함량이 높은 함량을 나타내어 스피룰리나는 인공 광배양이 높은 항산화 활성을 가지는 것을 알 수 있었다. 노지배양 조건은 광량과 명암시간이 일정하지 않으나, 인공 광배양 조건은 4,000 Lux의 높은 광량과 명암조건을 16:8시간으로 일정하게 배양하여 스피룰리나의 항산화 활성을 가지는 성분들의 함량이 증가한 것으로 사료된다. Kumar 등(2022)에 따르면 플라보노이드는 폴리페놀의 가장 큰 종류로, 폴리페놀의 하이드록실기 수소 기증 능력과 전자를 기증하는 능력으로 인해 총폴리페놀 함량이 항산화 활성과 높은 상관관계를 보인다고 보고하였다. 또한, 스피룰리나 추출물의 총폴리페놀 함량은 3,48-9.92 mg GAE/g이라고 보고하여 본 연구의 ALS 결과와 유사하였으며, 총플라보노이드 함량은 0.59-1.05 mg rutin equivalents(RE)/g이라고 보고하여, 본 연구와는 상반된 결과를 나타내었다.

남세균의 주요 보조 색소인 phycobiliproteins(PBPs)는 빛 흡수의 약 50%를 담당하며(Jaeschke 등, 2021), PBPs의 C-phycocyanin은 진한 파란색, allophycocyanin은 밝은 파란색, phycoerythrin은 빨간색을 나타내는 천연 색소이다(MacColl, 1998). 또한, 피코시아닌류는 색소의 특성 외에도 항염증, 항균, 신경 보호 및 간 보호 특성을 보이는 것으로 보고되어 있다(Estrada 등, 2001; Fernandez-Rojas 등, 2014; Jaeschke 등, 2021).
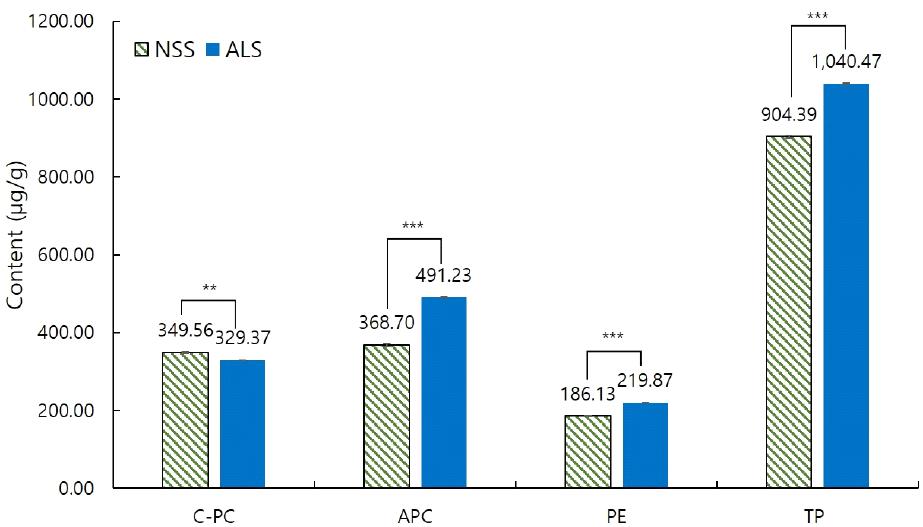
인공 광배양과 노지배양 스피룰리나의 피코시아닌 함량을 분석한 결과는 Fig. 4와 같다. C-phycocyanin, allophycocyanin, 및 phycoerythrin의 합으로 산출한 total phycocyanin 함량은 인공 광배양 스피룰리나가 1,040.47 μg/g을 나타내어 노지배양한 스피룰리나(904.39 μg/g)에 비해 약 1.2배 높은 것으로 나타났다. 피코시아닌은 광합성 색소 단백질이므로 4,000 Lux의 높은 광량과 16:8시간의 명암조건을 가지는 인공 광배양 조건이 광합성을 빠르게 진행시켜 피코시아닌 함량 또한 증가시킨 것으로 사료된다. 두 시료 모두 총 피코시아닌 함량 중 밝은 파란색을 띠는 allophycocyanin 함량이 가장 높은 비중(40.1-47.2%)을 차지했으며, 다음으로 진한 파란색을 띠는 C-phycocyanin (31.7-38.7%), 그 다음으로 붉은색을 띠는 phycoerythrin (20.6-21.1%)의 순으로 높게 나타났다. 각각의 피코시아닌 함량을 비교해 보면, C-phycocyanin은 노지배양한 스피룰리나(349.56 μg/g)가 인공 광배양 스피룰리나(329.37 μg/g)보다 유의적으로 높게 나타났으며(p<0.01), allophycocyanin과 phycoerythrin에서는 인공 광배양 스피룰리나 시료가 노지배양 스피룰리나에 비해 유의적으로 높은 수준을 나타냈다(p<0.001). Bae 등(2020)의 연구에 따르면 스피룰리나의 C-phycocyanin 함량이 0.40 mg/g, allophycocyanin 함량은 0.36 mg/g이라고 하여 C-phycocyanin은 본 연구 결과보다 높게 나타났으며, allophycocyanin은 노지배양한 스피룰리나와 유사한 경향을 나타내었다.
필로퀴논은 비타민 K1으로 불리는 지용성 비타민의 하나로 식물과 미세조류에 풍부하게 함유되어 있으며, 인체 내에서는 혈액 응고와 뼈와 혈관 건강을 포함한 많은 생리활동에 중요한 역할을 한다(Tarento 등, 2018). 미세조류는 높은 성장률, 비교적 쉬운 스크리닝, 유전적 단순성으로 인해 필로퀴논의 생합성이 식물보다 쉬우며 식품으로 제형화 하기에 더 적합한 것으로 평가된다(Demain과 Adrio, 2008; Tarento 등, 2018).
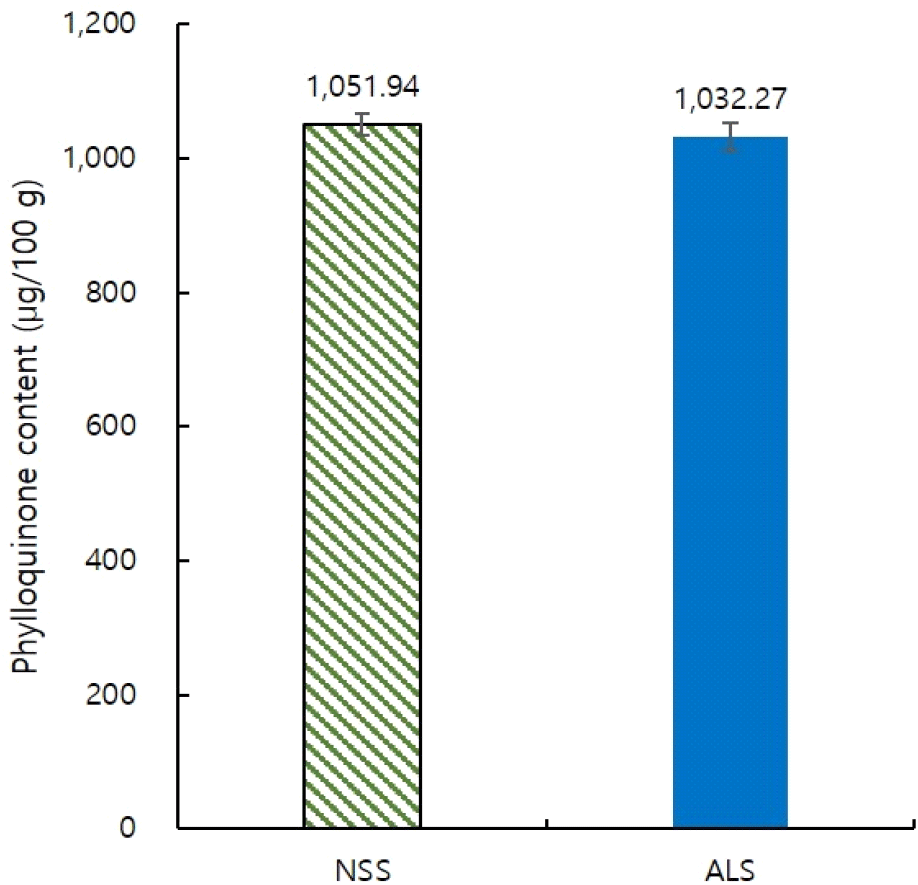
스피룰리나의 필로퀴논 함량은 Fig. 5와 같으며, 인공 광배양된 스피룰리나(ALS)는 1,032.27 μg/100 g으로 노지배양한 스피룰리나인 NSS(1,051.94 μg/100 g)와 유의적인 차이를 나타내지 않았다(p>;0.05). 한편, Tarento 등(2018)은 미세조류 중에서 남세균이 가장 높은 수준의 필로퀴논을 보유하고 있으며, 남세균의 하나인 스피룰리나의 필로퀴논 함량은 1,000 μg/100 g 수준이라고 보고하였는데, 본 연구에서도 이와 유사한 결과를 나타냈다. 필로퀴논의 인체 섭취량은 체중 1 kg당 일일 약 1 μg이 충분한 것으로 보고되었다(IOM, 2001; Turck 등, 2017). 한국인 영양소 섭취 기준(MOHW와 KNS, 2020)에 따르면 비타민 K의 일일 충분 섭취량이 성인 여성 기준 65 μg/day로 약 6 g의 스피룰리나 분말만으로 충분한 필로퀴논 함량을 섭취할 수 있을 것으로 사료된다. 현재까지 비타민 A와 D가 스피룰리나의 주된 지용성 비타민으로 알려졌으나 본 연구를 통하여 비타민 K 함량도 매우 높음을 확인할 수 있었다.
비타민 B9과 비타민 B12는 생화학적으로 상호 밀접한 관계가 있는 수용성 비타민으로(Afman 등, 2005; Min과 Kim, 2009), 비필수 아미노산인 호모시스테인을 필수 아미노산인 메티오닌으로 메틸화되는 과정에서 중요한 보조인자 역할을 한다(Ubbink 등, 1993). 특히 비타민 B12의 경우 주로 동물성 식품에 존재하여 채식주의자에게 결핍이 자주 발생한다.
스피룰리나의 비타민 B9과 비타민 B12 함량 수준은 Table 2와 같다. 비타민 B9과 B12 함량 모두 노지배양한 스피룰리나(NSS)가 인공 광배양 스피룰리나(ALS)보다 각각 1.4배와 1.3배 높은 수준을 나타났다. 본 연구에서 분석한 스피룰리나의 비타민 B9 함량은 인공배양 스피룰리나 62.24 μg/100 g, 노지배양 스피룰리나 92.85 μg/100 g으로 상당히 높은 수준을 나타냈는데, 이는 미국 FoodData Central (USDA, 2024)에서 보고한 건조 스피룰리나의 비타민 B9 함량은 94 μg/100 g이라고 보고하여 본 연구 결과와 유사한 수준인 것을 확인할 수 있었다. 비타민 B12는 일반적으로 식물성 식품에서 존재하지 않고 동물성 식품에서 존재한다. 본 연구에서 분석한 스피룰리나의 비타민 B12 함량은 인공배양 스피룰리나 18.62 μg/100 g, 노지배양 스피룰리나 23.33 μg/100 g으로 상당히 높은 수준을 나타냈는데, 이는 스피룰리나의 비타민 B12 함량이 풍부하다고 보고한 Watanabe 등(2002)의 연구 결과와도 일치하였다. 하지만, 미국 FoodData Central(USDA, 2024)에서 보고하는 건조 스피룰리나의 비타민 B12 함량은 0 μg/100 g으로 나타나 본 연구 결과와는 상당한 차이를 보여주었다. 일일 권장섭취량이 비타민 B9 400 μg Dietary Folate Equivalents(DFE)/일, 비타민 B12 2.4 μg/일(MOHW와 KNS, 2020)을 기준으로 할 때, 비타민 B12의 경우 약 10~13 g의 스피룰리나 분말을 섭취 시 일일 권장섭취량을 충족하는 것으로 보인다.
| Sample1) | Vitamin B9 (μg/100 g) | Vitamin B12 (μg/100 g) |
|---|---|---|
| NSS | 92.85±2.74 | 23.33±1.38 |
| ALS | 62.24±3.19 | 18.62±0.39 |
| t-value2) | −12.592*** | −5.866* |
4. 요약
본 연구에서는 인공 광배양한 스피룰리나(ALS)와 노지 배양한 스피룰리나(NSS)의 항산화 특성과 생리활성 성분을 분석 비교하였다. ALS의 색도 L값(명도), a값(적색도), 그리고 b값(황색도)은 각각 21.04, −5.45, 및 −0.21로 NSS(각각 21.88, −6.20, 및 −0.27)에 비해 다소 어둡고 갈색빛을 나타냈다. 그러나 ΔE가 1.14로 두 시료 간에 육안으로 구별될 만큼 차이를 보이지는 않았다. DPPH 라디칼 소거능은 ALS가 379.08 μg GAE/g으로 NSS(176.62 μg GAE/g)보다 약 2배 높은 수준이었다. ABTS 라디칼 소거능도 ALS가 2,602.55 μg AAE/g으로 NSS(896.85 μg AAE/g)보다 약 3배 높았다. 총폴리페놀 함량은 ALS(5.21 mg GAE/g)가 NSS(0.65 mg GAE/g)보다 약 8배 높았고, 총플라보노이드 함량도 ALS(10.79 mg QE/g)가 NSS (7.68 mg QE/g)보다 약 1.4배 높은 값을 보였다. C-phycocyanin, allophycocyanin 및 phycoerythrin 함량의 합으로 산출한 총피코시아닌 함량은 ALS가 1,040.47 μg/g으로 NSS(904.39 μg/g)보다 약 1.2 배 높았다. 반면, C-phycocyanin 함량은 NSS(349.56 μg/g)이 ALS(329.37 μg/g)보다 유의적으로 높았다(p<0.01). 필로퀴논 함량은 ALS(1,032.27 μg/100 g)와 NSS(1,051.94 μg/100 g)가 유의적인 차이를 보이지 않았다(p>0.05). NSS의 비타민 B9와 B12 함량은 각각 92.85 μg/100 g과 23.33 μg/100 g으로 ALS보다 약 1.4배 높게 나타났다. 전체적으로 스피룰리나의 수용성 비타민 B9과 B12 함량은 노지배양한 스피룰리나(NSS)가 높았으나, 항산화능과 기능성 피코시아닌 함량은 인공 광배양한 스피룰리나(ALS)가 높은 수준인 것으로 나타났다. 이에 근거할 때, 인공 광배양으로 생산하는 스피룰리나는 생리활성 성분이 우수하고, 주요 수용성 및 지용성 비타민 수준이 높아 우수한 식품소재로 활용될 수 있을 것으로 보인다.











