1. 서론
암은 전 세계적으로 높은 발병률과 치명률을 가지고 있어 심각한 건강 문제로 여겨지고 있다(Choi, 2021). 암은 세포의 비정상적인 증식에 의해 발생하는 질환으로 이를 치료하기 위한 항암제는 다양한 분자적 기전을 통해 세포 분열 및 증식 억제, 선택적인 세포 사멸(apoptosis) 유도를 통해서 암세포를 제거한다(Kawabe, 2004; Kim, 2018). 그 중, 암세포의 apoptosis 유도를 표적으로 하는 것은 항암제 개발에 있어서 중요 기작으로 여겨지고 있다(Fan 등, 2014; Kim 등, 2016; Luiz-Ferreira 등, 2023). 암 치료를 위해 다양한 종류의 항암제들이 사용되고 있지만, 항암제의 독성으로 인해 암세포뿐만 아니라, 정상 세포에도 영향을 미쳐 다양한 부작용을 야기하고 있다(Gao 등, 2017). 따라서 부작용의 발생을 줄이기 위해 안전성이 검증된 천연 소재를 이용하여 apoptosis 경로를 표적으로 하며, 암세포 제거에 있어서 효과를 나타내는 소재 개발을 위한 연구들이 진행되고 있다(An 등, 2019; Ryu 등, 2021).
후코이단은 다시마와 미역 등을 포함하는 갈조류에서 분리된 고분자의 황화 다당체로 항산화, 항균, 항당뇨, 항바이러스, 항염 등 다양한 생리활성을 가지고 있어 이를 활용하기 위한 다양한 연구들이 이루어지고 있다(Fitton, 2011; Fitton 등, 2015; Kan 등, 2017; Krylova 등, 2021; Mabate 등, 2021; Wang 등, 2012). 또한, 후코이단은 간암, 혈액암, 대장암, 유방암 등의 암세포 내 apoptosis 활성화, 전이 및 신생 혈관 생성 억제 효과가 있음이 보고되며 암 치료에 대한 활용 가능성이 제시되었다(Ale 등, 2011; Atashrazm 등, 2015; Kyung 등, 2012; Nagamine 등, 2009; Senthilkumar 등, 2013; Zhang 등, 2013). 그뿐만 아니라 보충제로서 섭취 시에도 추가적인 암 발생을 예방하는데 효과를 나타내는 것으로 보고되었다.
이고들빼기(Crepidiastrum denticulatum (Houtt.) Pak & Kawano)는 국화목 국화과에 속하는 관속식물로 강화고들빼기로 부르기도 하며 어린 뿌리와 잎이 주로 식용 채소로 이용되고 있다(Lee 등, 2014). 페놀 화합물인 hydroxycinnamic acids, caffeic acid, chlorogenic acid, chicoric acid, 3,5-di-O-caffeoylquinic acid, luteolin-7-O-glucoside 등을 포함하는 다양한 생리활성 물질을 포함하고 있으며, 또한 허혈에 의한 신장 손상 억제, 알코올에 의한 간 손상 및 지방간 생성 억제, 자외선에 의한 피부 손상 억제, 비알코올성 지방간 및 간염 개선, 산화적 스트레스에 의한 망막 손상 억제 효과 등을 가지고 있는 것으로 알려져 있다(Ahn 등, 2014; Kang 등, 2011; Kim 등, 2015; Kim 등, 2017; Lee 등, 2014; Maeda 등, 2006: Yoo 등, 2014). 이고들빼기에서 분리된 화합물인 youngiaside A, B, C가 해독효소인 quinone reductase와 CYP1A1을 유도하여 항암제로 이용 가능성에 대해 보고되어 있지만, apoptosis 유도에 대하여서는 정확하게 보고된 바 없다(Yun 등, 2010).
천연물을 이용한 복합 소재는 유효성이 있는 여러 물질이 복합적으로 이루어진 구성이므로 다양한 효능을 나타낼 수 있으며, 추출 방법이나 혼합 비율에 따라서 효능이 달라지며 기존의 효과 대비 서로 상승효과를 나타낼 수 있어 복합 소재를 이용한 항암제 개발이 진행되고 있다(Kong 등, 2023; Park 등, 2015; Song 등, 2023). 이에 본 연구에서는 기존 연구를 통해 apoptosis에 의한 암세포 사멸 유도 효과가 입증된 후코이단과 apoptosis 유도를 통해 항암 효과를 나타내는 페놀성 화합물인 chlorogenic acid, caffeic acid, hydroxycinnamic acids, luteolin-7-O-glucoside 등을 포함하고 있는 것으로 보고된 이고들빼기를 이용하여 후코이단/이고들빼기 혼합물을 제조하고 이고들빼기 추출물에 의해 기존의 후코이단 단독 처리보다 암세포의 증식 억제 및 apoptosis 유도 효능 증대 여부를 확인하기 위해 인체 간암 세포주인 HepG2 세포를 사용하여 세포 독성과 apoptosis의 유도 및 관련 단백질의 발현 변화를 분석하였다.
2. 재료 및 방법
Minimum essential medium (MEM), bicinchoninic acid (BCA) protein assay kit, enhanced chemiluminescent substrate는 Thermofisher (Waltham, MA, USA)에서 구입하여 사용하였다. Fetal bovine serum (FBS)은 Welgene (Gyeongsan, Korea)에서 구입하여 사용하였다. 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), radioimmunoprecipitation assay (RIPA) buffer는 Sigma-Aldrich Chemical Co (St. Luis, MO, USA)에서 구입하여 사용하였다. Mitochondrial membrane potential assay kit는 Abcam (Cambridge, UK)에서 구입하여 사용하였다. Cytotoxicity detection kit와 cell death detection kit는 Roche Diagnostics (Mannheim, Germany)에서 구입하여 사용하였다. p53, β-actin, cleaved caspase-3, cleaved caspase-9, Bcl-2, Bax, cytochrome c 및 anti-rabbit IgG-HRP conjugated, anti-mouse IgG-HRP conjugated는 Cell Signaling Technology (Beverly, MA, USA)와 Santa Cruz Biotechnology Inc (Santa Cruz, CA, USA)에서 구입하여 사용하였다.
전남지역에서 채취한 미역귀로부터 분리한 후코이단(순도: 93.3%, 황산기: 35.0%, 총당 함량: 32%)은 Biocorp (Goheung-gun, Korea)에서 구입하여 사용하였다. 이고들빼기 추출물 제조를 위해 전초 35 kg을 세척 후 DW 350 L를 첨가하고 100°C에서 3시간 동안 단회 추출하였다. 추출액을 여과한 후 여과액을 농축기(Tokyo Rikakikai, Tokyo, Japan)를 이용하여 55°C에서 농축하였다. 이고들빼기 농축액을 분무 건조하였다. 이고들빼기 추출물은 8.89 kg을 얻어 25.4%의 수율을 나타냈다. 후코이단/이고들빼기 혼합물은 분말 상태의 후코이단과 이고들빼기 추출물을 각각 1:1 비율로 혼합하여 만든 후 −20°C에 보관하며 실험에 사용하였다.
이고들빼기 추출물의 총폴리페놀 함량은 Folin-Denis의 방법에 따라 측정하였다(Folin과 Denis, 1912). 시료 1 mL에 Folin-Ciocalteu reagent 5 mL를 가하여 3분 동안 반응시킨 후 10% Na2CO3 용액 5 mL를 가하였다. 1시간 동안 반응시킨 후 spectrophotometer (Molecular Devices, San Jose, CA, USA)를 이용하여 700 nm에서 흡광도를 측정하였다. 표준물질로 tannic acid를 사용하였으며, 표준물질의 검량선과 비교하여 함량을 구하였다.
본 연구에 사용된 HepG2 세포는 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)으로부터 분양받아 사용하였으며, 10% FBS와 1% antibiotic-antimycotic이 함유된 MEM 배지를 사용하여 5% CO2, 37°C로 조절된 조건에서 배양하였다.
HepG2 세포를 96 well plate에 2×104 cells/well로 각 well에 분주하고 16시간 동안 안정화 시킨 후, 후코이단/이고들빼기 혼합물을 농도별로 처리하였다. 24시간 동안 배양한 후, 배지로 희석한 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT, 0.5 μg/mL)를 각 well에 100 μL씩 첨가하여 4시간 동안 배양하였다. MTT가 포함된 배지를 모두 제거하고 dimethyl sulfoxide (DMSO)를 100 μL씩 각 well에 넣어 생성된 formazan을 녹인 뒤, microplate reader (Molecular Devices)로 540 nm에서 흡광도를 측정해 세포 생존율을 계산하였다.
HepG2 세포를 24 well plate에 1×104 cells/well로 분주하고 16시간 동안 안정화시킨 후, 후코이단/이고들빼기 혼합물을 농도별로 24시간 처리하였다. 처리 후 배지를 회수하여 250 ×g에서 5분간 원심분리하였다. 그 후, 상층액을 취하여 96 well plate로 옮긴 후 cytotoxicity detection kit를 이용하여 kit에서 제공한 실험방법에 따라 진행하였다. 상층액 100 μL와 reaction mix reagent 100 μL를 혼합하고 암조건에서 30분간 반응시킨 후 stop solution 50 μL를 가하여 반응을 정지시킨 후 microplate reader로 490 nm에서 흡광도를 측정하여 LDH 활성을 계산하였다.
HepG2 세포를 24 well plate에 1×104 cells/well로 분주하고 16시간 동안 안정화시킨 후, 후코이단/이고들빼기 혼합물을 농도별로 24시간 처리하였다. 처리 후 cell death detection kit를 이용하여 kit에서 제공한 실험방법에 따라 진행하였다. 상층액 20 μL와 immunoreagent 80 μL를 혼합하고 암조건에서 2분간 반응시킨 후 ABTS 100 μL를 가하였다. 반응을 정지시키기 위해 stop solution을 처리하고 microplate reader로 405 nm에서 흡광도를 측정하여 DNA fragmentation 정도를 계산하였다.
HepG2 세포를 96 well plate에 1.5×104 cells/well로 분주하고 16시간 동안 안정화시킨 후, 후코이단/이고들빼기 혼합물을 농도별로 24시간 처리한 후 mitochondrial membrane potential assay kit를 이용하여 kit에서 제공한 실험방법에 따라 진행하였다. PBS로 세포를 씻어준 후, JC-1 solution 100 μL를 처리하고 37°C에서 10분간 반응시켜 세포를 염색하였다. JC-1 solution을 제거하고 세포를 PBS로 세포를 씻어준 후, 원심분리하여 얻은 상층액에 reaction mix 50 μL와 4 mM DEVD-pNA 5 μL를 혼합하고 37°C에서 1시간 동안 반응시켰다. Fluoroscence microplate reader (Molecular Devices)로 excitation 485 nm/emission 530 nm에서 흡광도를 측정하여 mitochondrial membrane potential을 계산하였다.
HepG2 세포를 60 mm에 1×104 cells/well로 분주하고 16시간 동안 안정화시킨 후, 후코이단/이고들빼기 혼합물을 농도별로 24시간 처리한 후 caspase-3 assay kit (Abcam)를 이용하여 kit에서 제공한 실험방법에 따라 진행하였다. 처리 끝난 후, 회수한 세포를 lysis buffer 50 μL를 처리하고 10분간 반응시킨 후 원심분리하여 얻은 상층액에 reaction mix 50 μL와 4 mM DEVD-pNA 5 μL를 혼합하고 37°C에서 1시간 동안 반응시켰다. Microplate reader로 400 nm에서 흡광도를 측정하여 caspase-3 활성을 계산하였다.
후코이단/이고들빼기 혼합물을 24시간 동안 처리한 후 HepG2 세포를 PBS로 씻어준 후, RIPA buffer 150 μL를 20분간 4°C에서 처리하였다. 세포를 회수하고 4°C, 12,000 rpm으로 20분간 원심분리하여 단백질을 분리하였다. 단백질 농도는 bicinchoninic acid (BCA) protein assay kit (Thermofisher)를 이용하여 microplate reader로 562nm에서 흡광도를 측정하여 계산하였다. 10%, 12% sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE)을 이용하여 단백질을 크기별로 분리한 후, polyvinylidene fluoride (PVDF) membrane (Sigma-Aldrich Co.)에 transfer하였다. Everyblot blocking buffer (Bio-rad, Hercules, CA, USA)을 이용하여 상온에서 10분 동안 blocking하고 1차 항체(1:1,000-1:5,000)를 실온에서 2시간 반응시켰다. 그 후 2차 항체(1:1,000-1:4,000)를 상온에서 2시간 반응시킨 후, enhanced chemiluminescent substrate (Thermofisher)를 처리하여 PVDF membrane에 나타난 protein band를 Microchemi 4.2 (DNR, Neve Yamin, IS)로 관찰하고 각 단백질의 발현 정도를 분석하였다.
3. 결과 및 고찰
식물체에 존재하는 폴리페놀 화합물은 flavonoids, anthocyanins, tannins, catechins, isoflavones, resveratrols 등을 포함하는 2차 대사 산물로 분자 내에 히드록실기(-OH)를 가지고 있으며, 뛰어난 항산화와 항암 효과를 가지고 있을 뿐만 아니라 항염증, 콜레스테롤 저하, 정장작용 등의 생리활성을 가지고 있다(Kim 등, 2012b). 본 연구에서 분석한 이고들빼기 추출물의 총폴리페놀 함량은 4,214±2.50 mg/100 g으로 나타났다. 이고들빼기에는 페놀성 화합물인 chlorogenic acid, caffeic acid, hydroxycinnamic acids, luteolin-7-O-glucoside 등 포함되어 있으며 이러한 물질들은 높은 항산화 효과뿐만 아니라, apoptosis를 유도하여 비인두암, 유방암, 신장암, 자궁경부암 등에 대한 항암효과를 가지고 있는 것으로 보고된 바 있어 본 연구에서도 이고들빼기 추출물에 의한 항암 효과도 이와 관련성이 있을 것으로 추정된다(Chang 등, 2010: Chuang등, 2005; Ho 등, 2021; Kaneta 등, 1978; Wang 등, 2019; Zeng 등, 2021).
HepG2 세포에 대한 후코이단/이고들빼기 혼합물의 세포 독성을 확인하기 위해 혼합물을 농도별로 24시간 동안 처리하고 MTT assay를 통해 세포 독성을 평가하였다. 후코이단/이고들빼기 혼합물을 0, 10, 30, 50, 100, 150, 200, 300, 500 μg/mL의 농도로 24시간 동안 처리한 결과, Fig. 1A에서 보여주는 바와 같이 농도별로 105, 101, 99, 91, 86, 77, 62, 41%의 생존율을 나타냈으며 농도 의존적으로 세포 증식을 억제함을 확인하였다.
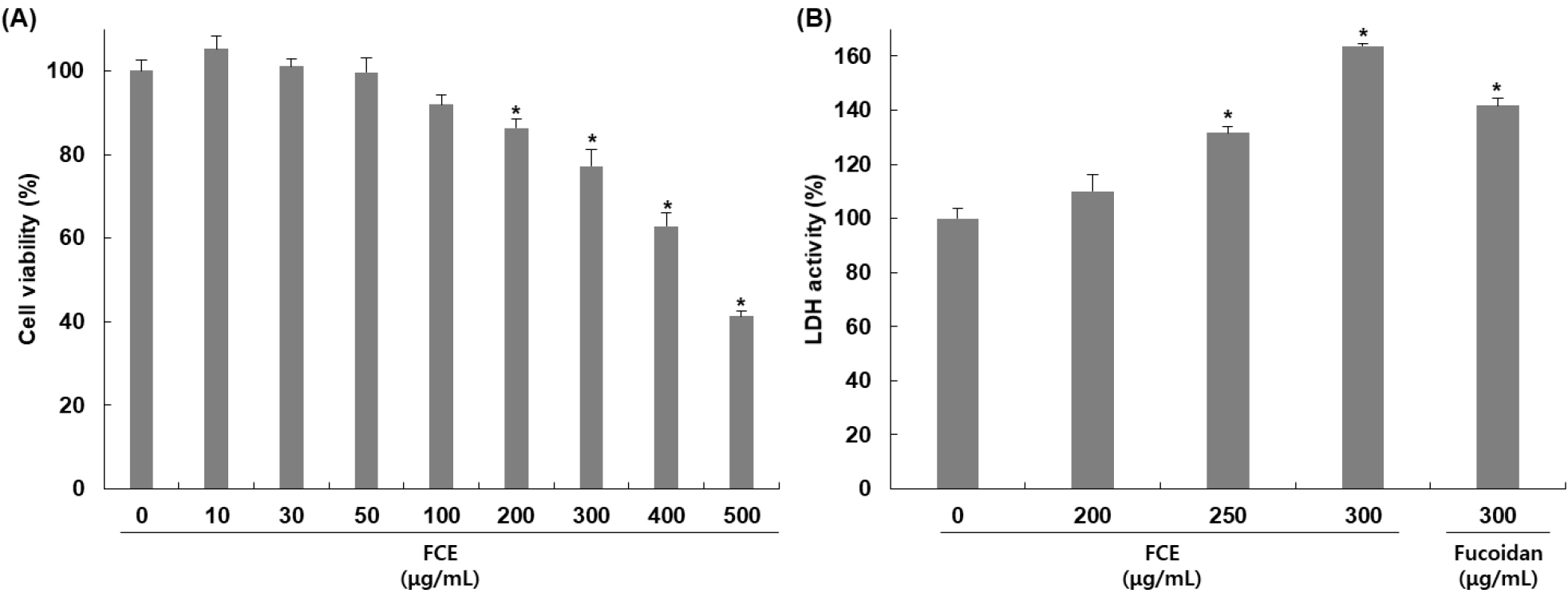
후코이단/이고들빼기 혼합물의 독성에 의한 HepG2 세포 손상 정도를 확인하기 위하여 배지 내에 존재하는 LDH의 활성을 측정한 결과는 Fig. 1B와 같다. 후코이단/이고들빼기 혼합물을 200, 250, 300 μg/mL 농도로 처리하고 24시간 동안 반응시켰을 때 나타난 LDH 활성을 확인한 결과, 무처리군 대비 농도별로 119, 131, 152%로 농도 의존적으로 증가하였으며, 후코이단만 300 μg/mL 농도로 처리하였을 때는 136% 증가하여 혼합물의 활성이 더 높게 나타남을 확인하였다. 세포 손상이 발생하면 세포질에 존재하는 효소인 LDH는 세포 외부로 유출되어 농도가 증가하며 이로 인해 LDH의 증가는 세포 손상의 지표로 여겨진다(Kim 등, 2016). Apoptosis 또한 세포 손상을 일으키며 LDH 증가가 나타남으로써 apoptosis와 LDH가 세포 생존과 사멸을 조절하는 데 밀접하게 연관되어 있으며 중요한 역할을 하는 것으로 여겨지고 있다(Kim 등, 2012a). 따라서 후코이단/이고들빼기 혼합물에 의해 나타난 세포 증식 억제가 세포 손상에 의한 apoptosis 유도에 의한 것임을 확인할 수 있었다. Guo 등(2016)의 연구에서도 kaempferol에 의해 HepG2 세포 생존율 감소 및 LDH 활성 증가를 확인하였고, 이를 통해서 kaempferol이 세포 증식 억제 및 세포 손상을 증가시키며 apoptosis를 유도한다고 보고하였다.
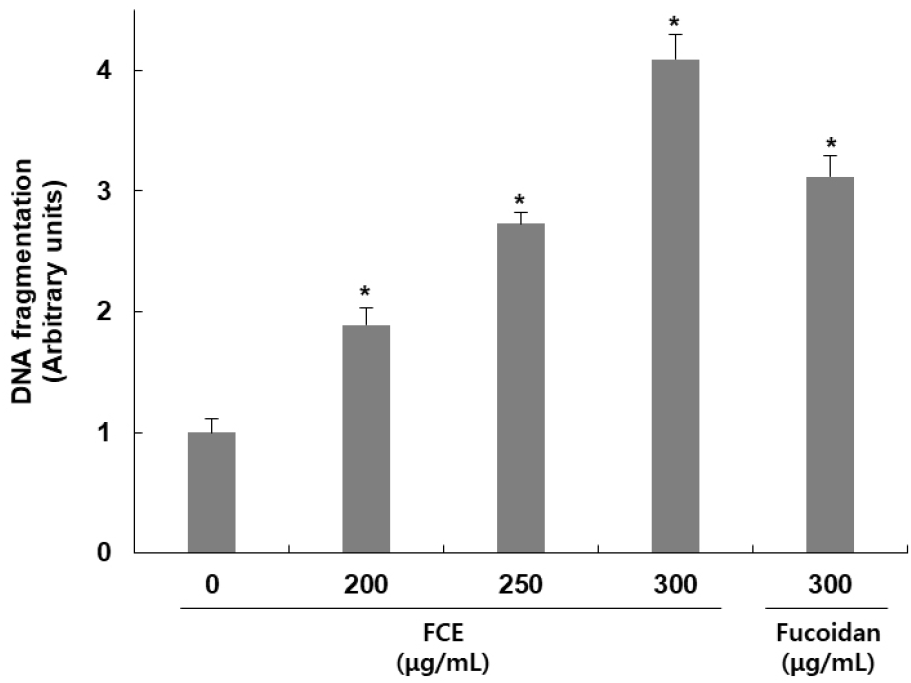
후코이단/이고들빼기 혼합물이 HepG2 세포 내 DNA fragmentation에 미치는 영향을 확인하기 위해 측정한 결과는 Fig. 2와 같다. 후코이단/이고들빼기 혼합물을 200, 250, 300 μg/mL 농도로 처리하고 24시간 동안 반응시켰을 때 나타난 DNA fragmentation을 확인한 결과, 무처리군 대비 농도별로 89, 173, 309% 증가하여 혼합물 처리에 의해 DNA fragmentation이 일어난 것을 확인하였으며, 후코이단만 300 μg/mL 농도로 처리하였을 때는 무처리군 대비 212% 증가가 나타나, 혼합물에 의한 DNA fragmentation이 더 강하게 나타남을 확인하였다. Apoptosis가 일어난 세포에서 나타나는 특징 중 하나인 DNA fragmentation은 핵 내의 endonuclease가 활성화되어 chromosomal DNA를 단편화시킴으로써 나타나는 전형적인 현상이다(Yoshida 등, 2006). 이를 통해 후코이단/이고들빼기 혼합물에 의한 HepG2 세포의 증식 억제는 apoptosis에 의해 나타나는 것임을 알 수 있었다. Chao 등(2019)의 연구에서도 peiminine 처리에 의해서 apoptosis가 발생한 세포에서 나타나는 특징 중에 하나인 DNA fragmentation이 나타났으며, apoptosis에서 중심적인 역할을 하는 caspase-3의 활성 억제에 의해 DNA fragmentation이 감소됨을 확인함으로서 piminine이 apoptosis 유도 효과를 가지고 있음을 보고하였다.
후코이단/이고들빼기 혼합물의 HepG2 세포 내 apoptosis 유도가 미토콘드리아 손상에 의한 미토콘드리아 막 전위의 탈분극과 연관되어 있는지를 확인하기 위하여 MMP의 변화를 측정한 결과, 무처리군 대비 후코이단/이고들빼기 혼합물을 200, 250, 300 μg/mL 농도로 처리한 군에서는 처리농도 증가에 따라 MMP가 9, 18, 37% 감소됨을 확인하였으며, 후코이단만 300 μg/mL 농도로 처리하였을 때는 무처리군 대비 24% 감소가 나타나 혼합물에 의한 DNA fragmentation이 더 높게 나타남을 확인하였다(Fig. 3A). 또한, 미토콘드리아 내막에 존재하는 cytochrome c는 미토콘드리아 기능 손상으로 인한 막 전위 변화로 인해 세포질 내로 방출이 증가하므로 세포질에서 cytochrome c의 발현 변화를 확인한 결과, 후코이단/이고들빼기 혼합물을 200, 250, 300 μg/mL 농도로 처리한 군에서는 처리농도 증가에 따라 무처리군 대비 미토콘드리아에서 발현은 267, 414, 427% 증가함을 확인하였고, 후코이단만 300 μg/mL 농도로 처리한 군에서는 무처리군 대비 미토콘드리아에서 발현은 322% 증가함을 확인하였다(Fig. 3B).
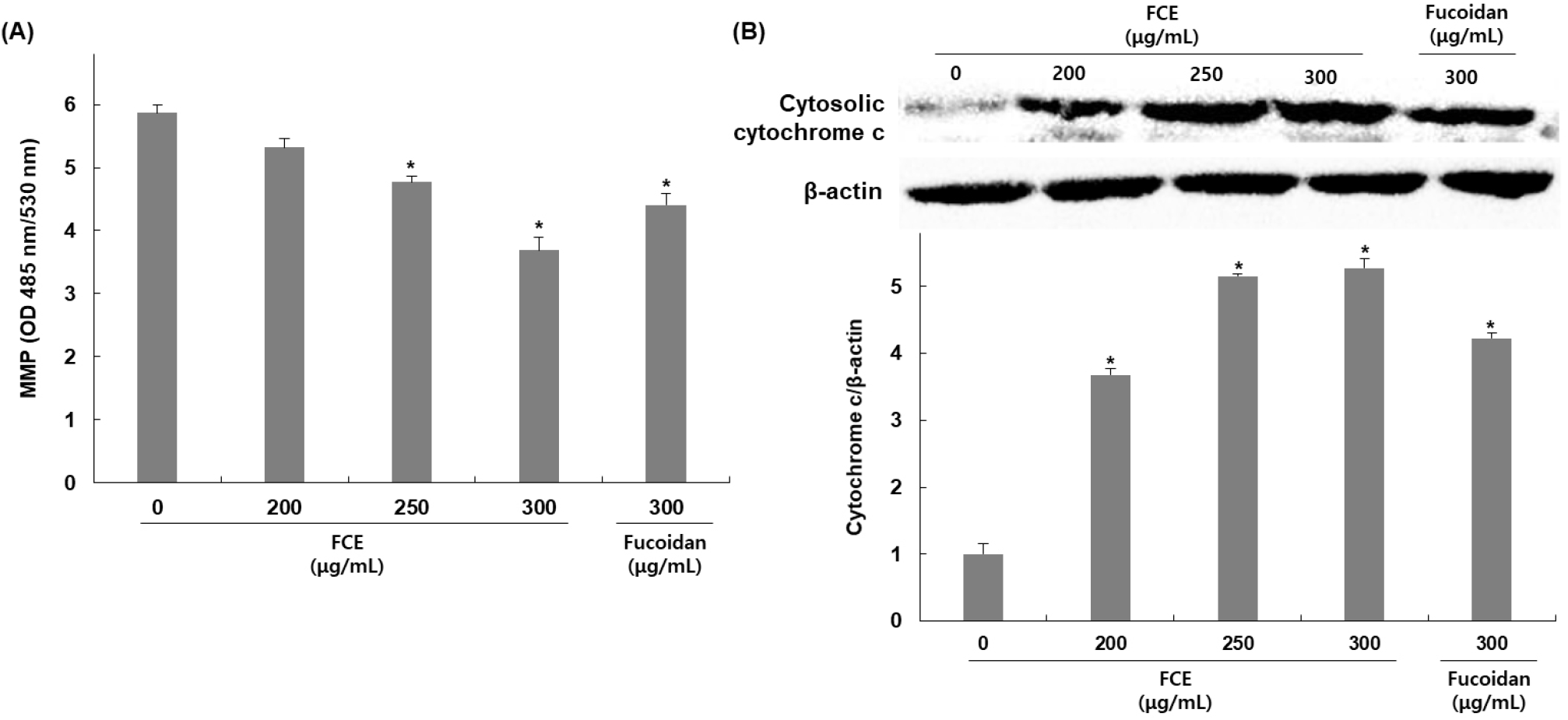
MMP는 미토콘드리아 내막의 전기적인 전위 차이를 나타내며, 미토콘드리아 기능의 중요한 지표로 여겨지고 있다(Kunnumakkara 등, 2007). Apoptosis 초기에 MMP의 감소가 나타나며 이로 인해 permeability transition pore의 개방을 유발하여 cytochrome c뿐만 아니라 그 외 apoptosis 유발인자들의 방출이 일어난다(Qi 등, 2017). 방출된 cytochrome c는 단백질 복합체인 apoptosome을 형성하여 caspase의 활성을 증가시키며 최종적으로 apoptosis을 일으키는 역할을 한다(Li 등, 1997; Riedl 등, 2005). 이에 따라 MMP와 cytochrome c는 apoptosis와 밀접하게 연관되어 있으며 apoptosis를 조절하는데 중요한 요소로 볼 수 있다. 따라서 본 연구를 통해 후코이단/이고들빼기 혼합물에 의해 MMP의 감소 및 세포질 내 cytochrome c의 발현 증가를 확인하였으며 이는 후코이단/이고들빼기 혼합물이 미토콘드리아 기능 손상을 유도하여 apoptosis가 일어난 것으로 보여진다. Qi 등(2015)의 연구에서도 고사리 추출물 처리에 의해 HepG2 세포 내 MMP 감소와 cytochrome c의 세포질 내 발현이 증가, caspase 활성 증가를 확인하였으며, 이를 통해서 고사리 추출물에 의한 apoptosis가 mitochondrial related caspase pathway의 활성화에 의해 유도된다고 보고하였다.
HepG2 세포에서 후코이단/이고들빼기 혼합물에 의한 apoptosis 유도가 p53과 bcl-2 family 발현 조절 여부에 의한 것인지를 확인하기 위해 HepG2 세포에 후코이단/이고들빼기 혼합물을 200, 250, 300 μg/mL 농도로 처리한 후 western blot을 이용하여 관련 단백질 발현 정도를 확인하였다. p53과 bcl-2 family인 Bcl-2와 Bax에 대한 발현을 확인한 결과, p53은 무처리군에 비해 후코이단/이고들빼기 혼합물 처리군은 149, 331, 669% 발현이 증가하였고, Bcl-2는 22, 48, 50% 발현이 감소하였으며 Bax는 63, 116, 103% 발현이 증가하였다(Fig. 4). 후코이단만 300 μg/mL 농도로 처리한 군은 423% 발현이 증가하였고, Bcl-2는 30% 발현이 감소하였으며 Bax는 72% 발현이 증가하였다.
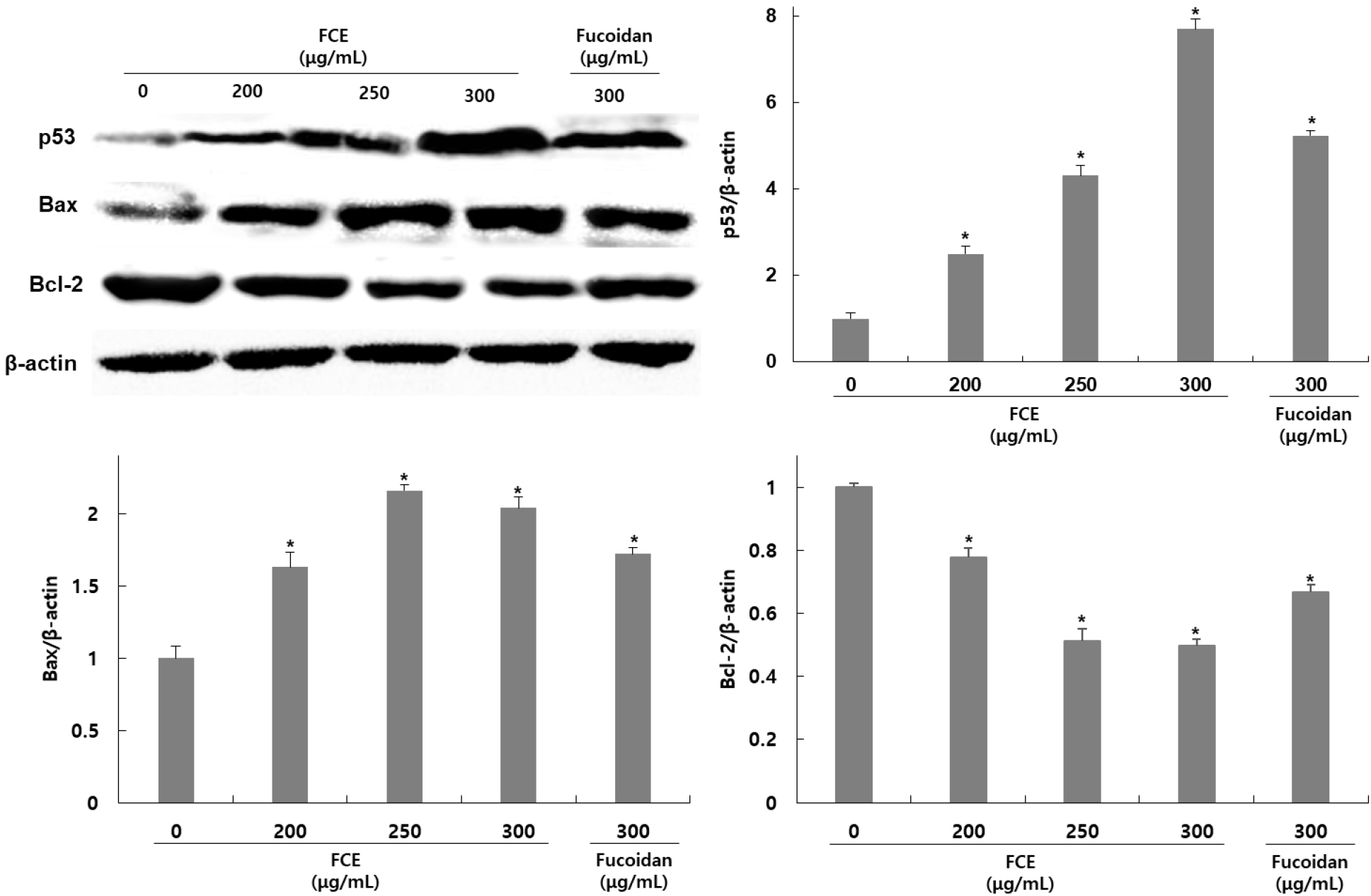
대표적인 종양 억제유전자인 p53은 외부 자극으로 인해 세포 손상과 함께 DNA 손상이 나타나면 Bcl-2 family의 발현 조절을 통해 apoptosis를 촉진하는 것으로 알려져 있다. Bcl-2 family에는 apoptosis를 유도하는 Bax, Bad, Bid, Bak 등의 단백질들과 apoptosis를 억제하는 Bcl-2, Bcl-xL, Bcl-xL 등의 단백질들이 포함된다. 그 중 Bcl-2는 Bax와 dimer 형태로 결합하여 존재하며 apoptosis를 억제하지만, p53의 발현 증가로 인해 Bcl-2로 분리된 Bax는 미토콘드리아로 이동하여 permeability transition pore의 개방을 유도한다. 이로 인해 세포질 내로 cytochrome c를 방출시켜 apoptosome을 형성하여 caspase의 활성화를 유도해 최종적으로 apoptosis를 유발한다. Kim 등(2012)의 연구에 의하면 목향 에탄올 추출물을 HepG2 세포에 처리하였을 때 Bax와 p53의 발현은 증가했지만 Bcl-2의 발현은 감소하였을 때 cleaved-caspase-3의 발현이 증가하였고, Kim 등(2016)의 연구에서도 개똥쑥 추출물을 HepG2 세포에 처리하였을 때 미토콘드리아의 탈분극과 Bax와 p53의 발현은 증가했지만 Bcl-2의 발현은 감소하였을 때 cleaved-caspase-3의 발현이 증가하며 세포 사멸이 증가하였다. 이러한 결과를 볼 때 후코이단/이고들빼기 혼합물은 HepG2 세포내 p53, Bax, Bcl의 발현 조절을 통해 미토콘드리아의 탈분극과 함께 caspase를 활성화시켜 apoptosis를 유도하였을 것으로 판단된다.
HepG2 세포에서 후코이단/이고들빼기 혼합물이 apoptosis를 유도하는 initiator인 caspase-9과 effector caspase인 caspase-3의 발현에 미치는 영향을 확인하기 위해 HepG2 세포에 후코이단/이고들빼기 혼합물을 200, 250, 300 μg/mL 농도로 처리한 후, western blot을 이용하여 관련 단백질 발현 정도를 확인하였다. Cleaved-caspase의 발현 변화를 확인한 결과, cleaved-caspase-9의 경우 무처리군에 비해 후코이단/이고들빼기 혼합물 처리군은 185, 204, 249% 발현이 감소하였고, caspase-3는 81, 204, 289% 발현이 증가하였다(Fig. 5A). 후코이단만 300 μg/mL 농도로 처리한 군에서는 cleaved-caspase-9은 166%, cleaved-caspase-3는 108% 발현이 증가하였다. 또한, caspase-3 activity를 colorimetric assay kit을 사용하여 측정한 결과에서도 무처리군에 비해 후코이단/이고들빼기 혼합물 처리군에서 19, 34, 65%로 활성이 증가하였으며, 후코이단만 처리한 구에서는 49%로 활성이 증가하여 후코이단/이고들빼기 혼합물 처리에 비해 낮은 활성을 나타냈다(Fig. 5B).
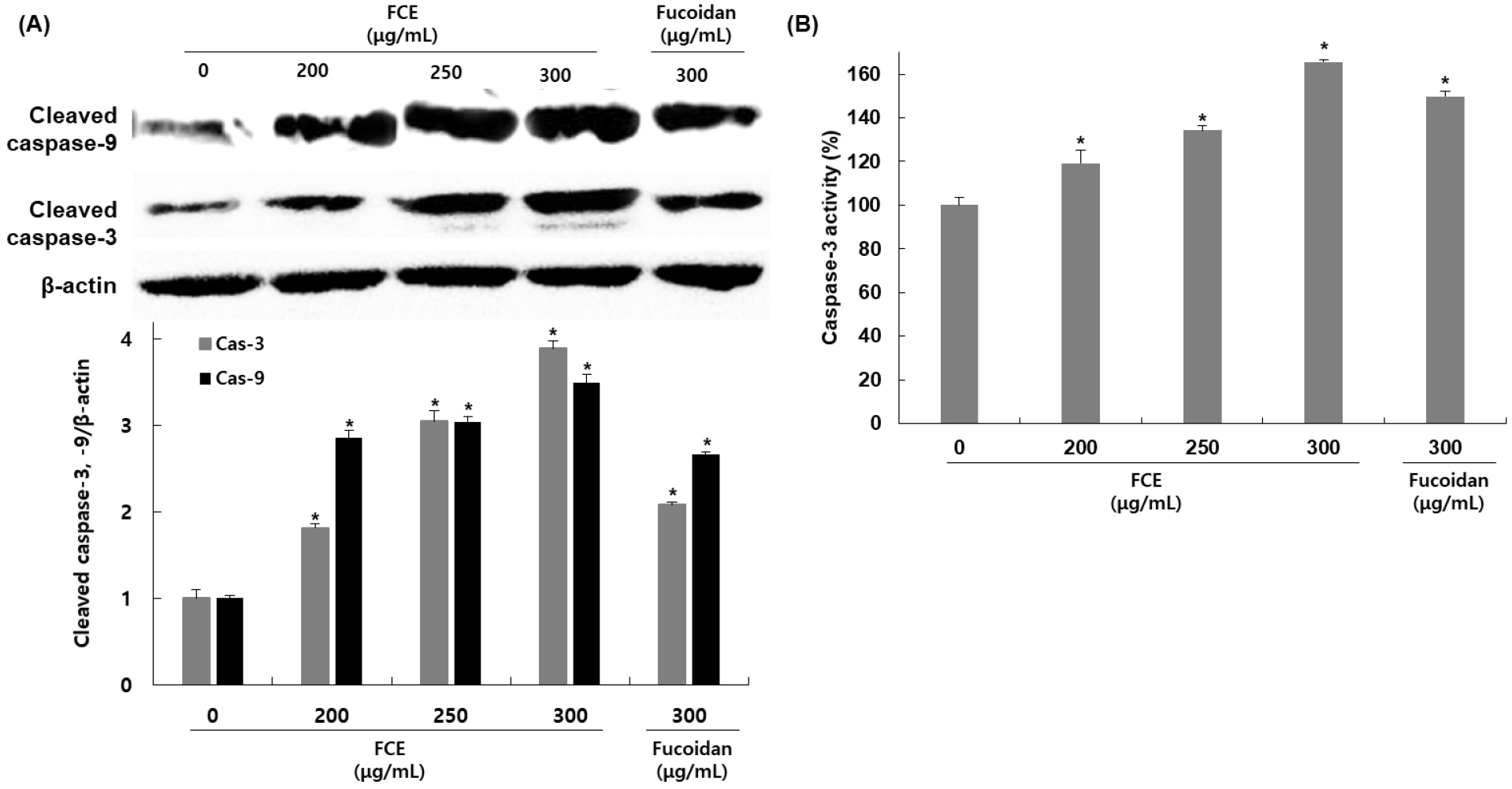
Apoptosis 핵심 매개자로 aspartate-specific cysteine related proteases의 일종인 caspase는 세포가 정상적으로 생존 및 증식하는 경우에는 비활성화된 상태의 procaspase 형태로 핵과 mitochondria의 외막에 존재하다가 apoptosis를 유도하는 다양한 자극으로 인해 활성화되면 active protease 형태로 분절되어 aspartic acid 부위만을 선택적으로 절단하여 세포 내 존재하는 단백질들을 분해하며 apoptosis를 유도한다. Caspase들 중 caspase-9은 세포질로 방출된 cytochrome c에 의해 만들어진 apoptosome에 의해 활성화되어 effector caspase인 caspase-3를 활성화시킨다. 활성화된 caspase-3는 PARP, lamin A/C 및 MEKK 및 다른 caspase 등의 단백질에 작용하여 apoptosis를 유도하게 된다. 이러한 근거를 바탕으로 caspases의 활성에 미치는 후코이단/이고들빼기 혼합물의 영향을 조사한 결과, initiator caspase인 caspase-9뿐만 아니라, 대표적인 effector caspase인 caspase-3도 후코이단/이고들빼기 혼합물 처리에 의해 활성이 증가함을 확인하였으며, 이는 후코이단/이고들빼기 혼합물이 caspase의 활성 증가에 중요한 역할을 하며, p53의 발현과 Bcl-2 family의 변화를 유도하여 caspase-9, −3와 관련된 경로를 경유하는 intrinsic apoptosis를 유발하는 것으로 판단된다. Harakeh 등(2023)의 연구에 의하면 trans-Anethole에 의한 apoptosis에서 HepG2 세포에 처리하였을 때 p53과 caspase-9 및 −3의 활성이 증가함을 확인하였으며, 또한, He 등(2023)의 연구에서도 사차인치의 peptide fraction을 처리에 의한 apoptosis를 확인한 결과, p53 및 Bax의 발현 증가와 Bcl-2의 발현 감소를 나타냈으며, caspase-9, −8, 3의 활성 또한 농도 의존적으로 증가함을 확인하였다.
이상의 결과들로 HepG2 세포에서 후코이단/이고들빼기 혼합물 처리에 의한 세포 증식 억제 및 DNA fragmentation 증가, MMP 감소 및 세포질 내 cytochrome c 증가는 apoptosis 증가와 연관되어 있으며, 이러한 apoptosis 증가는 p53의 발현 증가와 Bcl-2 family 단백질들의 발현 변화뿐만 아니라 caspase의 활성 증가를 통해 이루어진 것을 확인하였다. 또한 후코이단 단독 처리보다 후코이단/이고들빼기 혼합물에서 간암세포인 HepG2 세포의 증식을 억제하는 효과가 더 높게 나타났으며 이는 이고들빼기가 비인두암, 유방암, 신장암, 자궁경부암 등에서 apoptosis 유도하는 것으로 알려진 페놀 화합물인 chlorogenic acid, caffeic acid, hydroxycinnamic acids, luteolin-7-O-glucoside 등을 포함하고 있어, 후코이단과 복합물을 제조하여 처리할 경우 이고들빼기가 가지고 있는 페놀성 화합물들에 의해 시너지 효과를 나타내며 후코이단의 apoptosis 유도 효과가 증가하는 것으로 판단된다. 따라서 후코이단/이고들빼기 혼합물이 apoptosis 유도를 증가시키는 효과를 가지고 있으며, 이로 인해 간암세포 사멸을 유도하여 증식을 억제시킬 수 있을 것으로 사료된다.
4. 요약
본 연구에서는 후코이단/이고들빼기 혼합물이 HepG2 세포의 apoptosis에 미치는 영향을 확인하고 어떠한 경로를 통해 나타나는지를 조사하였다. 후코이단/이고들빼기 혼합물이 HepG2 세포의 증식을 억제하고 세포 독성을 나타냈다. 이러한 HepG2 세포의 증식 억제 및 세포 독성이 apoptosis에 의한 효과인지를 확인한 결과, DNA fragmentation과 mitochondria membrane potential의 저해를 일으키는 것을 확인하였다. 이러한 결과를 바탕으로 HepG2 세포에서 후코이단/이고들빼기 혼합물이 apoptosis를 유도하는 기전에 관여하는 단백질의 발현 양상을 확인한 결과, intrinsic apoptosis 경로인 p53을 증가시키고, Bcl-2 family인 Bcl-2의 억제 및 BAX의 증가를 통해서 cytochrome c를 증가시켜 caspase-9 활성화하였고, caspase-3를 활성화시켜 결과적으로 apoptosis를 유도하였다. 또한, 전반적으로 후코이단/이고들빼기 혼합물의 apoptosis 유도 효과는 후코이단만 처리한 것보다 더 높은 효과를 나타냈으며, 이는 이고들빼기 추출물과의 혼합물 제조를 통해서 후코이단의 apoptosis 유도 효과가 증대되는 것으로 판단된다. 이러한 결과는 후코이단/이고들빼기 혼합물이 HepG2 세포에서 apoptosis 관련 유전자의 발현 조절에 의해 항암 효과를 나타내며, 이는 후코이단/이고들빼기 혼합물의 항암 작용의 기전을 해석하였을 뿐만 아니라, 이러한 기전 연구를 바탕으로 실질적인 간암 치료제로서의 사용 가능성을 확인하기 위해서는 유용 물질 분석 및 in vivo에서 추가 실험 등이 다양하게 수행되어야 할 것으로 판단된다.











